江西及周边地区神经系统疾病患者博尔纳病毒感染的分子流行病学研究*
2018-04-10吴伟谢洪武谢亮黄孝天谢鹏
吴伟,谢洪武,谢亮,黄孝天,谢鹏
(1.南昌大学第二附属医院 神经内科,江西 南昌 330006;2.江西中医药大学附属医院针灸康复科,江西 南昌 330006;3.南昌大学 基础医学院,江西 南昌 330006;4.重庆医科大学附属第一医院 神经内科,重庆 400016)
博尔纳病毒(borna disease virus, BDV)是一种以非细胞溶解性,负链单股RNA为特点的严格的嗜神经病毒,其自然感染以马和羊为主,可能通过内源性干扰素和介导磷蛋白酶等环节参与[1-2]。在我国一些地域已有散在报道[3-5],但江西及周边环鄱阳湖地区尚未系统性研究。鄱阳湖是世界上最大的鸟兽类保护区之一,BDV与病毒性脑炎(virus encephalitis,VE)、多发性硬化(multiple sclerosis,MS)、吉兰-巴雷综合征(guillain barre syndrome,GBS)、帕金森(parkinson disease,PD)等神经精神类疾病密切相关[6]。因此,本实验采用聚合酶链反应(PCR)检测该地区患者、健康受试者以及山羊外周血液中BDV p24,进行相关比较研究[7-10]。
1 资料与方法
1.1 研究对象
选取2008年8月-2013年8月在南昌大学第二附属医院神经内科住院及门诊的患者。所有研究对象系地处江西及其周边地区。①30例VE患者,通过其临床表现、脑脊液和血液常规生化检测,以及细胞学、脑电图、影像学等检查,确诊为VE,并行单纯疱疹病毒、EB病毒等的特异性抗体检测,筛选剔除经病原学诊断不明确者。其中男性20例,女性10例;年龄20~45岁,平均(28.7±4.3)岁。②10例临床确诊MS患者,男性6例,女性4例;年龄18~46岁,平均(28.4±3.7)岁。③10例临床确诊GBS患者,男性7例,女性3例;年龄20~48岁,平均(29.2±3.4)岁。④10例临床确诊PD患者,男性5例,女性5例;年龄46~74岁,平均(62.1±4.3)岁。选取江西及其周边地区健康且自愿献血的对照组患者60例,男性38例,女性32例;年龄20~55岁,平均(34.7±3.6)岁。采集江西及其周边地区60只山羊外周血液单个核细胞(peripheral blood mononuclear cells,PBMC)。
1.2 主要试剂和仪器
引物和荧光探针序列由中山大学达辉基因诊断中心合成,从GenBank中调取出BDV的第二开放阅读框(ORFⅡ)区的序列,根据引物设计的原则,设计扩增BDV p24基因片段的引物序列。
外引物为正向引物:5'-TGACCCAACCAGTAGAC CA-3'(nt 1 443~146 119 bp),反向引物:5'-GTCCCAT TCATCCGTTGTC-3'(nt 1 816~183 419 bp)。内引物为设计正向引物:5'-CCCTCCAAGTGGAAACCAT-3'(nt 1 609~161 719 bp),设计反向引物:5'-CAGTATCTTG ATGTTCTCGCCA-3'(nt 1 673~169 422 bp)。设计荧光探针:5'-FAM-TCAGCGGTGCGACCACTCCGATAGCTAMRA-3'(nt 1 637~166 125 bp),5'标记物为 6- 羧基荧光素,3'标记物为4-甲基罗达明,其扩增的目的基因片段长度是86 bp。其中ABI7500的荧光定量PCR仪器系美国应用生物系统公司出产。
1.3 方法
1.3.1提取目的细胞的RNA每例研究对象的外周血液标本严格按操作规程采集5 ml,用Ficoll-conray液分离出PBMC,然后用TriPure RNA提取试剂盒(德国Boehring-Mannheim公司)提取目的细胞总的RNA物质,再将标本置于-70℃冰箱中保存[3-5]。
1.3.2巢式逆转录聚合酶链反应(nRT-PCR)及实时荧光定量聚合酶链反应(qRT-PCR)在进行常规nRT-PCR操作时,在第2轮行扩增PCR反应的混合物体系中加入特异性寡核苷酸探针(荧光基团标记)而行qRT-PCR反应。首先进行逆转录反应操作,取反应体积系11μl,其含逆转录体系的9μl、外引物1对各0.5μl,予以逆转录酶的MMLV 1μl,在37℃恒温持续1 h后,95℃ 3 min行灭活逆转录酶操作。取逆转录反应后的反应液10μl,加外引物1对各1μl,dNTP 物 1μl,浓度为 25 mmol/L 的 MgCl2溶液 10μl,取Taq DNA聚合酶2μl,其总体反应体积为50μl。过程中的第1轮PCR反应条件:94℃预变性2 min;94℃变性1 min,55℃退火1 min时间,72℃延伸1 min,共40个循环,72℃继续延伸7 min;而第2轮PCR反应体积系50μl,其中含第一轮扩增产物5μl,dNTP物1μl,Taq DNA聚合酶2μl,浓度为25 mmol/L的MgCl2溶液10μl,内引物1对各1μl,目的荧光探针lμl[3-5]。反应体系的条件:93℃预变性2 min,93℃变性45 s时间,55℃退火1 min,共10个循环;93℃变性30 s,55℃退火45 s,共30个循环。β-actin系小分子蛋白物,特点是易于扩增,因此检测每份标本的同时予以检测阻β-actin作为内参对照,以证明其参与反应的RNA完整性,并且每次实验设阴性对照以明确区分[3-5]。
1.3.3目的BDV p24基因的cDNA片段克隆与测序 在阳性PCR反应产物中用醋酸钠、乙醇沉淀法纯化后与目的T载体相连接,进而转化成目的大肠埃希菌,并采用公认的蓝白斑及菌落qRT-PCR鉴定法筛选目的基因的重组子,在每一标本操作的同时收集其阳性菌落进行培养。集菌中提取质粒DNA,然后再用qRT-PCR方法进行鉴定操作,并把阳性质粒重组子送至广东省广州市达辉生物工程有限公司进行测序鉴定明确[3-5]。
1.4 统计学方法
数据分析采用SPSS 19.0统计软件,计数资料以率表示,用χ2检验或Fisher确切概率法,P<0.05为差异有统计学意义。
2 结果
2.1 nRT-PCR和qRT-PCR扩增PBMC中BDV p24基因片段的检测结果
神经系统疾病患者的PBMC中BDV p24基因片段的检出率为15.00%(9/60),其中VE患者为20.00%(6/30)、MS患者为30.00%(3/10),但在GBS和PD患者及健康受试者中均未检出,山羊的BDV p24基因片段阳性率为1.67%(1/60)。VE和MS患者与健康受试者的PBMCs BDV p24基因片段检出率比较,差异有统计学意义(P<0.05),VE和MS患者高于健康受试者。山羊目的BDV p24基因片段的阳性率为1.67%,与健康受试者比较,差异无统计学意义(P>0.05)。见附表。

附表 PBMC BDV p24基因片段检出率比较
2.2 阳性PCR反应产物BDV p24基因片段的目的序列测定及其同源性
测序的结果经BLAST软件分析后证明其确实系目的BDV p24基因片段,而与GenBank所提供的马源性标准毒株比较,VE患者和MS患者目的BDV p24基因片段测序的结果相一致,而与strain V毒株同源性比较为95.73%,其中有3个基因位点出现一致性的沉寂突变(nt 1650T-C位点、nt 1671C-T位点、nt 1692C-A位点,其突变率为3.13%);而与BDV/MDCK毒株同源性比较为97.89%,其有2个基因位点出现一致性的沉寂突变(nt 1674C-T位点、nt 1677T-C位点,其突变率为2.09%);而与C6BV毒株比较有2个基因位点出现一致性的沉寂突变(nt 1659T-C位点、nt 1671C-T位点,其突变率为2.13%)。山羊中目的BDV p24基因片段测序的结果与GenBank所提供的strain V毒株同源性比较为95.72%,其有3个基因位点出现一致性的沉寂突变(nt 1609C-A位点、nt 159T-C位点、nt1661C-T位点,其突变率为3.16%),与BDV/MDCK毒株同源性比较为96.38%,其有3个基因位点出现一致性的沉寂突变(nt 1609 A-C位点、nt 1674 C-T位点、nt 1677 T-C位点,其突变率为3.18%);与C6BV毒株同源性比较为96.49%,其有3个基因位点出现一致性的沉寂突变(nt 1609 C-A位点、nt 1659 T-C位点、nt 1661 C-T位点,其突变率为3.12%),但其所编码的氨基酸并没有实质性改变。山羊中目的BDV p24基因片段测序与GenBank所提供strain V毒株、BDV/MDCK毒株、C6BV毒株相互比较,同源性极高,均<95.0%,差异无统计学意义(P=0.967),提示其所编码的氨基酸未有实质性的改变。山羊中的BDV p24基因片段测序与GenBank所提供strain V毒株、BDV/MDCK毒株、C6BV毒株同源性比较极高且均<95.0%,差异无统计学意义(P=0.962),其所编码的氨基酸未有实质性的改变。见图1。
2.3 BDV的系统发生树分析
应用Clustal X 1.83软件,把所测得的VE、MS患者和山羊的PBMC3者目的基因序列与GenBank所提供的国内外30个病毒毒株进行序列比较,绘制BDV的系统发生树。3者的基因序列目的基因片段和strain V、BDV/MDCK、C6BV毒株核苷酸序列的亲缘关系最近,同源性分别为95.72%、96.38%和96.49%。见图2。
2.4 研究对象所采集神经系统疾病、健康受试者及山羊区域空间分布
尽管本实验研究的样本含量较小,但基本能反映江西及周边环鄱阳湖地区区域的样本特点。见图3。

图1 VE、MS患者、山羊与马的目的BDV p24核苷酸序列(86 bp)比较
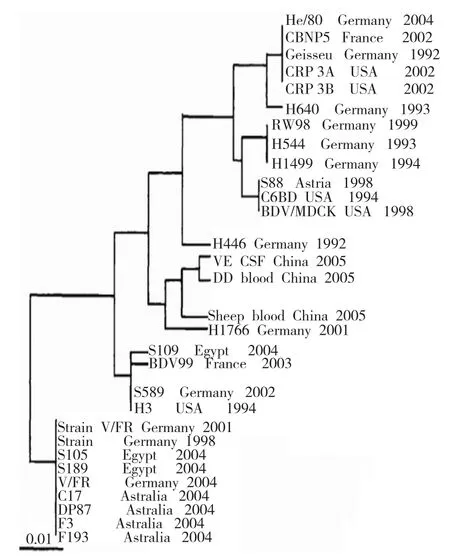
图2 BDV的系统发生树

图3 研究对象所采集神经系统疾病、健康受试者及山羊区域空间分布
3 讨论
近年在我国部分地区的VE、PD、GBS等神经系统疾病患者的血液和脑脊液中均检测出BDV p24基因片段[3-5]。在现有的各种检测方法中,病毒分离法被公认为金标准,但感染BDV时病毒含量很低,需要新鲜的脑组织,操作费时费力,极不利于临床普遍筛查和流行病学的统计;而p24具有较高的可操作性、敏感性、特异性、简便性、快捷性及重复性,且常规实验前无需对标本进行加热灭活或特殊的吸收处理等复杂的过程,能够快速而准确地监测整个感染进程,及时准确地说明这些疾病患者是否确实存在BDV感染的情况。我国对BDV的研究尚属起步阶段,尚需密切深入开展BDV感染的分子流行病学、临床流行病学和现场调查等方面的研究,为预防和控制BDV的暴发或流行提供理论依据和数据、技术支撑[3-5]。nRTPCR和qRT-PCR检测研究对象的血中病毒RNA,采用的是荧光技术并实行完全闭的管式操作,能极大地减少扩增产物被污染的机会,提高检测的特异性和敏感性,在用于BDV检测方面具备较高的研究和使用价值[7-10]。
本研究采用nRT-PCR和qRT-PCR技术检测江西及周边地区8个县(市)在南昌大学第二附属医院神经内科就诊的VE、MS、GBS患者及与之相匹配地区的山羊PBMC。研究对象所属区域限于客观条件,样本含量较小,但基本能反映江西及周边地区流行病地域特征,检测的结果与国内外的同时期实验结果比较,江西及周边地区人BDV的感染率增高[7-10]。分析可能主要与以下因素有关:①RNA提取或保存过程中,降解产物而出现假阴性;②实施nRT-PCR和qRT-PCR过程中扩增引物出现一定的污染。BDV的感染具有一定的地域性,不同的地区感染率可能不同,感染存在动物疫源性等特点[11-12]。江西及周边地区以农业发展为主,地处环鄱阳湖地域,禽兽类物种丰富,每年从俄罗斯西伯利亚、蒙古、日本、朝鲜以及中国东北、西北等地的大批外源性动物迁徙来此过冬。周围地区的人与动物的接触较多且卫生条件相对较差,因此人发生感染的机会相对较大。山羊中BDV p24阳性基因片段的检出率比其他动物如绵羊、马和牛较低,可能是该地区的山羊自然感染率低的原因,一定程度上也说明其存在地区和物种差异。从测序的结果看,VE和MS患者的BDV p24基因阳性片段序列相同,与GenBank提供的strain V、BDV/MDCK、C6BV毒株核苷酸序列亲缘关系具有高度的同源性,而山羊的BDV p24基因阳性片段序列和VE、MS患者同源性配比率高,突变率低,且编码的氨基酸没有实质性改变。虽然BDV的生物学标志研究中已发现许多值得重视和期待的指标,但是BDV本身就是一种由多种因素所导致的临床复杂现象,不仅受到一些相关因素的影响和作用,而且又有多个系统的相互协调,目前相关研究大多数局限于针对某一个方面进行深入的探讨,样本含量较小,且所得结果不尽一致,有时还相互矛盾。
从系统分析树的分析表明VE患者、MS患者和山羊的PBMC目的基因片段同德国的strain V来源于1个分支,说明BDV的流行有地域的局限性,但山羊尚可能存在BDV自然疫源性感染,而人感染BDV具有动物源性[11-12]。本研究还表明,BDV可能是新发感染性疾病中的一种病原体,与人类某些神经系统疾病的发生可能存在密切关系,因此对BDV的分子流行病学的研究有着重要的临床意义,如果不加以重视BDV的流行生物学行为,将可能给人类和动物造成不可预知的风险。通过这方面的初步探索工作,对江西及周边地区某些神经系统疾病患者中BDV感染情况作出一个比较粗浅的流行病学调查,BDV可能存在动物源性,博尔纳病是病毒性的传染病,考虑通过完善其抗原、抗体检测而进行疫苗的接种和预防,但是博尔纳病的人工免疫接种方法目前尚未取得成功,考虑到其以细胞免疫机制介导为主,弱毒疫苗研制具有一定的应用前景。进一步的抗原、抗体检测,如抗原阳性提示急性期感染,应予以相应的抗病毒治疗,研究中的样本应继续扩大,将抗原、抗体、循环免疫复合物同时检测,为临床的诊断及指导治疗提供更有力的依据。因此,在以后的研究过程当中,当进一步增加样本含量,改善或杜绝因检测技术的异质性所带来的影响,用系统神经生物学的方法,研究多个系统之间或系统内部多个因素之间的相互关系,再与神经影像学和分子生物学等最新的技术有机结合尽可能地揭示其发病的机制。
参 考 文 献 :
[1]QIAN J, ZHAI A, KAO W, et al. Modulation of miR-122 on persistently Borna disease virus infected human oligodendroglial cells[J]. Antiviral Res, 2010, 87(2): 249-256.
[2]ZHAI A, QIAN J, KAO W, et al. Borna disease virus encoded phosphoprotein inhibits host innate immunity by regulating miR-155[J]. Antiviral Res, 2013, 98(1): 66-75.
[3]邹德智, 谢鹏, 徐平, 等. 重庆地区精神疾病患者Borna病病毒感染的初步报道[J]. 中华精神科杂志, 2003, 36: 228-230.
[4]王振海, 谢鹏, 韩玉霞, 等. 宁夏及周边地区博尔纳病病毒感染的分子流行病学研究[J]. 中华流行病学杂志, 2006, 27: 479-482.
[5]王长明, 徐平, 葛均江, 等. 遵义市及周边地区博尔纳病毒感染的分子流行病学研究[J]. 中华流行病学杂志, 2008, 29: 1213-1216.
[6]ZHANG L, XU M M, ZENG L, et al. Evidence for Borna disease virus infection in neuropsychiatric patients in three western China provinces[J]. Eur J Clin Microbiol Infect Dis, 2014, 33(4): 621-627.
[7]LIPKIN W I, HORNIG M, BRIESE T, et a1. Borna disease virus and neuropsychiatric disease are appraisal[J]. Trends Microbiol,2001, 9: 295-298.
[8]KOLODZIE J, DURRWALD R, HEZOG S, et a1. Genetic clustering of Borna disease virus animal isolates, laboratory and vaccine strains strongly reflects their regional geographical origin[J]. J Gen Virol, 2005, 86: 385-398.
[9]MIRANDA H C, NUNES S O, CALVO E S, et a1. Detection of Boma disease virus p24 RNA in peripheral blood cells from Brazilian mood and psychotic disorder patients[J]. J Affect Disord,2006, 90: 43-47.
[10]HAGIWARA K, TSUGE Y, ASAKAWA M, et a1. Borna disease virus RNA detected in Japanese acaques[J]. Primates, 2008, 49:57-64.
[11]WENSMAN J J, THOREN P, HAKHVERDYAN M, et al.Development of a real-time RT-PCR assay for improved detection of Boma disease virus[J]. J Virol Methods, 2007, 143: 1-10.
[12]WATANABE Y, IBRAHIM M S, HAGIWARA K, et a1.Characterization of a Borna disease virus field isolate which shows ef fi cient viral propagation and transmissibility[J]. Microbes Infect, 2007, 9: 417-427.
