养猪微生物发酵床真菌空间分布特性研究*
2018-04-09肖荣凤朱育菁阮传清刘国红王阶平
肖荣凤, 刘 波, 朱育菁, 阮传清, 刘国红, 王阶平
(福建省农业科学院农业生物资源研究所 福州 350003)
微生物发酵床大栏养猪是利用垫料吸收养殖过程中排泄的猪粪尿, 通过微生物进行原位发酵, 分解消纳, 去污除臭, 实现了畜禽养殖的清洁环保的一种生态养殖模式[1]。发酵床是由微生物和垫料共同组成的一个复杂的微生态环境[2]。垫料可提供碳氮源、调节床体基质的孔隙度并维持发酵床体温湿度等, 且含有丰富的有机质, 为微生物的繁殖创造了条件, 有利于粪尿发酵与分解[3]。发酵床中的微生物可来源于发酵床垫料基质、动物体、饲料、水源和空气等, 微生物及其群落动态变化在垫料发酵和使用过程中起着非常重要的作用[4]。通过对发酵床中垫料微生物群落结构分析发现, 细菌是优势种群、放线菌次之、真菌数量最少[5-6]。目前关于垫料微生物的研究主要集中于优势种群细菌方面。周学利等[7]分析了发酵床养猪模式中猪肠道与垫料间的菌群相关性, 宦海琳等[2]研究了不同垫料组成对猪用发酵床细菌群落的影响, 刘国红等[8]研究了养猪微生物发酵床芽胞杆菌的空间分布多样性。相关的研究均表明, 发酵床细菌对降解猪粪、抑制病原、清除臭味等方面具有一定的积极作用。
真菌是生态系统中的重要组成部分, 包含有益真菌和病原真菌, 它们共同构成了真菌的多样性。许多真菌是有机物的分解者, 是转换营养物质和有效成分的主要因素, 分布广泛并能有效地促进物质循环[9]。真菌种类组成和数量不是一成不变的, 在自然界中会随着空间结构和时间结构呈现动态变化[10-11]。关于微生物发酵床中真菌总数量的变化, 郑雪芳等[5]研究表明, 在微生物发酵床中真菌脂肪酸总数量随垫料使用时间的延长呈逐渐减少趋势, 垫料中由上至下的真菌脂肪酸总数量也逐渐减少; 龚俊勇等[12]的研究表明, 从水帘端到风机端的水平方向上, 垫料中的真菌总数量差异显著。关于微生物发酵床中真菌种类的研究, 目前仅对垫料中部分真菌的种类进行了分离鉴定, 如分离到丝状真菌曲霉菌、青霉菌和镰刀菌等[13-15]。关于微生物发酵床真菌空间分布多样性的研究少见报道。
真菌的种群多样性、群落结构组成和生态位特征是评价其所在生态系统健康稳定的重要指标之一[16-17]。微生物发酵床垫料中不同真菌种类具有猪粪分解、臭味吸附和猪病防控等功能特性, 同时也可能存在部分危害猪健康的种类, 如黄曲霉菌等。因此, 本研究以2 100 m2的大栏养猪微生物发酵床为研究对象, 通过空间格局采样, 分离鉴定垫料中的真菌种类与数量, 利用空间分布频次、空间分布型指数、多样性指数和生态位特征等指标, 评估发酵床真菌种群的空间分布特性, 为养猪发酵床管理、猪粪资源化利用、猪病防控等提供理论依据。
1 材料与方法
1.1 样品来源
样品采自福建省农业科学院福清现代设施农业样本工程示范基地已使用约1年半的大栏养猪微生物发酵床垫料。该大栏发酵床猪场建筑面积为2 100 m2(长60 m, 宽35 m), 养殖面积为1 600 m2, 发酵床深度80 cm, 发酵床垫料由70%椰糠和30%谷壳组成。发酵床饲养1 600头育肥猪, 饲养密度为1头·m-2。
1.2 样品采集方法
将大栏发酵床横向划分8列(记为1、2、3、4、5、6、7和 8), 纵向划分 4行(记为 A、B、C 和 D), 共32个小栏, 每小栏的面积为50 m2, 采样格局平面图见图1。根据前期研究, 15~20 cm深度垫层中的真菌数量最多[5], 因此, 每个小栏采用五点取样方法, 采集15~20 cm处样品, 均匀混合后取1 000 g装入无菌聚氯乙烯塑料瓶, 样品分别标记为1-A、1-B、1-C、1-D、2-A、…、8-D, 带回实验室, 并立即进行真菌的分离与保存。

图1 微生物发酵床猪舍取样点示意图Fig. 1 Sampling points of the microbial fermentation bed of pigsty
1.3 仪器与试剂
PCR仪和凝胶成像分析仪(Bio-Rad公司); 恒温培养箱(BI-250AG)购自施都凯仪器设备(上海)有限公司; 2×PCR Master Mix购自上海铂尚生物技术有限公司; 引物由上海铂尚生物技术有限公司合成。
真菌分离培养基: 含300 μg·mL-1硫酸链霉素的马铃薯葡萄糖琼脂培养基(PDA), 查氏琼脂培养基(CA)和查氏酵母培养基(CYA)。
1.4 微生物发酵床真菌的分离、鉴定
1.4.1 真菌的分离方法
分别取10 g均匀混合后的垫料样品与90 mL无菌水充分震荡, 吸取1 mL悬浮液梯度稀释后涂布于含300 μg·mL-1硫酸链霉素的PDA平板上, 设3个重复, 28 ℃培养3~7 d。根据平板上不同菌落形态的真菌单菌落分别计数统计, 并选取每个样品中不同的单菌落, 挑取菌落边缘的菌丝接种于PDA培养基上进行纯化培养5~7 d, 根据纯化后的菌落形态和色泽进行初步归类并编号保存。
1.4.2 真菌的鉴定
菌株鉴定采用形态学和分子鉴定相结合的方法。形态学鉴定: 曲霉属真菌参考齐祖同主编的《中国真菌志》第5卷[18]、青霉属真菌参考孔华忠主编的《中国真菌志》第35卷[19]; 其他真菌参考魏景超编著的《真菌鉴定手册》[20]。将纯化后的菌株用接种环蘸取孢子分别点接于PDA、CA和CYA平板上,于 28 ℃静置培养 3~7 d, 然后观察菌落形状、质地和颜色等特征, 每处理点接 3个平板。另取一接种后的平板, 待菌丝刚长出时, 将无菌的盖玻片斜插入平板内, 继续培养至孢子成熟, 取出盖玻片, 用酒精灯火焰进行固定; 滴上适量的苯胺蓝染色液,染色 1~2 h后于水中轻柔漂洗后晾干, 放在载玻片上, 于倒置显微镜下观察菌体的形态特征等。分子鉴定: 利用真菌I T S基因通用引物序列ITS4/ITS5(TCCTCCGCTTATTGATATGC/GGAAGT AAAAGTCGTAACAAGG)扩增[21], 其中部分曲霉属和青霉属真菌进一步利用BenA基因序列Bt2a/Bt2b(GGTAACCAAATCGGTGCTGCT TTC/ACCCTCAGTGTAGTGACCCTTGGC)进行验证[22]。采用真菌基因组DNA试剂盒(DP2032)提取各菌株的基因组DNA。PCR反应体系25 μL:BenA基因引物各 1 μL, 2×Power Taq PCR MasterMix(Bioteke)12.5 μL,无菌双蒸水9.5 μL, DNA 1 μL, 以无菌双蒸水作阴性对照; 扩增程序参考文献[21,23]。PCR产物经1.5%琼脂糖凝胶电泳检测后, 送交铂尚生物技术(上海)有限公司进行测序。将测得的序列在 NCBI数据库中进行BLAST搜索和同源性比对分析。结合形态学和分子鉴定结果, 将鉴定为同一属或种的菌株, 选择1株有代表性的菌株序列提交GenBank注册获得登录号。
1.5 微生物发酵床真菌种群空间分布格局
根据1.4的分离鉴定结果, 核对统计每个空间样本的真菌种类与数量。对每个空间坐标下的真菌种类与数量做总和统计, 依据每个空间样本所分离到的种类个数和数量大小划分为不同的等级, 由高到低分别用黑色、深灰色、浅灰色和白色表示真菌种类与含量空间格局色块, 并在相应的坐标位置标出所对应的空间格局色块, 直观比较不同样本的真菌种类与含量的空间分布特点。
1.6 微生物发酵床真菌种群空间频次分布和空间分布型
根据1.5绘制的统计表, 计算、统计发酵床中真菌种群出现的频次和数量。同时计算平均拥挤度(m*)、I指标、m*/m指标、CA指标、扩散系数(C)、负二项分布K指数和Taylor幂法则等空间分布型指数。获得的各项指数的数值依据表 1所列的各项指数判别原则, 分析发酵床真菌的空间分布型。
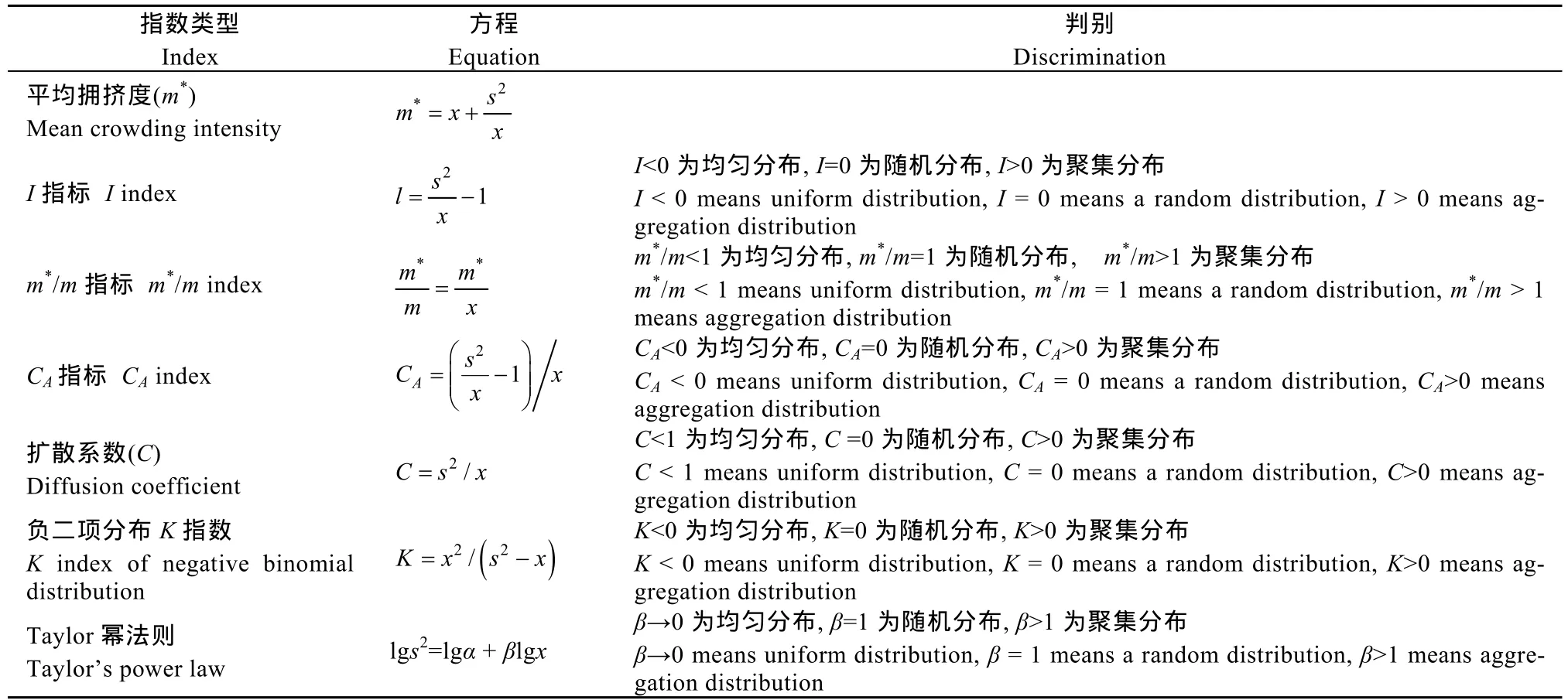
表1 猪舍微生物发酵床真菌种群的空间分布型指数Table1 Spatial distribution indexes of fungal population of microbial fermentation bed of pigsty
1.7 微生物发酵床真菌种群空间分布多样性指数
根据 1.5绘制的统计表, 计算发酵床不同空间样本的真菌丰富度指数(D)、均匀度指数(J')、优势度指数(λ)和香农指数(H')。多样性指数公式如下:

式中:Pi=Ni/N。Ni为第i种真菌的数量,S为真菌占据的单元总数,N为真菌种类个体总数。
1.8 微生物发酵床真菌种群空间分布生态位宽度与生态位重叠
根据 1.5绘制的统计表, 用 Levins生态位宽度公式和Pianka生态位重叠公式分别计算不同真菌种的生态位宽度和生态位重叠值。
1)Levins生态位宽度公式:
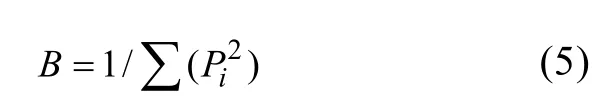
式中:Pi为利用资源i的个体比例。
2)Pianka生态位重叠公式(Oik):
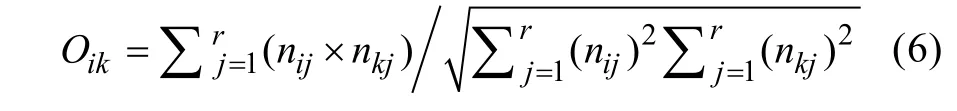
式中:Oik为真菌种类i和种类k的生态位重叠值,nij和nkj为真菌种类i和k在资源单位j中所占的个体比例,r为真菌种类个体总数。
1.9 数据处理与分析
采用 Microsoft Excel 2007 软件绘制每个空间样本的真菌种类与数量统计表; 采用 DPS 16.05统计分析软件[24]计算真菌种群空间分布频次和数量、空间分布型指数与多样性指数、生态位宽度与生态位重叠值。
2 结果与分析
2.1 微生物发酵床真菌的分离、鉴定
根据形态学和分子鉴定相结合的方法, 从32个空间样本中分离到真菌共计18个种类, 归于10个属(表2)。其中16个鉴定到种, 分别为: 亮白曲霉(Aspergillus candidus)、薛氏曲霉菌(A. chevalieri)、黄曲霉(A. flavus)、构巢曲霉(A. nidulans)、匍匐曲霉菌(A. repens)、聚多曲霉(A. sydowii)、土曲霉(A.terreus)、橘青霉(Penicillium citrinum)、爪哇正青霉(Eupenicllium javanicum)、短柄帚霉(Scopulariopsis brevicaulis)、黄帚霉(S. flava)、尖孢枝孢菌(Cladosporium oxysporum)、白地霉(Geotrichum candidum)、总状毛霉(Mucor racemosus)、水贼镰刀菌(Fusarium equiseti)和地衣镰刀菌(F. lichenicola)。2个种类鉴定到属, 分别为黑孢菌(Nigrosporasp.)和毛壳属菌(Chaetomiumsp.)。其中表2中的亮白曲霉、黄曲霉、构巢曲霉、聚多曲霉、土曲霉、橘青霉、爪哇正青霉等7个种的鉴定结果已另文发表[13-14]。
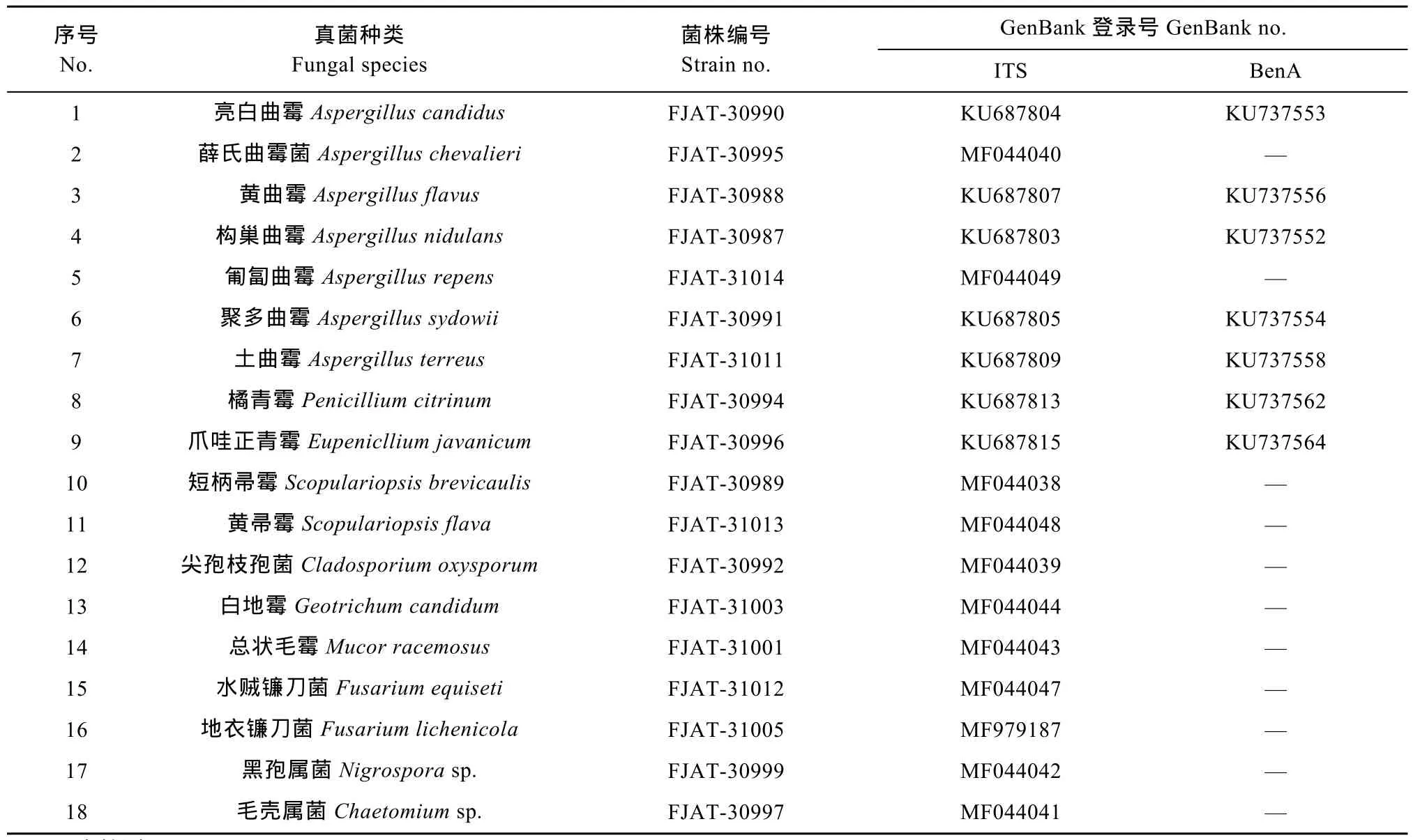
表2 猪舍微生物发酵床真菌的分离与鉴定Table 2 Isolation and identification of fungal species from microbial fermentation bed of pigsty
2.2 微生物发酵床真菌种群空间分布格局
32个空间样本的真菌种类与数量统计结果见表3。每个坐标下的真菌种类与数量的空间格局见图2。不同空间样本所分离到的真菌种类介于1~4种, 样本2-C和7-A的种类仅为1种, 2-B、3-A、3-B、4-A、5-C、6-C、6-D、7-D、8-C和 8-D等10个样本的种类为2种, 另有17个样本的真菌种类为3种, 1-B、2-D和3-C的种菌真类为4种。不同空间样本的真菌数量差异较大, 在4×102至5.8×105菌落·g-1之间, 真菌数量≥105菌落·g-1的样本有 3个, 分别为 1-A、1-B和 4-A, 其中 1-A样本菌数量最大, 总计达 5.8×105菌落·g-1; 真菌数量≥104且<105菌落·g-1的样本有 9个, 由高至低分别为4-C、1-D、8-D、4-D、1-C、5-A、5-B、5-C 和 8-A; 真菌数量≥103且<104菌落·g-1的样本有12个; 真菌数量≥102且<103菌落·g-1的样本有12个, 3-B、2-D、7-D、3-C、3-A、7-B、4-B、2-C、3-D、6-D、6-B 和 7-A; 真菌数量<102菌落·g-1的样本有8个, 分别是2-B、6-A、8-B、8-C、5-D、2-A、6-C和 7-C样本。总体而言, 第 1列的真菌种类多且数量大, 其次是第4和第5列, 而其他列的种类与数量呈不均匀分布。
2.3 微生物发酵床真菌种群空间分布频次
真菌种类与数量分布频次差异显著(图3)。分布频次方面, 有的种类仅出现在 1个样本中, 有的种类可现出在18个样本中。高频次分布的种有2个, 分别为总状毛霉和橘青霉, 在 10个以上的样本中出现; 中频次分布的种有4个, 分别为构巢曲霉、尖孢枝孢菌、地衣镰刀菌和匍匐曲霉菌, 可在6~9个样本中出现; 低频次分布的种有12个, 分别为黄曲霉、黑孢菌、白地霉、短柄帚霉、黄帚霉、聚多曲霉、毛壳属菌、爪哇正青霉、亮白曲霉、薛氏曲霉菌、土曲霉霉和水贼镰刀菌等, 仅在1~5个样本中出现。曲霉属为优势属, 共分离到7个种, 分布频次总计达25次。
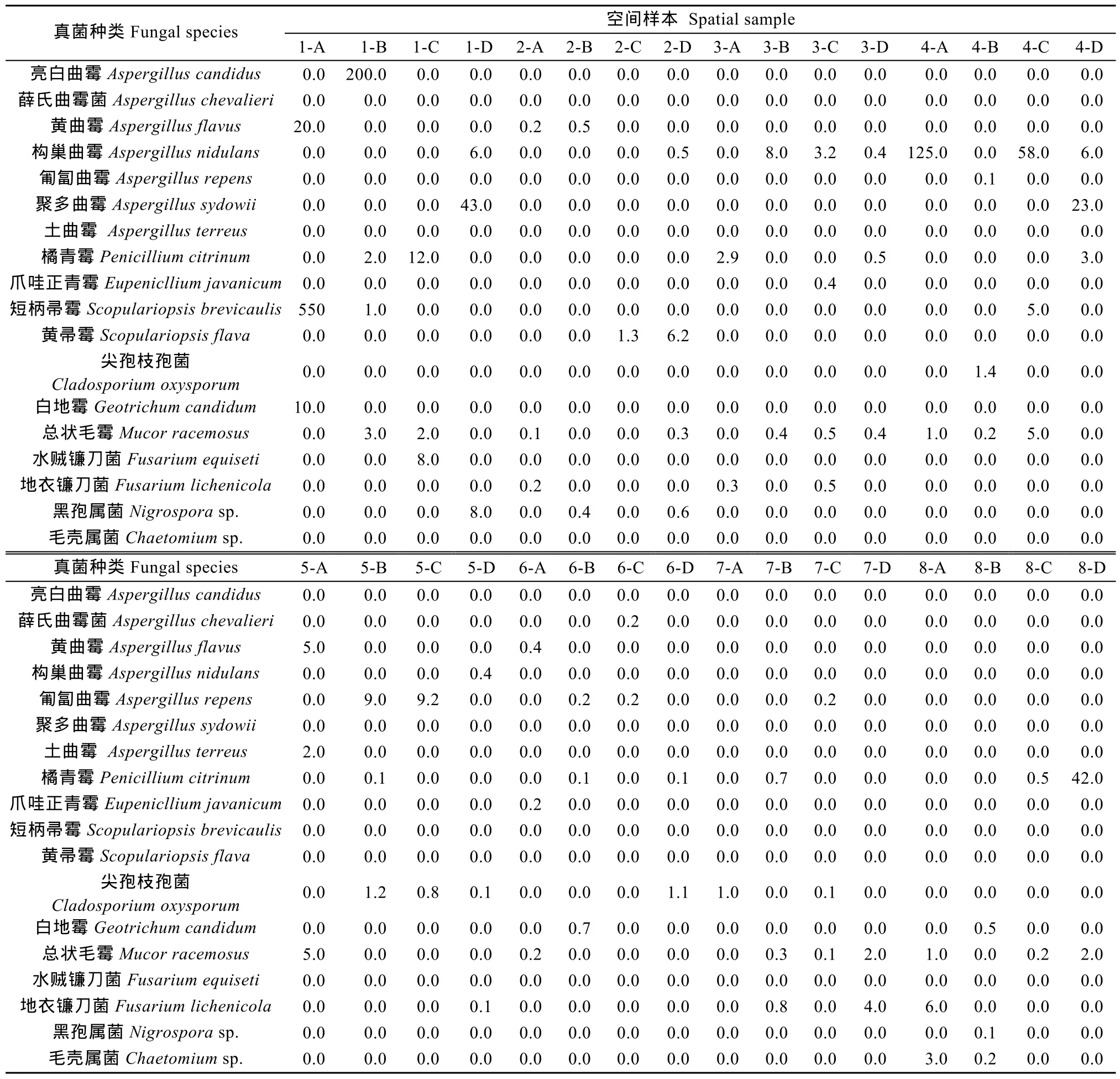
表3 猪舍微生物发酵床不同空间样本的真菌种类与数量Table 3 Fungal species and amounts in different samples from microbial fermentation bed of pigsty ×103colonies·g-1

图2 猪舍微生物发酵床真菌种类(Ⅰ)和数量(Ⅱ)的空间格局Fig. 2 Spatial patterns of fungal species (Ⅰ) and amounts (Ⅱ) in microbial fermentation bed of pigsty

图3 猪舍微生物发酵床真菌种类分布频次(Ⅰ)和数量分布(Ⅱ)情况Fig. 3 Frequency distribution (Ⅰ) and amount (Ⅱ) of fungal species in microbial fermentation bed of pigsty
真菌数量分布方面, 高含量的种有 3个, 菌含量为(2.00~5.56)×105菌落·g-1, 分别为短柄帚霉、构巢曲霉和亮白曲霉; 中含量的菌有 7个, 菌含量在(1.12~6.60)×104菌落·g-1, 分别为聚多曲霉、橘青霉、黄曲霉、总状毛霉、匍匐曲霉菌、地衣镰刀菌和白地霉; 低含量的种有8个, 菌含量小于1.00×104菌落·g-1, 分别为黑孢菌、水贼镰刀菌、短柄帚霉、尖孢枝孢菌、毛壳属菌、土曲霉、爪哇正青霉和薛氏曲霉菌。曲霉属中的构巢曲霉、亮白曲霉和聚多曲霉菌含量最大, 总计达4.74×105菌落·g-1。
2.4 微生物发酵床真菌种群的空间分布型
利用表2数据进行空间分布型指数分析的结果表明(表4):I指标=30.99>0, 为聚集分布; 平均拥挤度(m*/m)指标=17.09>1, 为聚集分布;CA指标=16.09>0, 为聚集分布; 扩散系数(C)=31.99>1, 为聚集分布; 负二项分布K指标=0.09>0, 为聚集分布, 表明发酵床真菌种群呈聚集分布。同时, 运用幂法则分析, Taylor幂法则方程为lgs2=1.189 5+1.965 8×lgx, R=0.964 9,β=1.965 8>1, 亦为聚集分布。上述各空间分布型指标结果均表明, 微生物发酵床真菌种群的空间分布型为聚集分布。

表4 猪舍微生物发酵床真菌种群的空间分布型指数Table 4 Spatial distribution pattern indexes of fungal population in microbial fermentation bed of pigsty
2.5 发酵床真菌种群空间分布多样性指数
多样性指数是反映物种丰富度和均匀度的综合指标。物种丰富度指数(D)越大, 丰富度越高; 均匀度指数(J')反映了各物种个体数目分配的均匀程度; 香农指数(H')越大, 物种越多, 分布越均匀;优势度指数(λ)越大, 多样性越高, 且与其他 3个多样性指数呈负相关。32个不同空间样本的真菌种群多样性指数分析结果表明(表 5): 空间样本2-C和7-A因仅分离到1个物种, 所以多样性指数均为 0。其他 30个空间样本丰富度指数(D)为0.09~0.36、均匀度指数(J')为 0.07~1.00、香农指数(H')为 0.05~1.09、优势度指数(λ)为 0.02~0.66。空间样本2-A和3-D真菌种群具有较高的丰富度、均匀度和优势度, 样本 2-A包含出现频次和数量较高的3个种类, 分别为总状毛霉、尖孢枝孢菌和黄曲霉菌; 样本 3-D亦包含出现频次和数量较高的 3个种类, 分别为总状毛霉、橘青霉和构巢曲霉。空间样本 1-A和 1-B的真菌数量最大, 分别5.80×105菌落·g-1和 2.06×105菌落·g-1, 种类为 4种和3种, 但它们的丰富度、均匀度、香农指数和优势度均较低, 其所包含的多为出现频次低于 3次的种类, 如亮白曲霉、短柄帚霉和白地霉。该结果进一步证明, 微生物发酵床真菌种群呈现明显的空间分布多样性, 且呈不均匀分布。

表5 猪舍发酵床真菌种群的空间分布多样性指数Table 5 Diversity indexes of fungal population in different spatial samples from microbial fermentation bed of pigsty
2.6 微生物发酵床真菌种群空间分布生态位宽度与生态位重叠
不同真菌种类的空间分布生态位宽度结果表明(表6): 总状毛霉和尖孢枝孢菌的生态位宽度值最大,分别为7.60和5.18, 为广适应种; 其次由高至低依次是地衣镰刀菌、构巢曲霉、匍匐曲霉菌和橘青霉, 它们的生态位宽度值为2.12~2.67; 其余12个种的生态位宽度值均在 2.0以下, 其中亮白曲霉、薛氏曲霉菌、土曲霉、短柄帚霉、水贼镰刀菌和毛壳属菌生态位宽度最小, 仅1.00~1.10, 为窄适应种。
不同真菌种的空间分布生态位重叠结果表明(表 6),短柄帚霉和白地霉的重叠值最高(1.00), 其次是黄曲霉和短柄帚霉、黄曲霉和白地霉, 两组值均为0.97; 再次为聚多曲霉和黑孢属菌、土曲霉和总状毛霉、匍匐曲霉菌和尖孢枝孢菌, 这3组值分别为0.88、0.58和0.57;剩余的其他各组的重叠值均低于0.50。
生态位宽度和生态位重叠的综合结果表明, 总状毛霉的生态位最宽且与其他 12个种类存在重叠,说明其在发酵床中的生存适应性最强, 但竞争能力较弱或不存在竞争; 尖孢枝孢菌的生态位宽度值位居第2位, 但仅与其他2个种类存在重叠, 说明其生存适应性和竞争能力均较强; 地衣镰刀菌和构巢曲霉的生态位宽度值分别排第 3和第 4位, 与其他种类的重叠个数仅为 2种和 4种, 且重叠值最高仅为0.23; 白地霉菌的生态位宽度值仅为1.25, 且仅与2个种类(黄曲霉和短柄帚霉)存在重叠, 但重叠值为0.97~1.00。说明发酵床中真菌种的生态位宽度与生态位重叠没有明显的相关性。

表6 猪舍微生物发酵床真菌种类的生态位宽度和生态位重叠Table 6 Niche breadth and niche overlap of fungal population in different spatial samples from microbial fermentation bed of pigsty
3 讨论
真菌在自然界中广泛分布且功能多样, 可作为分解菌、吸附菌和生防菌等。本研究分离到的曲霉属(Aspergillus)、青霉属(Penicillium)、镰刀菌属(Fusarium)、毛壳属(Chaetomium)和枝孢属(Cladosporium)等真菌是常见的纤维素、木质素分解菌。发酵床垫料中的谷壳、秸秆和椰糠等富含纤维素和木质素, 菌株利用它们产生的纤维素酶、木质素酶对分解动物粪便和除臭具有良好的效果[25-26]。此外, 曲霉属、青霉属、镰刀菌属、枝孢属和地霉属(Geotrichum)等菌对重金属Cu、Zn、Pb和Cr等都具有良好的富集作用[27-28]。由于饲料的使用、猪的粪尿排泄等因素, 可从发酵床垫料中检测到As、Zn、Cr和Cu等重金属[29]。本研究中分离到的部分菌株可能参与了重金属的吸附和降解。此外,毛霉属(Mucor)的部分种能分解糖类, 如总状毛霉在食品、化工行业中应用广泛, 可作为发酵菌种[30]。本研究分离到地衣镰刀菌目前已有的报道仅从水及水果柚子中分离获得[31-32], 且在我国未见报道。
发酵床微生物群落的空间分布型受垫料的种类和疏松度、垫料含水量、环境温度、猪的活动与排泄物等因素影响, 由单个或是多个因子共同起作用。宦海琳等[2]认为垫料组成是影响发酵床微生物构成的重要因素, 疏松的垫料有利于微生物的繁殖;龚俊勇等[12]研究表明发酵床水帘端到风机端处的真菌总数较其他位置的高, 且呈聚集分布; 周学利等[7]研究发现发酵床垫料和猪肠容物中含有的细菌种类基本相同, 但猪的活动与排泄物会引起垫料中的微生物产生差异, 且出现聚集分布现象; 刘国红等[8]研究发现微生物发酵床中芽胞杆菌种类丰富且在不同空间中呈聚集分布。本研究结果表明, 微生物发酵床真菌在32个空间样本中的种类与数量存在明显差异,且呈聚集分布型, 该结果与前述他人研究结果具有一致性[7-8,12]。发酵床垫料不同空间格局的真菌种类和数量存在不均匀性, 且分布频次和数量差异显著,总状毛霉和橘青霉为高频次分布种群, 短柄帚霉、构巢曲霉和亮白曲霉为高含量分布种群。本文所分离到的高频次和高含量的菌株多属于纤维素和木质素分解菌, 其中部分菌株具有吸附和降解重金属的能力。因此, 发酵床可利用这些菌株分解纤维素, 产生纤维素酶、木质素酶等, 起到去污除臭和清洁环保的作用。
发酵床的正常运转主要是依靠添加外源发酵菌种、猪肠道微生物和垫料本身的土著菌种进行调节,微生物群落呈现明显的多样性[8,33-34]。多样性指数如丰富度、均匀度、优势度等分别从微生物群落物种丰富度、均一性及常见物种优势度等方面反映其群落多样性[35]。本研究中32个不同空间样本的真菌种群多样性指数分析结果表明: 除空间样本2-C和7-A因仅分离到1个物种外, 其他30个样本呈现明显的空间分布多样性。空间样本2-A和3-D真菌种群具有较高的丰富度、均匀度和优势度, 包含出现频次和数量均较多的种类, 如总状毛霉、尖孢枝孢菌、橘青霉和构巢曲霉。空间样本1-A和1-B的真菌数量最大, 种类也较多, 但它们的丰富度、均匀度和优势度均较低, 所包含的多为出现频次低于 3次的种类, 如亮白曲霉、短柄帚霉和白地霉。该结果也进一步验证了前述空间分布格局和空间分布型的分析结果, 即所供试的微生物发酵床的真菌种群呈现明显的多样性, 且呈聚集分布和不均匀分布。该结果也与刘国红等[8]对微生物发酵床中芽胞杆菌种群多样性的研究结果一致。发酵床能形成以有益微生物为优势种的群落, 有效抑制环境中有害微生物的生长, 从而减少猪病发生[36]; 而且微生物(细菌、真菌和放线菌)与环境之间具有双向的适应性和选择性,发酵床中虽然含有一定数量的潜在致病菌, 但发酵床中微生物种类丰富, 群落多样性高, 有利于有益微生物形成优势种群。如本研究的32个空间样品中仅有5个样本检测到少量的黄曲霉菌, 该菌适合的生长温度为 20~35 ℃, 而发酵床内部中心发酵层温度可高达60~80 ℃。因此, 发酵床管理过程中, 对具有潜在致病菌的区域, 可通过及时翻耙, 将表层垫料翻至里层, 通过高温处理和深度发酵将致病菌杀死,以保证发酵床的正常运转。
生态位理论被广泛用于研究物种共存机制、群落演替和物种多样性等方面, 其中生态位宽度和生态位重叠是两个重要的指标。生态位宽度反映种群对环境的适应状况或对资源的利用程度, 生态位重叠则反映 2个或多个种群在适用环境和利用资源的实际幅度或潜在能力方面所表现出的共同性或相似性[37]。本研究所分离到的真菌种群的生态位宽度和生态位重叠的结果表明, 总状毛霉和尖孢枝孢菌生态位最宽, 为广适应种和优势种群, 说明它们在发酵床中的生存适应性最强, 可很好地利用发酵床中的资源进行生长繁殖。总状毛霉可与其他12个种类存在重叠, 但尖孢枝孢菌仅与其他 2个种类存在重叠。说明发酵床中真菌种类的生态位宽度与生态位重叠没有明显的正相关性, 不同种类真菌在垫料中呈不均均分布, 可能与猪的活动、垫料的翻动、不同位置的环境温湿度等影响因素有关。而潘好芹等[17]对太白山土壤淡色丝孢真菌群落多样性及生态位研究表明, 生态位宽度值大的属, 与其他各属的生态位重叠也较高, 反之亦然。两者研究结果差异的原因可能与两种环境类型有关, 发酵床因猪的运动及垫料的人为翻动, 处于动态环境; 而森林土壤相对来说偏于静态环境。在森林植被生态位的研究方面,程中秋等[38]对宁夏盐池不同封育措施下的植物生态位研究表明, 较大的生态位宽度常常伴随着较高的生态位重叠; 而邓贤兰等[39]对井冈山山顶矮林乔木层优势种的生态位研究表明, 生态位宽度与生态位重叠无明显的正相关性, 该结果与本研究结果具有相似性。
综上所述, 养猪微生物发酵床的真菌种群呈现明显的群落多样性, 真菌在发酵床空间中呈聚集分布和不均匀分布, 有利于有益微生物发展成为优势种群, 如常见发酵菌种总状毛霉和纤维素降解菌尖孢枝孢菌在发酵床中分布广、适应性强。而且, 所分离到大部分种类为有益微生物, 可作为发酵菌种和纤维素降解菌并产生多种酶类物质, 有利于垫料中的椰糠、谷壳以及猪排泄物等的发酵与降解, 起到了除臭、除异味、调节发酵床垫料微生物群落结构等作用。本研究结果可为养猪发酵床管理、猪粪资源化利用、猪病防控等提供理论依据。
参考文献 References
[1] 刘波, 郑雪芳, 朱昌雄, 等. 脂肪酸生物标记法研究零排放猪舍基质垫层微生物群落多样性[J]. 生态学报, 2008,28(11): 5488–5498 LIU B, ZHENG X F, ZHU C X, et al. The diversity of PLFAs biomarkers for the microbial community in the stroma cushion of non-pollution pigsty[J]. Acta Ecologica Sinica, 2008,28(11): 5488–5498
[2] 宦海琳, 冯国兴, 李健, 等. 发酵床猪舍内气载需氧菌的分布状况[J]. 江苏农业学报, 2013, 29(6): 1411–1414 HUAN H L, FENG G X, LI J, et al. Distribution of airborne aerobic microorganisms in bio-bed pigsty[J]. Jiangsu Journal of Agricultural Sciences, 2013, 29(6): 1411–1414
[3] 刘克锋, 刘悦秋, 雷增谱, 等. 不同微生物处理对猪粪堆肥质量的影响[J]. 农业环境科学学报, 2003, 22(3): 311–314 LIU K F, LIU Y Q, LEI Z P, et al. Effects of different microorganism consortiums on quality of composting pig-dung[J].Journal of Agro-Environment Science, 2003, 22(3): 311–314
[4] 李庆康, 吴雷, 刘海琴, 等. 我国集约化畜禽养殖场粪便处理利用现状及展望[J]. 农业环境保护, 2000, 19(4): 251–254 LI Q K, WU L, LIU H Q, et al. The status and outlook of treatment on excreta from intensive animal farming in China[J]. Agro-Environmental Protection, 2000, 19(4):251–254
[5] 郑雪芳, 刘波, 朱育菁, 等. 养猪发酵床垫料微生物及其猪细菌性病原群落动态的研究[J]. 农业资源与环境学报,2016, 33(5): 425–432 ZHENG X F, LIU B, ZHU Y J, et al. Community dynamic of bacteria, fungi, actinomycetes and pig bacterial pathogens in the stroma cushion of pig-on-litter system[J]. Journal of Agricultural Resources and Environment, 2016, 33(5): 425–432
[6] 蓝江林, 栗丰, 刘波, 等. 养猪发酵床垫料微生物类群结构特性分析[J]. 福建农业学报, 2016, 31(6): 649–656 LAN J L, LI F, LIU B, et al. Analysis on spatial distribution of microbes population in the fermentation bed[J]. Fujian Journal of Agricultural Sciences, 2016, 31(6): 649–656
[7] 周学利, 吴锐锐, 李小金, 等. 发酵床养猪模式中猪肠道与垫料间的菌群相关性分析[J]. 家畜生态学报, 2014, 35(2):70–74 ZHOU X L, WU R R, LI X J, et al. Correlation analysis of bacteria from pig intestine and padding in the breeding pattern of fermentation bed[J]. Acta Ecologae Animalis Domastici,2014, 35(2): 70–74
[8] 刘国红, 刘波, 王阶平, 等. 养猪微生物发酵床芽胞杆菌空间分布多样性[J]. 生态学报, 2017, 37(20): 6914–6932 LIU G H, LIU B, WANG J P, et al. Spatial distribution pattern and community diversity of theBacillus-like species in a fermentation bed system for pig rearing[J]. Acta Ecologica Sinica, 2017, 37(20): 6914–6932
[9] WANG Y, XU J, SHEN J H, et al. Tillage, residue burning and crop rotation alter soil fungal community and water-stable aggregation in arable fields[J]. Soil and Tillage Research, 2010, 107(2): 71–79
[10] 张俊忠, 陈秀蓉, 杨成德, 等. 东祁连山高寒草地土壤可培养真菌多样性分析[J]. 草业学报, 2010, 19(2): 124–132 ZHANG J Z, CHEN X R, YANG C D, et al. A study on the diversity of soil cultured fungi in the alpine grassland of eastern Qilian Mountains[J]. Acta Prataculturae Sinica, 2010,19(2): 124–132
[11] 邵璐, 姜华. 辽宁碱蓬根际土壤真菌多样性的季节变化及其耐盐性[J]. 生态学报, 2016, 36(4): 1050–1057 SHAO L, JIANG H. Effect of season and variation in salinity on the rhizosphere fungal diversity ofSuaeda liaotungensis[J].Acta Ecologica Sinica, 2016, 36(4): 1050–1057
[12] 龚俊勇, 廖新俤, 杨平, 等. 水帘降温系统下猪用发酵床垫料的特性与功能的空间变化[J]. 家畜生态学报, 2012, 33(6):36–43 GONG J Y, LIAO X D, YANG P, et al. Effect of cooling pad system on properties and function of litters in pig-on-litter system[J]. Acta Ecologae Animalis Domastici, 2012, 33(6):36–43
[13] 肖荣凤, 王阶平, 刘波, 等. 大栏养猪微生物发酵床垫料中青霉菌的分离与鉴定[J]. 福建农业学报, 2016, 31(2):189–193 XIAO R F, WANG J P, LIU B, et al. Isolation and identification ofPenicilliumfungi in microbial fermentation bed at pig farms[J]. Fujian Journal of Agricultural Sciences, 2016, 31(2):189–193
[14] 肖荣凤, 朱育菁, 刘波, 等. 微生物发酵床大栏养猪垫料中曲霉菌的分离与鉴定[J]. 福建农林大学学报: 自然科学版,2017, 46(3): 336–342 XIAO R F, ZHU Y J, LIU B, et al. Isolation and identification ofAspergillusfrom microbial fermentation beds for pig raising[J]. Journal of Fujian Agriculture and Forestry University:Natural Science Edition, 2017, 46(3): 336–342
[15] Dänicke S, Goyarts T, Döll S, et al. Effects of theFusariumtoxin deoxynivalenol on tissue protein synthesis in pigs[J].Toxicology Letters, 2006, 165(3): 297–311
[16] 王芳, 图力古尔. 土壤真菌多样性研究进展[J]. 菌物研究,2014, 12(3): 178–186 WANG F, BAU T. Research advances in the diversity of soil fungi[J]. Journal of Fungal Research, 2014, 12(3): 178–186
[17] 潘好芹, 张天宇, 黄悦华, 等. 太白山土壤淡色丝孢真菌群落多样性及生态位[J]. 应用生态学报, 2009, 20(2): 363–369 PAN H Q, ZHANG T Y, HUANG Y H, et al. Diversity and niche of soil moniliaceous hyphomycetes in Taibai Mountain[J]. Chinese Journal of Applied Ecology, 2009, 20(2):363–369
[18] 齐祖同, 孔华忠, 孙曾美. 中国真菌志(第 5卷): 曲霉属及其相关有性属[M]. 北京: 科学出版社, 1997: 1–199 QI Z T, Kong H Z, Sun Z M. Flora Fungorum Sinicorum Summarizes Vol. 5:Aspergillusand Its Realated Teleomorphs[M]. Beijing: Science Press, 1997: 1–199
[19] 孔华忠. 中国真菌志 第35卷: 青霉属及其相关有性型属[M].北京: 科学出版社, 2007: 1–284 KONG H Z. Flora Fungorum Sinicorum Summarizes Vol. 35:Penicilliumand Its Realated Teleomorphs[M]. Beijing: Science Press, 2007: 1–284
[20] 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社,1979 WEI J C. Fungal Identification Manual[M]. Shanghai:Shanghai Scientific & Technical Publishers, 1979
[21] LANDEWEERT R, LEEFLANG P, KUYPER T W, et al.Molecular identification of ectomycorrhizal mycelium in soil horizons[J]. Applied and Environmental Microbiology, 2003,69(1): 327–333
[22] GLASS N L, DONALDSON G C. Development of primer sets designed for use with the PCR to amplify conserved genes from filamentous ascomycetes[J]. Applied and Environmental Microbiology, 1995, 61(4): 1323–1330
[23] NASRI T, HEDAYATI M T, ABASTABAR M, et al.PCR-RFLP on β-tubulin gene for rapid identification of the most clinically important species ofAspergillus[J]. Journal of Microbiological Methods, 2015, 117: 144–147
[24] 唐启义. DPS数据处理系统: 第3卷: 专业统计及其他[M].第3版. 北京: 科学出版社, 2013: 1246–1250 TANG Q Y. DPS Data Processing System Volume Ⅲ: Professional Statistics and Others[M]. 3rd ed. Beijing: Science Press, 2013: 1246–1250
[25] 杨巧丽, 姚拓, 王得武, 等. 木质纤维分解菌群筛选及其对秸秆分解与畜禽粪便除臭能力评价[J]. 草业学报, 2015,24(1): 196–203 YANG Q L, YAO T, WANG D W, et al. Screening of lignocellulose degrading microbial communities for their ability to deodorize livestock and poultry wastes[J]. Acta Prataculturae Sinica, 2015, 24(1): 196–203
[26] 黄旺洲, 张生伟, 滚双宝, 等. 高效纤维素分解菌群及锯末对动物粪便降解纤维素酶活与除臭效果的影响[J]. 农业环境科学学报, 2016, 35(1): 186–194 HUANG W Z, ZHANG S W, GUN S B, et al. Effects of cellulose-decomposing microbes and sawdust on cellulose enzyme activity and odor during animal waste degradation[J].Journal of Agro-Environment Science, 2016, 35(1): 186–194
[27] EZZOUHRI L, CASTRO E, MOYA M, et al. Heavy metal tolerance of filamentous fungi isolated from polluted sites in tangier, morocco[J]. African Journal of Microbiology Research, 2009, 3(2): 35–48
[28] SIOKWU S, ANYANWN C U. Tolerance for heavy metals by filamentous fungi isolated from a sewage oxidation pond[J].African Journal of Microbiology Research, 2012, 6(9):2038–2043
[29] 张霞, 杨杰, 李健, 等. 猪发酵床不同原料垫料重金属元素累积特性研究[J]. 农业环境科学学报, 2013, 32(1): 166–171 ZHANG X, YANG J, LI J, et al. Accumulated characteristics of heavy metals in different pig bio-bed materials[J]. Journal of Agro-Environment Science, 2013, 32(1): 166–171
[30] 李顺, 顾永忠, 杨英, 等. 八公山腐乳酿制过程中毛霉和根霉的前期发酵比较研究[J]. 食品科学, 2016, 37(17):163–168 LI S, GU Y Z, YANG Y, et al. Comparative study of pre-fermentation withMucor racemosusandRhizopus oryzaein Bagongshan sufu during fermentation[J]. Food Science,2016, 37(17): 163–168
[31] MORALES-BARRERA L, DE MARÍAGUILLÉN-JIMÉNEZ F, ORTIZ-MORENO A, et al. Isolation, identification and characterization of aHypocrea tawastrain with high Cr(VI)reduction potential[J]. Biochemical Engineering Journal, 2008,40(2): 284–292
[32] AMBY D B, THUY T T T, HO B D, et al. First report ofFusarium lichenicolaas a causal agent of fruit rot in pomelo(Citrus maxima)[J]. Plant Disease, 2015, 99(9): 1278
[33] 赵国华, 方雅恒, 陈贵. 生物发酵床养猪垫料中营养成分和微生物群落研究[J]. 安徽农业科学, 2015, 43(8):98–99 ZHAO G H, FANG Y H, CHEN G. Study on the nutritional components and microbial community in the beddings of pig raising by bio-fermentation bed[J]. Journal of Anhui Agricultural Sciences, 2015, 43(8): 98–99
[34] 毕泗伟, 吴祖芳, 虞耀土. 16S rDNA基因文库技术分析发酵床细菌群落的多样性[J]. 宁波大学学报: 理工版, 2013,26(1): 18–22 BI S W, WU Z F, YU Y T. The bacteria diversity of fermentation bed in pig-farming by 16S rDNA gene clone library analysis[J]. Journal of Ningbo University: Natural Science &Engineering Edition, 2013, 26(1): 18–22
[35] 李忠佩, 吴晓晨, 陈碧云. 不同利用方式下土壤有机碳转化及微生物群落功能多样性变化[J]. 中国农业科学, 2007,40(8): 1712–1721 LI Z P, WU X C, CHEN B Y. Changes in transformation of soil organic carbon and functional diversity of soil microbial community under different land use patterns[J]. Scientia Agricultura Sinica, 2007, 40(8): 1712–1721
[36] 郑雪芳, 刘波, 蓝江林, 等. 微生物发酵床对猪舍大肠杆菌病原生物防治作用的研究[J]. 中国农业科学, 2011, 44(22):4728–4739 ZHENG X F, LIU B, LAN J L, et al. Study on the biocontrol effects of microbial-fermentation bed on the pig pathogenEscherichia coliin the piggery[J]. Scientia Agricultura Sinica,2011, 44(22): 4728–4739
[37] WEIDER L J. Niche breadth and life history variation in a hybrid daphnia complex[J]. Ecology, 1993, 74(3): 935–943
[38] 程中秋, 张克斌, 常进, 等. 宁夏盐池不同封育措施下的植物生态位研究[J]. 生态环境学报, 2010, 19(7):1537–1542 CHENG Z Q, ZHANG K B, CHANG J, et al. Vegetable niche of different enclosure measures in Yanchi County,Ningxia[J]. Ecology and Environment Sciences, 2010,19(7): 1537–1542
[39] 邓贤兰, 曹裕松, 梁琴, 等. 井冈山山顶矮林乔木层优势种的生态位研究[J]. 植物资源与环境学报, 2016, 25(1): 88–93 DENG X L, CAO Y S, LIANG Q, et al. Study on niche of dominant species at arbor layer in montane elfin forest of Jinggangshan[J]. Journal of Plant Resources and Environment,2016, 25(1): 88–93
