3个玉米WRKY转录因子在非生物胁迫下的表达分析
2018-04-08决登伟桑雪莲刘丽琴王一承石胜友
决登伟,桑雪莲,舒 波,刘丽琴,王一承,石胜友
(中国热带农业科学院 南亚热带作物研究所,农业部热带果树生物学重点实验室,广东湛江 524091)
转录因子(transcription factor,TF)是一类能与真核基因启动子区域中的顺式作用元件特异性结合的蛋白分子。通过它们之间及与其他蛋白间的相互作用,实现对基因激活或者抑制转录,从而保证目的基因以特定的强度、在特定的时间与空间表达[1]。植物体内含有大量的转录因子,根据序列特征及功能的差异,可以将它们分为很多不同的类型或家族。比如WRKY、AP2/ERF和MYB等。这其中,WRKY是植物体中最大的转录因子家族之一,它们在植物的生长发育及响应胁迫过程中起到重要作用。第一个WRKY转录因子(SPF1)在1994年从甘薯中鉴定出来[2]。随后,在众多植物中都出现报道,且其数目从低等植物到高等植物呈现上升趋势。比如,在油菜 (BrassicanapusL.)中有46个WRKY转录因子成员[3],黄瓜(Cucumissativus)中有57个[4],麻风树(Jatrophacurcas)中有58个[5],蓖麻(RicinuscommunisL.)中有58个[6],拟南芥(Arabidopsisthaliana)中有72个[7],白梨(Pyrusbretschneideri)中有103个[8],白杨(Populustrichocarpa)中有105个[9],谷子(Setariaitalica)中有105个[10],水稻(Oryzasativa)中有109个[11],在棉花(Gossypium)中有109~112个[12],玉米(ZeamayL.)中有136个[13],大豆(Glycinemax)中有197个[14]。
WRKY蛋白在结构上有一个显著特点:都包含一个或者两个WRKY结构域,包括N-端高度保守的WRKYGQK七肽及C-端的锌指结构(Cx4-7Cx22-23HxH/C)。根据WRKY结构域的数目及锌指结构的特点,可将WRKY蛋白划分为3个主要类型。第Ⅰ类有两个WRKY结构域,锌指结构类型为C2H2。第Ⅱ和Ⅲ类只含有一个WRKY结构域。其中,第Ⅲ类成员的锌指结构类型为C2HC,而第Ⅱ类为C2H2。根据进化关系及WRKY结构域中某些氨基酸基序不同,第Ⅱ类WRKY转录因子又可细分为5个小类(a~e)[15]。研究表明,WRKY转录因子参与植物多种生理生化过程,如应对生物和非生物胁迫,参与叶片衰老,发育和次生代谢等[16]。在拟南芥中,AtWRKY25和AtWRKY33受盐的促进表达,且异源表达这两个基因,增强植物对NaCl的耐性[17-18]。 AtWRKY70既可以激活SA介导的抗病信号途径,同时也能抑制JA介导的信号途径,从而实现对拟南芥抗病反应的调控[19]。在水稻中,过表达 OsWRKY45促进拟南芥对干旱的耐性, OsWRKY8异源表达促进拟南芥对渗透的耐性, OsWRKY72的异源表达则会影响根的生长和逆境耐性[20]。另外, OsWRKY89的过表达促进植株对紫外线的抵御[21],过表达 OsWRKY11增强转基因植株对高温的耐性[18]。在白梨的103 WRKY基因中,44个PbWRKY在干旱处理下呈上调表达[8]。高粱(PanicummiliaceumL.)中,10个PmWRKY基因的表达受到干旱胁迫诱导,16个PmWRKY基因的表达受到低温胁迫诱导[22]。玉米(ZeamaysL.)是当今世界重要的粮食作物之一,亦是重要的饲料和工业原料作物, 在世界粮食总产量中处于第一位[23]。中国作为世界第二大玉米生产国,近30多年来,玉米生产发展非常迅速,总产量也呈逐年上升趋势。世界粮农组织统计数据库(FAOSTAT)显示在2012 年,玉米产量超过稻谷产量,成为中国第一大粮食作物[24]。2014年,中国玉米常年种植面积达3 715.04 万hm2,总产量约2.16 亿t,占同年中国粮食总产量(6.07亿t)的1/3。但在实际生产中,玉米常因受到诸多不利环境因素的影响而大面积减产,比如干旱、盐胁迫和低温等。目前,已有关于WRKY家族基因的研究文章[13],但还没有关于 ZmWRKY1-like、 ZmWRKY4-like、 ZmWRKY21-like基因在植物响应非生物胁迫中作用的报道。本研究采用生物信息学技术从玉米的基因组发现3个WRKY家族基因: ZmWRKY1-like、 ZmWRKY4-like、 ZmWRKY21-like。利用荧光定量PCR技术,探讨这3个基因在玉米不同组织、干旱、盐胁迫及低温胁迫的表达模式。该研究可以为挖掘玉米抗逆基因及丰富WRKY转录因子在不同作物中的功能研究提供一定的理论和试验依据。
1 材料与方法
1.1 试验材料及处理
玉米自交系B73种子保存于南亚热带作物所。玉米组织根(root)、茎(stem)、叶(leaf)、穗(tassel)、幼果(young seed)和穗丝(silk)取自大田种植的玉米自交系B73植株,采样时期为乳熟期。所用植物RNA提取试剂盒购自北京华越洋生物公司(Huayueyang Bio Co., Ltd, Beijing, China);反转录试剂及Realtime PCR试剂盒购自大连宝生物工程有限公司(TaKaRa Bio, Inc., Dalian, China);引物由北京赛百盛基因技术有限公司合成;其他试剂购自上海生物工程有限公司。逆境处理所用材料为B73种子萌发而来的幼苗,种子萌发后,转入1/2 Hoagland 培养液,在培养箱中继续培养,生长条件为(28±2) ℃,14 h光照,10 h黑暗。3周后,选择长势均一的幼苗进行下步试验。每个处理具体方法如下:①盐胁迫处理,将幼苗放入含200 mol/L NaCl的1/2 Hoagland培养液中培养,按0、1、6和24 h时间点取样;②干旱胁迫处理,将幼苗放入含200 g/L PEG6000的1/2 Hoagland培养液中培养,按0、1、6和24 h时间点取样;③低温胁迫处理,将幼苗放入温度设置为4 ℃的培养箱中培养,按0、1、6和24 h时间点取样。设3次重复,取样部位为叶片。所有取样剪成2 cm左右的小段,立即放入液氮速冻并转入-80 ℃冰箱中保存,备用。
1.2 试验方法
1.2.1 ZmWRKY1-like、 ZmWRKY4-like和 ZmWRKY21-like序列的获得及分析 ZmWRKY1-like、 ZmWRKY4-like和 ZmWRKY21-like3个基因序列从Phytozome (http://bioinformatics.psb.ugent.be/plaza/versions/plaza/)数据库中获得,并在玉米基因组数据库(MaizeGDB, http://www. maizegdb.org/)中进行验证。3个基因的ORF、氨基酸长度和染色体定位信息从Phytozome数据库获得。应用在线软件SMART (http://smart.emblheidelberg.de/)预测3个蛋白的结构域;通过ExPASy (http://expasy.org/tools/)分析3个蛋白的等电点和分子质量;通过Plant-mPLoc (http://www.csbio.sjtu.edu.cn/cgibin/ PlantmPLoc.cgi)预测3个蛋白的亚细胞定位情况;采用Gene Structure Display Server (GSDS) (http://gsds.cbi.pku.edu. cn/)分析3个基因的外显子和内含子结构;用Clustal X进行不同序列的多重序列对比,同时利用MEGA 6软件进行氨基酸序列同源性分析及系统发育分析,构建Neighbor-Joining进化树,1 000 次重复,其他均为默认设置。
1.2.2植物总RNA提取及Realtime PCR分析用北京华越洋生物公司的植物RNA提取试剂盒提取玉米不同组织材料的RNA,然后用TaKaRa公司的PrimeScript RT试剂盒反转录成cDNA后作为模板,具体操作步骤参照说明书。根据玉米基因组中 ZmWRKY1-like、 ZmWRKY4-like和 ZmWRKY21-like3个基因的CDS序列设计Realtime PCR引物,并以玉米的 Actin 2(NM_001154731)基因作为内参基因,具体引物序列见表1。
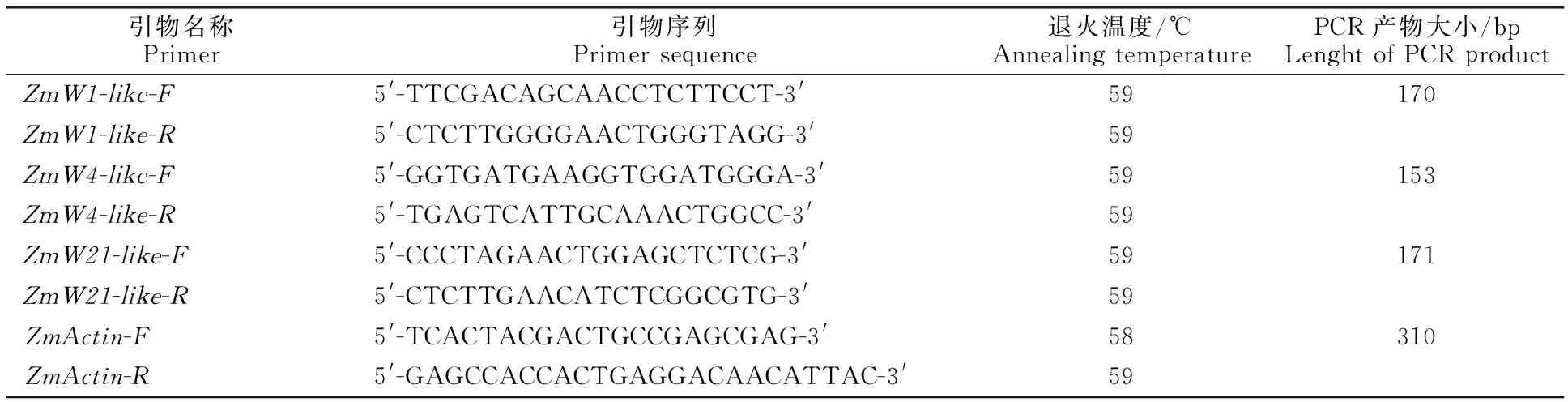
表1 ZmWRKY基因定量PCR所用引物Table 1 Primers used in quantitative RT-PCR of ZmWRKY gene
Realtime PCR反应在Roche的LightCycler480仪器中进行,PCR反应酶为TaKaRa公司的SYBR Green Master Mix。反应体系为20 mL,其中模板cDNA 40 ng,上、下游引物各250 nmol/L,SYBR Green Master Mix 10 μL,用ddH2O 补齐。反应程序:94 ℃预变性5 min;94 ℃ 10 s,59 ℃ 20 s,72 ℃ 30 s,40 个循环后作熔解曲线(95 → 65 ℃,0.1 ℃/s)。利用2-ΔΔCt计算基因的相对表达量。所有样品进行3次重复,均设阴性对照。在分析基因的表达时,上调或者下调大于2倍时才认为存在差异。
2 结果与分析
2.1 ZmWRKY1-like、 ZmWRKY4-like和 ZmWRKY21-like3个基因的获得及生物信息学分析
以WRKY转录因子保守区氨基酸序列在Phytozome和MaizeGDB进行BLASTP搜索,通过分析获得3个玉米同源性较高的WRKY转录因子家族基因,分别为 ZmWRKY1-like、 ZmWRKY4-like和 ZmWRKY21-like。3个基因的基因id、locus、染色体定位等信息见表2和图1。其中, ZmWRKY1-like基因序列开放阅读框为1 194 bp,编码的蛋白具有397个氨基酸,其分子质量为42.80 ku,理论等电点为9.98,位于玉米第Ⅰ号染色体; ZmWRKY4-like基因序列开放阅读框为1 701 bp,编码的蛋白具有566个氨基酸,其分子质量为61.71 ku,理论等电点为6.20,位于玉米第Ⅳ号染色体; ZmWRKY21-like基因序列开放阅读框为1 065 bp,编码的蛋白具有354个氨基酸,其分子质量为38.04 ku,理论等电点为9.81,位于玉米第Ⅰ号染色体。预测表明3个基因都位于细胞核。对3个基因的氨基酸序列进行分析,发现 ZmWRKY4-like含有两个WRKY结构域,根据WRKY转录因子分类原则,归为第Ⅰ类。 ZmWRKY1-like和 ZmWRKY21-like都含有1个WRKY结构域,锌指结构同为C-X5-C-X23-H-X1-H型,属于第Ⅱd类WRKY转录因子。

表2 ZmWRKY基因信息Table 2 Information of ZmWRKY genes
2.2 ZmWRKY1-like、ZmWRKY4-like和ZmWRKY21-like的系统进化分析
采用MEGA 6软件将玉米ZmWRKY1-like、ZmWRKY4-like和ZmWRKY21-like蛋白序列与拟南芥、水稻、小米、小麦的部分WRKY蛋白序列进行分析并构建进化树(图 2),发现ZmWRKY1-like和ZmWRKY21-like都聚到Ⅱd分支中,与小米的SiWRKY1及小麦的TaWRKY16同源性最高,与同分支拟南芥及水稻的WRKY蛋白同源性稍低。ZmWRKY4-like属于Ⅰ分支,与同分支中小麦的TaWRKY45同源性最高,与拟南芥的AtWRKY25、AtWRKY26、AtWRKY33,水稻的OsWRKY24、OsWRKY53、OsWRKY70同源性较低(图 2)。

A.保守结构域蛋白序列对比,黑框中为WRKY结构Alignment of conserved motifs of ZmWRKYS.The WRKY conserved motifis are bordered(black rectangles);B.基因结构,蓝色为外显子,黑色为内含子Gene structure of ZmWRKYs is presented by blue exons and gray intron between the blue box
图1ZmWRKY1-like、ZmWRKY4-like和ZmWRKY21-like保守结构域蛋白序列对比及基因结构
Fig.1AlignmentofconservedmotifsandgenestructureofZmWRKYs
2.3 玉米不同组织 ZmWRKY1-like、 ZmWRKY4-like和 ZmWRKY21-like的表达分析
以大田种植的B73植株为材料,采样时期为乳熟期。用Realtime PCR技术分析 ZmWRKY1-like、 ZmWRKY4-like和 ZmWRKY21-like3个基因在玉米幼苗的根(root)、茎(stem)、叶(leaf)、穗(tassel)、幼果(young seed)和穗丝(silk)中的表达情况。图3结果显示,3个基因在玉米不同组织中都表达,但存在差异。其中, ZmWRKY1-like和 ZmWRKY21-like基因在穗丝中的表达量最低, ZmWRKY4-like基因在根中的表达量最低。3个基因在幼果中的表达量都显著高于在其他组织, ZmWRKY1-like和 ZmWRKY21-like在幼果中的表达量分别是根的65和13倍; ZmWRKY4-like在幼果中的表达量是穗丝的27倍。说明 ZmWRKY1-like、 ZmWRKY4-like和 ZmWRKY21-like这3个基因可能参与玉米植株不同组织器官的发育过程,特别是玉米籽粒的发育过程。
2.4 不同非生物逆境胁迫下 ZmWRKY1-like、 ZmWRKY4-like和 ZmWRKY21-like的表达分析
以3周苗龄的B73玉米幼苗为材料,用Realtime PCR技术分析 ZmWRKY1-like、 ZmWRKY4-like和 ZmWRKY21-like3个基因在盐、干旱和低温处理下表达情况。如图4、5、6所示,盐胁迫下, ZmWRKY1-like基因在6 h时出现下调表达,为对照的0.43倍,在24 h时恢复到对照水平; ZmWRKY4-like基因的表达在检测时间内未出现变化; ZmWRKY21-like基因在24 h时呈现上调表达,为对照的2.2倍。干旱胁迫下, ZmWRKY1-like基因在6和24 h出现下调表达,分别为对照的0.3和0.4倍; ZmWRKY4-like基因的表达在检测时间内未出现变化; ZmWRKY21-like基因在6 h时出现下调表达,为对照的0.4倍,在24 h时恢复到对照水平。低温胁迫下,3个基因的表达都没有出现显著变化。上述结果表明, ZmWRKY1-like和 ZmWRKY21-like基因可能分别参与植物对干旱和盐胁迫的响应。

○玉米 Zea mays;▲拟南芥 Arabidopsis thaliane; ● 小米 Setaria italica;◆水稻 Oryza sativa ;■小麦 Triticum aestivum
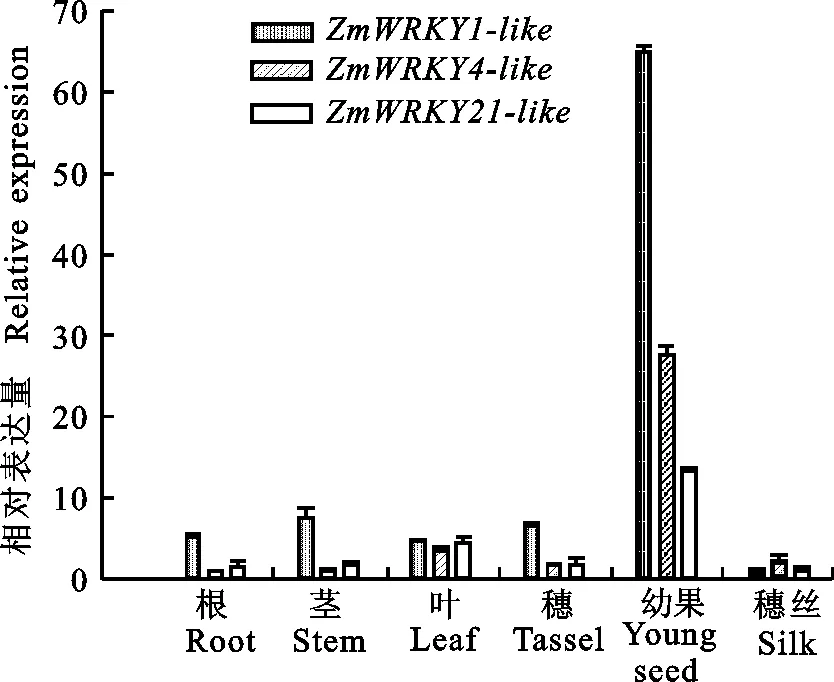
图3 ZmWRKY1-like、ZmWRKY4-like和ZmWRKY21-like基因在玉米不同组织中的表达水平Fig.3 Expression level of ZmWRKY1-like, ZmWRKY4-like and ZmWRKY21-like gene in different maize tissues

图4 玉米 ZmWRKY1-like基因的逆境表达分析Fig.4 Stress expression analysis of ZmWRKY1-like gene
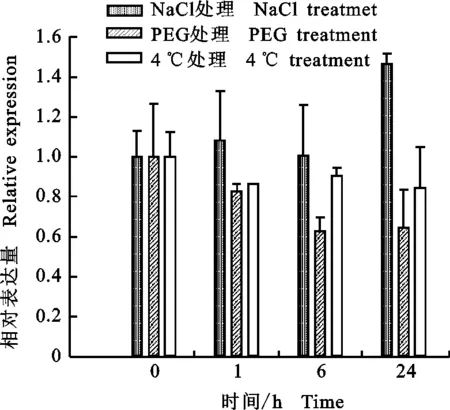
图5 玉米 ZmWRKY4-like基因的逆境表达分析Fig.5 Stress expression analysis of ZmWRKY4-like gene

图6 玉米 ZmWRKY21-like基因的逆境表达分析Fig.6 Stress expression analysis of ZmWRKY21-like gene
3 结论与讨论
WRKY是植物中一类重要的转录因子家族,也是植物转录因子中最大的家族之一[25]。本研究从Phytozome和MaizeGDB数据库中得到3个玉米WRKY家族基因: ZmWRKY1-like、 ZmWRKY4-like和 ZmWRKY21-like。对3个基因的序列特征和进化关系进行分析,并采用荧光定量PCR检测这3个基因在玉米不同组织和不同逆境胁迫处理下的表达情况。
分析表明ZmWRKY1-like、ZmWRKY4-like和ZmWRKY21-like都具有WRKY保守结构域和锌指结构,分别为第Ⅱd、Ⅰ和Ⅱd类WRKY转录因子。石红梅等[26]的研究表明,PsWRKY基因主要在牡丹的叶片和心皮中表达,在其他器官中的表达量非常低。烟草的164个WRKY基因中,大部分在根、茎、叶中都有表达,但不同基因间的表达模式存在差异。比如: NtWRKY7、NtWRKY11、NtWRKY32、NtWRKY82、NtWRKY92、NtWRKY105和 NtWRKY147在根、茎、叶中不表达或表达量较低; NtWRKY26和 NtWRKY78在根中表达量最高; NtWRKY21和 NtWRKY114在茎中表达量最高; NtWRKY28、 NtWRKY81、 NtWRKY163在叶片中表达量最高[27]。与这些研究结果类似,本研究中 ZmWRKY1-like、 ZmWRKY4-like和 ZmWRKY21-like3个基因在检测的玉米组织中都有表达,呈多种表达模式。其中, ZmWRKY1-like和 ZmWRKY21-like基因在穗丝中的表达量最低, ZmWRKY4-like基因在根中的表达量最低。3个基因在幼果中的表达量都显著高于在其他组织中的表达量,特别是 ZmWRKY1-like在幼果中的表达量达到根中表达量的65倍。该结果说明这3个基因可能参与玉米植株不同组织器官的发育过程,特别是玉米籽粒的发育过程。
大量研究表明,WRKY蛋白参与植物对逆境胁迫的响应过程[16]。比如在拟南芥中,有近2 000 个干旱响应基因,其中就包含不少WRKY基因[28]。干旱和高盐处理时, AtWRKY25和 AtWRKY33 的表达量会提高,而它们的异源表达增强转基因植株对NaCl耐性[29]。高温胁迫诱导 AtWRKY25和 AtWRKY26的表达,而抑制 AtWRKY33 的表达[30]。过表达 OsWRKY45可以增强转基因植株对盐和干旱的耐受性[31]。过表达 GmWRKY21可以增强转基因拟南芥植株对低温的耐受性[32]。在本研究中,高盐处理下, ZmWRKY55-like基因出现上调表达,24 h为对照的2.2倍。 ZmWRKY1-like基因在干旱胁迫处理的24 h时表达量下调为对照的0.4倍。该结果表明, ZmWRKY1-like和 ZmWRKY21-like基因可能分别参与玉米植株对干旱和盐胁迫的响应。但具体的分子机制仍需要进一步研究分析。
参考文献Reference:
[1]刘强,张贵友.植物转录因子的结构与调控作用[J].科学通报,2000,45(14):1465-1474.
LIU Q,ZHANG G Y.Structure and regulation of plant transcription factors [J].ChineseScienceBulletin,2000,45(14):1465-1474.
[2]ISHIGURO S,NAKAMURA K.Characterization of a cDNA encoding a novel DNA-binding protein,SPF1,that recognizes SP8 sequences in the 5′ upstream regions of genes coding for sporamin and β-amylase from sweet potato[J].MolecularandGeneralGeneticsMGG,1994,244(6):563-571.
[3]YANG B,JIANG Y,RAHMAN M H,etal.Identification and expression analysis of WRKY transcription factor genes in canola(BrassicanapusL.) in response to fungal pathogens and hormone treatments[J].BMCPlantBiology,2009,9(1):68.
[4]LING J,JIANG W,ZHANG Y,etal.Genome-wide analysis of WRKY gene family inCucumissativus[J].BMCGenomics,2011,12(1):471.
[5]XIONG W,XU X,ZHANG L,etal.Genome-wide analysis of the WRKY gene family in physic nut(JatrophacurcasL.)[J].Gene,2013,524(2):124-132.
[6]LI H L,ZHANG L B,GUO D,etal.Identification and expression profiles of the WRKY transcription factor family inRicinuscommunis[J].Gene,2012,503(2):248-253.
[7]DONG J,CHEN C,CHEN Z.Expression profiles of theArabidopsisWRKY gene superfamily during plant defense response[J].PlantMolecularBiology,2003,51(1):21-37.
[8]HUAG X,LI K,XU X,etal.Genome-wide analysis of WRKY transcription factors in white pear(Pyrusbretschneideri) reveals evolution and patterns under drought stress[J].BMCGenomics,2015,16(1):1104.
[9]HE H,DONG Q,SHAO Y,etal.Genome-wide survey and characterization of the WRKY gene family inPopulustrichocarpa[J].PlantCellReports,2012,31(7):1199-1217.
[10]MUTHAMILARASAN M,BONTHALA V S,KHANDELWAL R,etal.Global analysis of WRKY transcription factor superfamily inSetariaidentifies potential candidates involved in abiotic stress signaling[J].FrontiersinPlantScience,2015,6:910.
[11]ROSS C A,LIU Y,SHEN Q J.The WRKY gene family in rice(Oryzasativa)[J].JournalofIntegrativePlantBiology,2007,49(6):827-842.
[12]CAI C,NIU E,DU H,etal.Genome-wide analysis of the WRKY transcription factor gene family inGossypiumraimondiiand the expression of orthologs in cultivated tetraploid cotton[J].TheCropJournal,2014,2(2):87-101.
[13]WEI K F,CHEN J,CHEN Y F,etal.Molecular phylogenetic and expression analysis of the complete WRKY transcription factor family in maize[J].DNAResearch,2012:dsr048.
[14]YIN G,XU H,XIAO S,etal.The large soybean(Glycinemax) WRKY TF family expanded by segmental duplication events and subsequent divergent selection among subgroups[J].BMCPlantBiology,2013,13(1):148.
[15]EULGEM T,RUSHTON P J,ROBATZEK S,etal.The WRKY superfamily of plant transcription factors[J].TrendsinPlantScience,2000,5(5):199-206.
[16]PANDEY S P,SOMSSICH I E.The role of WRKY transcription factors in plant immunity[J].PlantPhysiology,2009,150(4):1648-1655.
[17]ZHENG Z,MOSHER S L,FAN B ,etal.Functional analysis ofArabidopsisWRKY25 transcription factor in plant defense againstPseudomonassyringae[J].BMCPlantBiology,2007,7(1):2.
[18]ZHENG Z,QAMAR S A,CHEN Z,etal.ArabidopsisWRKY33 transcription factor is required for resistance to necrotrophic fungal pathogens[J].ThePlantJournal,2006,48(4):592-605.
[19]LI J,BRADER G,PALVA E T.The WRKY70 transcription factor:a node of convergence for jasmonate-mediated and salicylate-mediated signals in plant defense[J].ThePlantCell,2004,16(2):319-331.
[20]QIU Y,YU D.Over-expression of the stress-induced OsWRKY45 enhances disease resistance and drought tolerance inArabidopsis[J].EnvironmentalandExperimentalBotany,2009,65(1):35-47.
[21]WANG H,HAO J,CHEN X,etal.Overexpression of rice WRKY89 enhances ultraviolet B tolerance and disease resistance in rice plants[J].PlantMolecularBiology,2007,65(6):799-815.
[22]YUE H,WANG M,LIU S,etal.Transcriptome-wide identification and expression profiles of the WRKY transcription factor family in Broomcorn millet(PanicummiliaceumL.)[J].BMCGenomics,2016,17(1):343.
[23]齐涛.中国玉米国际竞争力研究[D].陕西杨凌:西北农林科技大学,2011.
QI T.Study on the intrnational competitiveness of corn in china [D].Yangling Shaanxi:Northwest A&F University,2011.
[24]刘巍.中国玉米及其深加工产品国际竞争力研究[D].北京:对外经济贸易大学,2009.
LIU W.Study on international competitiveness of Chinese corn and its deep processing products [D].Beijing:University of International Business and Economics,2009.
[25]颜君,郭兴启,曹学成.WRKY转录因子的基因组水平研究现状[J].生物技术通报,2015,31(11):9-17.
YAN J,GUO X Q,CAO X CH.Progress of genome-wide researches on WRKY transcription factors[J].BiotechnologyBulletin,2015,31(11):9-17.
[26]石红梅,战新梅,管世铭,等.牡丹PsWRKY基因的克隆和表达特性分析[J].植物生理学报,2015,51(10):1743-1748.
SHI H M,ZHAN X M,GAN SH M,etal.Clong and expression analysis ofPsWRKYin tree peony(Paeoniasuffruticosa)[J].PlantPhysiologyJournal,2015,51(10):1743-1748.
[27]向小华,吴新儒,晁江涛,等.普通烟草WRKY基因家族的鉴定及表达分析[J].遗 传,2016,38(9):840-856.
XIANG X H,WU X R,CHAO J T,etal.Genome-wide identification and expression analysis of the WRKY gene family in common tobacco(NicotianatabacumL.)[J].Hereditas,2016,38(9):840-856.
[28]HUANG D,WU W,ABRAMS S R,etal.The relationship of drought-related gene expression inArabidopsisthalianato hormonal and environmental factors[J].JournalofExperimentalBotany,2008,59(11):2991-3007.
[29]JIANG Y,DEYHOLOS M K.Functional characterization ofArabidopsisNaCl-inducible WRKY25 and WRKY33 transcription factors in abiotic stresses[J].PlantMolecularBiology,2009,69(1/2):91-105.
[30]LI S,FU Q,CHEN L,etal.ArabidopsisthalianaWRKY25,WRKY26 and WRKY33 coordinate induction of plant thermo tolerance[J].Planta,2011,233(6):1237-1252.
[31]QIU Y,YU D.Over-expression of the stress-induced OsWRKY45 enhances disease resistance and drought tolerance inArabidopsis[J].EnvironmentalandExperimentalBotany,2009,65(1):35-47.
[32]ZHOU Q Y,TIAN A G,ZOU H F,etal.Soybean WRKY-type transcription factor genes,GmWRKY13, GmWRKY21 and GmWRKY54,confer differential tolerance to abiotic stresses in transgenicArabidopsisplants[J].PlantBiotechnologyJournal,2008,6(5):486-503.
