甲醚菊酯降解菌的分离鉴定及其农药降解酶的纯化
2018-04-08黄升谋李云捷吴进菊李玉奇湖北文理学院化学工程与食品科学学院湖北襄阳44053襄阳市中心医院湖北襄阳44053
阎 华,王 会,于 博*,黄升谋,李云捷,吴进菊,李玉奇(.湖北文理学院 化学工程与食品科学学院,湖北 襄阳 44053; .襄阳市中心医院,湖北 襄阳 44053)
甲醚菊酯是一种人工合成的高效拟除虫菊酯类杀虫和杀螨剂。该农药具有典型的触杀和胃毒作用,无内吸和熏蒸作用。其杀虫谱广,对绝大多数昆虫和螨虫具有良好的效果,杀灭时间短[1]。甲醚菊酯在土壤中不移动,对环境影响相对较小,但是其残效期较长,因此容易通过食物链进入人体,造成人体组织的损伤[2]。该农药适用作物有香蕉、大麦、棉花、莴苣、茶、苹果、甜瓜、大葱等。在农业上,甲醚菊酯防治对象主要是各种鳞翅目幼虫、粉虱、蚜虫、植食性叶螨[3]。由于甲醚菊酯农药的广泛应用,其残留造成的环境污染和食品污染直接威胁到人体健康。
生物原位修复方法相对来说对残留农药的清除是比较有效的,因此越来越受到研究人员的重视。分离获取微生物产生的酶用于降解农药,具有较多优点[3]:(1)农药降解速度快,效率高,即使农药的浓度比较低,酶也能进行催化;(2)安全无毒副作用,其降解产物可以溶解于水体中流入大海并进行光氧化作用;(3)农药降解酶通常比产生这类酶的微生物菌体更能耐受异常环境条件,具有更宽广的温度和pH值稳定范围;(4)具有比微生物更宽广的降解谱,可以对具有相同基团的农药进行酶降解作用。由微生物发酵后制备的粗酶蛋白,通常含有多种杂蛋白及其他小分子物质。将有活力的酶从粗酶中有效分离出来,并测定其酶学性质,有利于酶的综合开发利用。因而,本研究采用平板划线培养的方法从湖北省襄阳市农药厂下水道活性污泥中分离得到对甲醚菊酯农药有降解作用的细菌菌株,然后采用DEAE-52和CM-52阴阳离子纤维素交换层析柱对该菌株中甲醚菊酯降解酶进行了部分纯化。获得部分纯化酶以后,通过SDS-PAGE不连续凝胶电泳分析,确定该酶蛋白的分子质量,并评价阴阳离子纤维素交换层析柱的纯化效果。最后对该细菌菌株中甲醚菊酯降解酶的酶促反应最适温度、最适pH值及反应动力学特性进行了研究,为其应用于农药污染物的原位降解奠定理论和实践基础。
1 材料和方法
1.1 试剂与培养基
SDS、丙烯酰胺、甲叉双丙烯酰胺、过硫酸铵、四甲基乙二胺、溴酚蓝、甘氨酸、考马斯亮蓝G-250、三羟甲基氨基甲烷、牛血清白蛋白、琼脂糖,均购自上海生工生物工程有限公司;标准蛋白质Marker,购自日本Takara公司;20%甲醚菊酯乳油,购自浙江威尔达化工有限公司;甲醚菊酯标样,购自北京康林科技有限公司。富集培养基和无机盐培养基的配制和灭菌方法参照文献[4]。
1.2 仪器与设备
UV-362型紫外-可见分光光度计,购自日本日立公司;TV-200型振荡型恒温水浴锅,购自上海一恒科学有限公司;DHZ-5型恒温振荡器,购自太仓市强乐实验设备有限公司;中空纤维超滤膜管,购自广州能淼环保科技有限公司;BD-164蛋白电泳仪、电泳槽,购自美国Bio-Rad公司;HP6890气相色谱仪,购自美国惠普公司。
1.3 菌株分离及鉴定
准确称取湖北省襄阳市农药厂下水道活性污泥10 g放入250 mL锥形瓶,然后添加100 mL无机盐培养基,最初设定甲醚菊酯质量浓度为100 mg/L,锥形瓶置于30 ℃、150 r/min的摇床上振荡培养7 d。然后转接5 mL培养液至二次无机盐培养基(设定甲醚菊酯200 mg/L),在30 ℃、150 r/min的摇床上振荡培养7 d,以此重复接种5次,设置100 mg/L的质量浓度梯度,使最后无机盐培养液中甲醚菊酯的质量浓度为500 mg/L,从而获得对甲醚菊酯有降解活力的菌株。而后将菌悬液制备成10-6稀释液,在固体富集培养基上划线涂布,30 ℃培养2 d,根据细菌生长的外观形态和特征选取单菌落,反复划线培养,最后将分离得到的菌株(XU-3)接种于固体富集培养基斜面,保存于4 ℃冰箱备用。
甲醚菊酯降解菌株的形态、生理生化特征鉴定方法参照《常见细菌系统鉴定手册》[5]。降解菌株总DNA的制备方法参照文献[3],使用细菌16S rDNA通用引物FT1(5′-TGAGTTTGATTATGGCTCAG-3′)和RK2(5′-GAGGTTACCTTGTGTCGACTT-3′),采用PCR扩增仪扩增降解菌的16S rDNA片段。PCR扩增的产物用2%琼脂糖凝胶电泳进行分离,然后利用DNA胶回收试剂盒收集纯化PCR扩增产物,最后送到深圳华大基因股份有限公司进行测序,将测序结果登录NCBI网站,使用Blast软件进行16S rDNA序列同源性比较。
1.4 甲醚菊酯降解菌XU-3粗酶液的制备及其可溶性蛋白含量测定
甲醚菊酯降解菌XU-3粗酶液的制备参照文献[6]开展。可溶性蛋白含量的测定参照文献[7],使用福林酚法。
1.5 甲醚菊酯农药含量和菌体酶活力测定
甲醚菊酯农药含量测定参照文献[8],使用气相色谱法。酶活力测定方法参照文献[9],酶活力单位(U)定义为每分钟降解1 mg甲醚菊酯所需的酶量。
1.6 甲醚菊酯降解菌XU-3生长与降解酶活力的关系试验
采用添加50 mg/L甲醚菊酯作为唯一碳、氮源的无机盐培养基培养XU-3菌株,在30 ℃、pH值7.0、150 r/min的条件下振荡培养120 h,每隔12 h测定XU-3菌液的OD600 nm[10],同时按照1.5的方法测定培养基中残留甲醚菊酯农药的含量,计算出菌体酶活力单位。
1.7 甲醚菊酯降解酶的部分纯化
1.7.1DEAE-52阴离子交换层析使用1 mol/L的HCl溶液处理DEAE-52树脂成Cl-型。用0.005 mol/L Na2HPO4-NaH2PO4缓冲液平衡DEAE-52柱子24 h后,加样XU-3粗酶液20.0 mL,然后使用0.005 mol/L Na2HPO4-NaH2PO4缓冲液洗脱,最后使用0.1~0.5 mol/L NaCl梯度洗脱。用自动收集器收集流出液,自动收集器设定为9 min/格,流速为9 滴/min。收集时间约9 h,得到XU-3酶蛋白的收集峰。按照1.5的方法测定出峰样品的酶活力,将有活力的样品合并后用透析膜和聚乙二醇-20000进行浓缩。部分酶液进行蛋白质含量和酶活力测定,其余保存于4 ℃冰箱备用。
1.7.2CM-52阳离子交换层析使用1 mol/L的NaOH 溶液处理CM-52树脂成Na+型。用0.005 mol/L Na2HPO4-NaH2PO4缓冲液平衡CM-52柱子24 h后,加样浓缩过的XU-3酶液,然后使用0.005 mol/L Na2HPO4-NaH2PO4缓冲液洗脱,最后使用0.1~0.5 mol/L NaCl梯度洗脱。用自动收集器收集流出液,自动收集器设定为9 min/格,流速为9 滴/min。收集时间约8 h,得到XU-3酶蛋白的收集峰。然后将有活力的收集峰合并浓缩,测定蛋白质含量和酶活力后,保存于4 ℃备用。
1.8 酶蛋白纯度鉴定及其分子质量测定
酶蛋白的纯度鉴定及其分子质量的测定参照文献[9]开展,使用SDS-PAGE不连续凝胶电泳法。电泳完成后,与标准蛋白质条带位置相比较,测算出甲醚菊酯降解酶蛋白的分子质量。
1.9 甲醚菊酯降解酶特性研究
1.9.1酶促反应最适温度测定将纯化后的甲醚菊酯降解酶配制成0.01 mg/mL的液体,分别在20、25、30、35、40、45、50、55、60 ℃恒温水浴中保持60 min,然后根据1.5的方法测定酶活力,以酶活力最高值为基准,测算出各温度下的相对活力[11],相对活力最高值所对应的温度即为酶促反应最适温度。
1.9.2酶促反应最适pH值测定将纯化后的甲醚菊酯降解酶配制成0.01 mg/mL的液体,用0.1 mol/L HCl或者NaOH分别调节pH值为5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0,并保持60 min,然后按照1.5的方法测定酶活力,以酶活力最高值为基准,测算出各pH值下的相对活力[12],相对活力最高值所对应的pH值即为酶促反应最适pH值。
1.9.3酶促反应动力学测定分别配制0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0 mmol/L的甲醚菊酯溶液,在最适条件下按照1.5的方法测定酶活力,以单位时间底物浓度[S]减少量计算出反应速率V。使用Lineweaver-Burk双倒数作图法测算甲醚菊酯降解酶对底物的米氏常数Km和最大反应速率Vmax。Lineweaver-Burk方程[11]如下所示:
2 结果与分析
2.1 甲醚菊酯降解菌XU-3菌落形态特征
采用平板划线培养的方法从湖北省襄阳市农药厂下水道活性污泥中分离得到1株细菌XU-3,在30 ℃采用营养琼脂平板培养24 h后,可见其菌落形态为黄色、湿润圆形略隆起、边缘整齐,直径2 mm左右。
2.2 甲醚菊酯降解菌XU-3生理生化特征及其16S rDNA鉴定结果
采用VITEK-32 全自动微生物鉴定仪分析菌株XU-3的形态和生理生化特性,结果见表1。从表1可以看出,菌株XU-3属于革兰氏阴性菌,短杆状,其生化反应具有典型的阴沟肠杆菌(Enterobactercloacae)特性。同时以菌株XU-3总DNA为模板,采用细菌16S rDNA通用引物FT1和RK2进行PCR扩增,得到长度为836 bp的16S rDNA基因片段。测序后将XU-3的16S rDNA序列与GenBank上其他细菌的序列进行同源性比对,结果发现,该菌株的16S rDNA与阴沟肠杆菌BX273453.1菌株的同源性达98.0%。综合菌株XU-3的形态、生理生化特性和16S rDNA序列分析结果,将菌株XU-3鉴定为阴沟肠杆菌。

表1 菌株XU-3的形态和生理生化特性
注:+代表阳性,-代表阴性。
2.3 甲醚菊酯降解菌XU-3生长与降解酶活力的关系
采用添加50 mg/L甲醚菊酯作唯一碳、氮源的无机盐培养基振荡培养阴沟肠杆菌XU-3,测定不同时间段菌株生长和甲醚菊酯降解酶活力的关系。由图1可以看出,甲醚菊酯降解酶的活力大小变化和菌株XU-3生长速度基本一致,都在60 h达到最大值。因此,用于制备甲醚菊酯降解酶的培养时间选择60 h较为合适。

图1 菌株XU-3生长与甲醚菊酯降解酶活力的关系
2.4 甲醚菊酯降解酶的纯化
2.4.1DEAE-52纤维素柱层析20.0 mL粗酶液经过DEAE-52柱层析后,具有甲醚菊酯农药降解活力的酶蛋白出现在馏分管的第20~40管(图2)。DEAE-52柱层析后酶蛋白得到初步纯化,将获得的第20~40 管酶蛋白使用透析膜和聚乙二醇-20000进行除盐和浓缩,共收集到浓缩后的酶液5.6 mL。

图2 甲醚菊酯降解酶的DEAE-52纤维素柱层析结果
2.4.2CM-52纤维素柱层析5.6 mL DEAE-52浓缩后的酶液经过CM-52柱层析后,具有甲醚菊酯农药降解活力的酶蛋白出现在馏分管的第25~45 管(图3)。将第25~45 管的酶液使用透析膜和聚乙二醇-20000进行除盐和浓缩,共收集到浓缩后的酶液2.2 mL。

图3 甲醚菊酯降解酶的CM-52纤维素柱层析结果
2.4.3部分纯化结果分析阴沟肠杆菌XU-3中甲醚菊酯降解酶经过部分纯化的结果见表2。结果显示,最初阴沟肠杆菌XU-3中破碎得到的粗酶液总体积为20.0 mL,通过DEAE-52柱层析后,酶液总体积为5.6 mL,再通过CM-52柱层析后,酶液总体积为2.2 mL。甲醚菊酯降解酶经过部分纯化后,酶液的总体积降低,而其酶蛋白比活力上升,所以DEAE-52和CM-52柱层析对酶蛋白具有纯化作用。最初酶的总蛋白质量为12.4 mg,通过DEAE-52柱层析后,总蛋白质量为2.6 mg,再通过CM-52柱层析后,总蛋白质量为1.9 mg,酶蛋白得到了进一步的纯化。酶总活力最初为189.4 U,通过DEAE-52柱层析后,总活力为146.8 U,再通过CM-52柱层析后,总活力为126.5 U。这表明,酶的总活力随着纯化过程会逐渐降低,主要是纯化过程中回收率降低的原因。而酶的比活力是升高的,最初酶的比活力为15.2 U/mg,通过DEAE-52柱层析后,酶的比活力上升为56.5 U/mg,再通过CM-52柱层析后,酶的比活力上升为66.6 U/mg。综合计算后,纯化倍数为4.4,回收率为66.8%,相对而言酶蛋白的回收率较高[7]。

表2 菌株XU-3中甲醚菊酯降解酶的纯化结果
2.5 甲醚菊酯降解酶的电泳分析
将纯化的甲醚菊酯降解酶进行SDS-PAGE不连续凝胶电泳分析,从图4可以看出,甲醚菊酯降解酶出现较为清晰的条带,该条带较粗,考马斯亮蓝染色较深,表明经过纯化的酶较为均一,酶蛋白量较丰富。根据SDS-PAGE不连续凝胶电泳的酶分子质量计算方法,阴沟肠杆菌XU-3中甲醚菊酯降解酶的分子质量约为74.8 ku。

M.标准蛋白质Marker;1—2.甲醚菊酯降解酶图4 菌株XU-3中甲醚菊酯降解酶的SDS-PAGE不连续凝胶电泳分析
2.6 甲醚菊酯降解酶的特性
2.6.1酶促反应最适温度将甲醚菊酯降解纯化酶在不同温度保持60 min后,对其酶活力进行了测定(图5)。从图5可以看出,酶促反应最适温度为35 ℃,该酶在25~40 ℃时活力较为稳定,相对酶活力可以达到60%以上。温度对酶活力的影响体现在两方面[12]。一方面,酶促反应速度随温度的升高而增加,主要原因是较高温度有助于酶的分子构象改变,更容易和底物相结合。本研究中,温度从20 ℃上升到35 ℃时,酶活力明显增加。另一方面,当温度升高到一定程度时,由于酶蛋白出现变性,酶活力会逐渐降低甚至完全消失。本研究中,温度从35 ℃上升到60 ℃时,酶活力下降明显,60 ℃时,相对酶活力仅为20%左右。综合以上结果,阴沟肠杆菌XU-3中甲醚菊酯降解酶的最适反应温度为35 ℃。
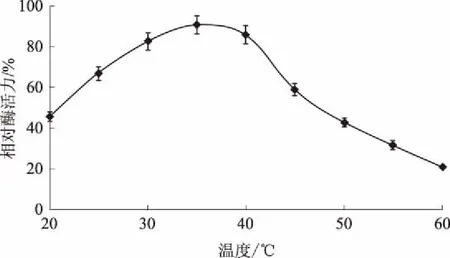
图5 不同温度处理对甲醚菊酯降解酶活力的影响
2.6.2酶促反应最适pH值酶液中pH值对酶活力的影响是多方面的[9]:可能改变酶蛋白分子构象,进而影响酶活力中心基团,使酶活力发生改变;也可能改变酶的解离状态,一般来说,只有特定解离状态最适合酶促反应。本研究将甲醚菊酯降解纯化酶在不同pH值保持60 min后,对其酶活力进行了测定(图6)。从图6可以看出,酶促反应最适pH值为8.5,该酶在pH值7.5~9.0时活力较为稳定,相对酶活力可以达到60%以上。由此可以推测,阴沟肠杆菌XU-3中甲醚菊酯降解酶是一种偏碱性水解酶,在偏碱性环境中可以发挥农药降解作用。当pH值低于8.5时,酶活力随pH值降低而降低,在pH值5.0时,相对酶活力仅为20%左右。当pH值高于8.5时,酶活力随pH值上升而降低,在pH值10.0时,相对酶活力不足25%。 综合以上结果, 阴沟肠杆菌XU-3中甲醚菊酯降解酶的最适反应pH值为8.5。

图6 不同pH值处理对甲醚菊酯降解酶活力的影响
2.6.3酶促反应动力学参数采用Lineweaver-Burk双倒数作图法对甲醚菊酯降解酶进行了酶促反应动力学测定,以酶促反应速度倒数1/V对底物浓度倒数1/[S]作图,采用线性回归方程来计算反应动力学相关参数。由图7可以看出,甲醚菊酯降解酶对底物甲醚菊酯的降解作用符合米氏方程线性特征。其标准曲线的R2为0.994,表明线性拟合较好,可以用于反应动力学参数的计算。通过线性回归方程计算后得到,Km为0.825 mmol/L,Vmax为0.748 mmol/(L·min)。

图7 菌株XU-3中甲醚菊酯降解酶对底物作用的Lineweaver-Burk曲线
3 结论与讨论
本研究采用平板划线培养的方法从湖北省襄阳市农药厂下水道活性污泥中分离获得了对甲醚菊酯有降解作用的细菌菌株XU-3,经过VITEK-32全自动细菌鉴定仪分析,综合其形态、生理生化特征和16S rDNA序列分析结果,将其鉴定为阴沟肠杆菌(Enterobactercloacae)。阴沟肠杆菌XU-3可以生长于甲醚菊酯农药作为唯一碳、氮源的无机盐培养基中,培养时间为60 h时,可以获得最大量的甲醚菊酯降解酶,降解酶活力达到8.5 U/mL。随后使用DEAE-52和CM-52阴阳离子交换层析柱对阴沟肠杆菌XU-3中甲醚菊酯降解酶进行了部分纯化,经检测分析,纯化了4.4倍,酶活力回收率为66.8%。使用SDS-PAGE不连续凝胶电泳分析发现,纯化酶的分子质量约为74.8 ku,属于小分子质量酶蛋白,后续研究中可以对其进行基因序列测定。本研究获得纯酶后,测定了酶促反应最适温度、最适pH值及反应动力学等基本性质,有助于甲醚菊酯降解酶的实际应用。测定结果表明,酶促反应最适温度为35 ℃,最适pH值为8.5,在温度25~40 ℃和pH值7.5~9.0内,甲醚菊酯降解酶具有良好的热稳定性和酸碱稳定性,该范围和农药厂下水道的环境相匹配。酶促反应动力学测定表明,该降解酶对底物甲醚菊酯农药的Km为0.825 mmol/L,Vmax为0.748 mmol/(L·min),说明该酶对甲醚菊酯的降解属于正向反应,降解速度较快。研究该酶的纯化特性也有助于更深入研究XU-3降解甲醚菊酯农药的机制,后续研究中可以探讨其属于水解作用、氧化作用还是矿化作用,并且可以研究其反应产物。
参考文献:
[1]陈少华,罗建军,肖盈,等.一株拟除虫菊酯农药降解菌的分离鉴定及其降解特性与途径[J].环境科学学报,2011,31(8):1616-1625.
[2]Aksoy A,Gacar A.Evaluation of changes in monoamine levels and apoptosis induced by cyfluthrin in rats[J].Toxicology Research,2015,3:331-340.
[3]Zhai Y,Li K,Song J L.Molecular cloning,purification and biochemical characterization of a novel pyrethroid-hydrolyzing carboxylesterase gene fromOchrobactrumanthropiYZ-1[J].Journal of Hazardous Materials,2012,16:221-222.
[4]Hu G P,Zhao Y,Song F Q,etal.Isolation,identification and cyfluthrin-degrading potential of a novelLysinibacillussphaericusstrain,FLQ-11-1[J].Research in Microbiology,2014,165:110-118.
[5]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京: 科学出版社,2001:128-192.
[6]Wang J H,Ren L,Jia Y,etal.Degradation characteristics and metabolic pathway of 4-nitrophenol by a halotolerant bacteriumArthrobactersp.CN2[J].Toxicological and Environmental Chemistry,2016,98:226-240.
[7]Fan X J,Liu X L,Huang R,etal.Identification and characterization of a novel thermostable pyrethroid-hydrolyzing enzyme isolated through metagenomic approach[J].Microbial Cell Factories,2012,5:11-33.
[8]Yang Z,Fu X.Monitoring of total type Ⅱ pyrethroid pesticides in citrus oils and water by converting to a common product 3-phenoxybenzoic acid[J].Journal of Agricultural and Food Chemistry,2012,60:50-65.
[9]林淦,王兆守,尤民生.甲氰菊酯的酶促降解[J].化学与生物工程,2005,22(3):13-15.
[10]秦坤,朱鲁生,王金花.氯氰菊酯降解真菌的筛选及其降解特性研究[J].环境工程学报,2010,4(4):950-954.
[11]刘艳,范丽薇,王晓萍.氯嘧磺隆降解菌的分离鉴定及其降解特性[J].微生物学通报,2010,37(8):1164-1168.
[12]崔志峰,汪华,王渭霞,等.氯氰菊酯降解菌CY22-7的分离鉴定及降解特性研究[J].环境污染与防治,2009,31(11):35-38,43.
