银杏酚C17 1与顺铂联用逆转A549/DDP细胞对顺铂的耐药性
2018-04-03董燕李月英张心驰杨小明厉琳杰马文斌
董燕,李月英,张心驰,杨小明,厉琳杰,马文斌
(江苏大学1.医学院,2.食品与生物工程学院,江苏 镇江212013)
非小细胞肺癌(non-small cell lung cancer,NSCLC)占所有肺癌80%~85%[1]。目前,基于铂类药物的联合化疗方案是NSCLC标准的药物治疗方案之一,但其毒副作用大且易产生耐药性,是治疗失败的重要原因[2]。研究表明,中药因其毒副作用小,效价高,在临床肿瘤辅助治疗中发挥重要作用[3]。
核转录因子E2相关因子2(nuclear factor-erythroid 2 related factor 2,Nrf2)是一种抗氧化应激的核转录因子[4],其激活后自Keap1蛋白解离进入胞核与抗氧化反应元件(ARE)结合,启动下游靶基因多药耐药相关蛋白1(multidrug resistance associated protein 1,Mrp1)等表达,参与细胞耐药性的调控[5-6]。Nrf2-ARE信号通路在癌症中呈高表达,促进癌症的发生发展,是诱发多种癌细胞耐药产生的重要因素[7]。在肺癌和乳腺癌中,下调Nrf2可显著增强肿瘤细胞对化疗药物的敏感性[8]。因此,亟待寻找一种抑制Nrf2/Keap1信号通路的新型物质,来辅助治疗化疗耐药的肺癌。
银杏作为中国传统药物,已有上千年的治疗历史[9]。银杏酚C17 1是银杏外种皮提取物烷基酚类化合物中的银杏酚单体之一,具有细胞毒性,但低剂量时细胞毒性较弱[10]。有研究揭示,与银杏酚其他单体比较,银杏酚C17 1抗肿瘤活性最高,可抑制肝癌HepG2细胞增殖、迁移和侵袭[11]。本课题组前期研究结果表明[12],银杏酚C17 1与顺铂联用可促进肝癌细胞的凋亡,但其能否作为顺铂的辅助药物增强化疗敏感性尚不清楚。因此,本研究将银杏酚C17 1与顺铂联合作用,观察A549/DDP耐药细胞中Nrf2/Keap1信号通路及下游蛋白Mrp1表达的情况,探讨银杏酚C17 1与顺铂联用对A549/DDP耐药细胞的作用机制。
1 材料与方法
1.1 材料
人肺腺癌A549、A549/DDP细胞株购自中国科学院上海生命科学研究院。纯度98%银杏酚C17 1(江苏大学食品学院);RPMI 1640(Wisent公司);胎牛血清(Gibco公司);顺铂、MTT试剂(Sigma公司);Transwell小室(Corning公司);流式细胞凋亡检测试剂盒Annexin V-FITC/PI(美国BD公司);二甲基亚砜(Sigma公司);Mrp1、Keap1、Bcl2、Bax、β-肌动蛋白及组蛋白H3抗体(Cell Signaling Technology公司);Nrf2蛋白抗体(Abcam公司);HRP标记的兔二抗、鼠二抗(碧云天生物技术公司);PVDF膜、ECL-plus发光剂(美国Millipore公司)。
1.2 方法
1.2.1细胞培养 A549、A549/DDP细胞株培养于含10%胎牛血清的RPMI1640培养基中,并置于37℃、5%CO2饱和湿度的培养箱中孵育;在A549/DDP细胞培养基中加入1 mg/mL顺铂维持 A549/DDP细胞的耐药性。细胞生长密度达90%时用胰酶消化传代;取处于对数生长期的细胞,进行后续实验。
1.2.2MTT法检测细胞活性 收集 A549、A549/DDP细胞用RPMI 1640培养液稀释成1×105/mL,接种于96孔板,每孔100μL,置于37℃、5%CO2培养箱中孵育12 h。根据不同的实验目的进行分组,在检测顺铂对细胞活性的影响时,分为对照组(顺铂0 mg/L)和实验组(顺铂 1,2,4,8,16 mg/L),分别作用于A549/DDP细胞24 h;在检测银杏酚与顺铂联用对耐药细胞活性的影响时,分为对照组[顺铂(0 mg/L)+银杏酚(0 mg/L)]和实验组[不同浓度顺铂(1、2、4、8、16 mg/L)分别与不同浓度银杏酚 C17 1(10、20、40mg/L)],共同作用于A549/DDP细胞24 h;每孔加入10μLMTT溶液(5mg/mL),避光培养4 h;弃培养液,每孔加入100μL二甲基亚砜,彻底混合。使用酶标仪(美国Bio-Rad公司)在490 nm波长处测量光密度值(D)。每组实验重复3次,设置5个复孔。细胞相对存活率=(实验组D均值-空白对照组D均值)/(实验对照组D均值-空白对照组D均值)。
1.2.3Transwell实验检测 A549/DDP细胞迁移和侵袭能力
1.2.3.1细胞迁移实验 取对数生长期 A549/DDP细胞,胰酶消化,用无血清RPMI 1640培养基悬浮细胞,调整细胞密度为2×105/mL。用无血清RPMI 1640培养基配置药物,在下室(24孔板底部)加入500μL含10%血清的RPMI 1640培养液,上室加入300μL悬浮细胞以及相应的药物(0 mg/mL顺铂,4 mg/mL顺铂,4 mg/mL顺铂分别与 10、20、40 mg/L银杏酚 C17 1联用),于 37℃、5%CO2培养箱中培养24 h;4%低聚甲醛固定细胞30 min;吉姆萨染液染色20 min;蒸馏水清洗小室,用棉花将上室内的染液轻轻擦干,待晾干后于高倍镜下(×200)观察细胞,随机选取10个视野计数(迁移细胞数)。每组实验重复3次,计算细胞迁移率=实验组迁移细胞数/对照组迁移细胞数。
1.2.3.2细胞侵袭实验 用4℃预冷的无血清RPMI 1640培养基稀释基质胶至终浓度为1 mg/mL;取60μL加入小室上部,37℃温育4~5 h使其干成胶状;后续步骤同迁移实验。
1.2.4免疫印迹法检测Nrf2/Keap1信号通路相关蛋白的表达 将对数生长期A549/DDP细胞接种于6孔板,每孔约1×106个,每组设置3个复孔。培养过夜后,分别加入含 0 mg/mL,4 mg/mL顺铂,4 mg/mL顺铂分别与10、20、40 mg/L银杏酚 C17 1联用的培养基,置于37℃、5%CO2培养箱中培养24 h;加入预热的细胞裂解液(70μL)裂解细胞,提取总蛋白;100℃煮沸5min;超声仪破碎10 s,离心30 s;提取的蛋白储存于-20℃备用。
配置10%或12%聚丙烯酰胺凝胶,70 V电泳2 h;转膜(PVDF膜)2 h;用含 5%牛奶的 TBST(80 g/L NaCl,2 g/L KCl,30 g/L Tris,0.1%Tween-20;pH=7.4)封闭 1 h;加入一抗 Nrf2、Keap1、Mrp1、Bcl2、Bax抗体(1 1 000)及内参β-肌动蛋白和组蛋白H3抗体(1 1 000)4℃孵育过夜;TBST洗膜3次,每次10 min;除内参 β-肌动蛋白为鼠二抗(1 1 000),其他蛋白均为兔二抗(1 1 000),孵育1 h;TBST洗膜3次,每次15min;ECL发光剂曝光;Lane 1D凝胶分析软件进行灰度扫描,得出灰度值。蛋白相对表达量=目的蛋白灰度值/β-肌动蛋白灰度值,每组实验重复3次。1.2.5 流式细胞术检测细胞凋亡 取对数期生长A549/DDP细胞,均匀接种于24孔板,每孔约3×104个,每组设3个复孔。过夜贴壁后加药(0 mg/mL顺铂,4 mg/mL顺铂,4mg/mL顺铂分别与 10、20、40 mg/L银杏酚 C17 1联用)培养 24 h;用0.25%无EDTA的胰酶消化细胞,蒸馏水洗3次,离心;取100μL过筛后的细胞(3×104个/mL)悬浮于流式管中,于冰上避光条件下依次加入10μL Annexin V-FITC和5μL PI,轻轻混匀;10 min后加入缓冲液400μL,设置一组单染的阳性对照,2 h内利用流式细胞仪检测细胞凋亡率。
1.3 统计学分析
运用SPSS 22.0软件分析数据,每组实验重复3次,实验结果以均数±标准差(±s)表示,多组比较行单因素方差分析,实验组与对照组比较采用Dunnett-t检验,P<0.05为差异具有统计学意义。采用Origin法计算肺腺癌细胞增殖的半数抑制浓度(50%inhibitory concentration,IC50)。
2 结果
2.1 顺铂对敏感A549细胞和耐药细胞A549/DDP细胞活性的影响
MTT检测结果如图1所示,单独顺铂作用,敏感A549细胞和耐药A549/DDP细胞活性均不同程度地被抑制,但抑制A549/DDP细胞活性明显需要更高浓度的顺铂;经计算得出 A549和 A549/DDP细胞的 IC50所需的顺铂浓度分别为(7.0±0.09)mg/L和(40.0±0.13)mg/L,A549/DDP细胞对顺铂的耐药性是A549细胞的5.8倍,表明A549/DDP是顺铂耐药细胞株。根据MTT的结果,本研究选取4 mg/L顺铂进行后续实验。

图1 不同浓度的顺铂对A549和A549/DDP细胞活性的影响
2.2 银杏酚C17 1对A549/DDP耐药细胞迁移的影响
与对照组比较,顺铂组耐药细胞迁移率没有显著的变化(P>0.05);但与对照组及顺铂组相比,10,20,40 mg/L银杏酚C17 1与顺铂联用明显抑制耐药细胞的迁移能力(P<0.05),且呈银杏酚C17 1剂量依赖性。见图2。结果表明,银杏酚C17 1能增强顺铂对A549/DDP耐药细胞迁移的抑制能力。
2.3 银杏酚C17 1对A549/DDP耐药细胞侵袭的影响
如图3所示,与对照组相比,顺铂组细胞侵袭力稍有降低,但差异无统计学意义(P>0.05);与对照组及顺铂组比较,银杏酚与顺铂联用时,随着银杏酚C17 1浓度(10,20,40 mg/L)的升高,细胞侵袭数量呈明显下降趋势(P<0.05)。由此说明,银杏酚C17 1能够增强顺铂对A549/DDP耐药细胞侵袭的抑制能力。
2.4 银杏酚C17 1对A549/DDP细胞耐药的逆转作用
MTT法检测结果如图4所示,与对照组相比,银杏酚 C17 1(10,20,40mg/L)与顺铂1mg/L联用时,细胞存活率没有明显变化(P>0.05);同时,银杏酚 C17 1(10,20 mg/L)与顺铂 2 mg/L联合作用时,细胞活性较对照组也没有明显差异(P>0.05)。其余各实验组细胞活性与对照组相比差异均具有统计学意义(P<0.05或 P<0.01)。结果表明,银杏酚C17 1剂量上调增强顺铂的细胞毒性,逆转耐药细胞对顺铂的耐药性。

图2 不同剂量银杏酚C17 1与顺铂联用对A549/DDP耐药细胞迁移的影响(×200)
2.5 银杏酚C17 1对A549/DDP耐药细胞Nrf2/Keap1信号通路的影响
如图5所示,与对照组和顺铂组相比,顺铂与不同浓度银杏酚 C17 1(10,20,40 mg/L)联合应用组总Nrf2与核内Nrf2表达明显降低(P<0.05或P<0.01),其结合蛋白 Keap1表达明显增加(P<0.05或P<0.01)。

图3 不同剂量银杏酚C17 1与顺铂联用对A549/DDP耐药细胞侵袭的影响(×200)
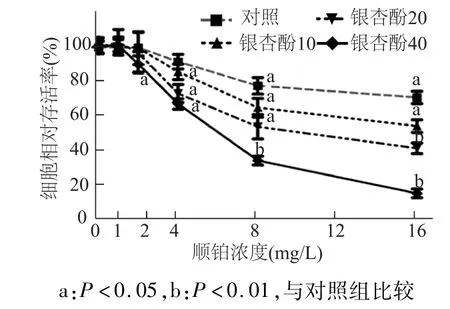
图4 不同剂量银杏酚C17 1与顺铂联用对A549/DDP耐药细胞活性的影响
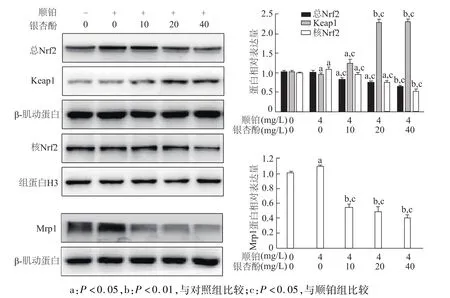
图5 不同剂量银杏酚C17 1与顺铂联用对A549/DDP耐药细胞Nrf2/Keap1信号通路相关蛋白表达的影响
同时下游Mrp1蛋白表达也明显降低(P<0.05)。由此表明,银杏酚 C17 1可能通过抑制Nrf2/Keap1信号通路逆转 A549/DDP细胞的耐药性。
2.6 银杏酚C17 1对A549/DDP耐药细胞凋亡蛋白表达的影响
如图6所示,与对照组及顺铂组相比,随着银杏酚C17 1浓度的增加,促凋亡蛋白Bax的表达逐渐增强(P<0.05),而抗凋亡蛋白Bcl2表达逐渐被抑制(P<0.05)。Bcl2/Bax比值呈现明显下降趋势(P<0.05),故可初步推断银杏酚C17 1与顺铂联用能够促进耐药细胞A549/DDP的凋亡。

图6 不同剂量银杏酚C17 1与顺铂联用对A549/DDP耐药细胞凋亡蛋白的影响
2.7 银杏酚C17 1对A549/DDP耐药细胞凋亡的影响
流式细胞术检测结果显示,对照组自发凋亡率与顺铂组比较无明显差异(P>0.05),而银杏酚C17 1(10,20,40 mg/L)与顺铂联用后,与对照组及顺铂组相比,早期凋亡率显著升高(P<0.05),且呈银杏酚浓度依赖性。见图7。由此进一步确定银杏酚C17 1与顺铂联用能促进A549/DDP细胞凋亡。
3 讨论
肺癌的病死率逐年增加,大多数患者的死亡受到不同程度耐药的影响[13]。近来研究发现,基于中药成分的抗癌药物具有良好的安全性、稳定性和效价高等特点,如银杏提取物(Ginkgo biloba)[14]。迁移和侵袭能力是肿瘤恶性的生物学标志[15]。本研究Transwell实验结果显示,银杏酚C17 1与顺铂联用,抑制肺癌耐药细胞的迁移和侵袭能力且呈浓度依赖性;此外,银杏酚C17 1作用后,顺铂对A549/DDP细胞的IC50显著下降,提高了耐药细胞对顺铂的敏感性。上述结果初步确定银杏酚C17 1可增强肺癌耐药细胞对顺铂的敏感性。
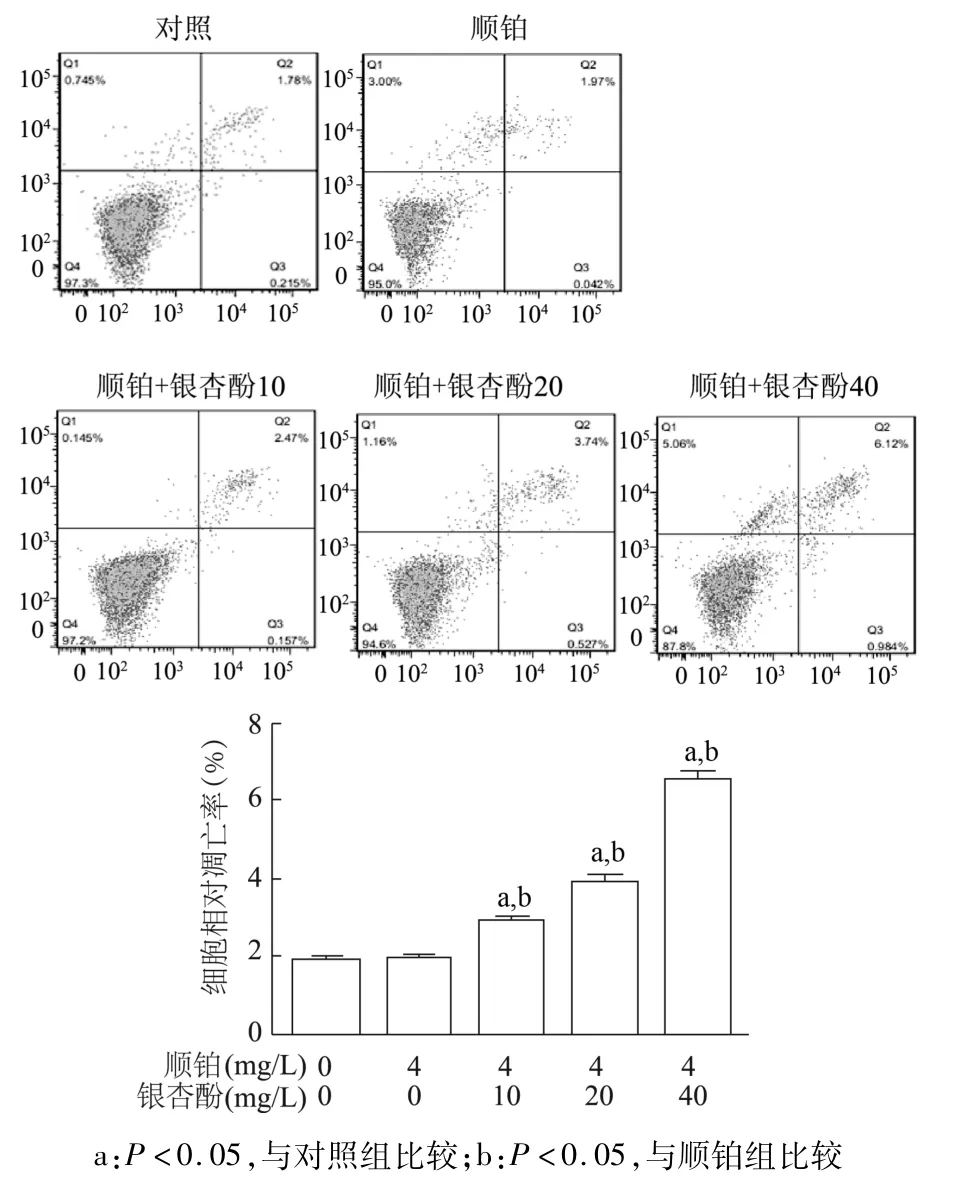
图7 不同剂量银杏酚C17 1与顺铂联用对A549/DDP耐药细胞凋亡的影响
多药耐药的产生机制繁杂,其中Mrp1和肺耐药蛋白(Lrp)表达改变是耐药的重要机制之一[16]。Nrf2/Keap1信号通路参与非小细胞肺癌Mrp1的表达调控,当Keap1表达下降或被其他蛋白如P62竞争结合后,致Nrf2入核与ARE元件上的Mrp1基因启动子结合,促进耐药蛋白Mrp1的表达[6]。Keap1为Nrf2的负调控蛋白,在一些肿瘤如肺癌细胞中,Keap1的突变致Nrf2活性增强,并与标准化疗耐药及肺癌患者高死亡率相关[17]。本研究显示,与对照组相比,单独顺铂组肺癌耐药细胞株中总Nrf2没有呈高表达,但核Nrf2高表达,说明细胞内Nrf2的分布发生了变化。胞质Nrf2入核后,促进下游耐药蛋白Mrp1的高表达,进而抑制药物进入细胞发挥细胞毒性作用;Keap1作为Nrf2抑制剂,其低表达不仅减少Nrf2的降解,同时增强Nrf2入核进而激活Nrf2。但银杏酚C17 1与顺铂联合作用后,与顺铂组相比,细胞内Keap1高表达抑制Nrf2入核,进而核内Nrf2减少,抑制下游耐药蛋白Mrp1的表达,减弱其发挥药物外排的作用。由此表明,银杏酚C17 1可能通过抑制Nrf2/Keap1信号通路逆转肿瘤细胞对顺铂的耐药性。
凋亡是耐药性细胞死亡的重要机制之一,与肿瘤细胞凋亡相关的调控基因有Bcl2、Caspase和P53等家族。Bcl2家族成员Bcl2、Bax、单BH3结构域蛋白等组成一个蛋白质—蛋白质相互作用的网络,通过线粒体外膜的渗透来调节细胞凋亡[18]。Bcl2是抗凋亡基因,而Bax是促凋亡基因,Bcl2/Bax比值是细胞凋亡发生的关键,比值升高抑制肿瘤细胞凋亡,反之降低则促进肿瘤细胞凋亡[19]。本研究结果表明,银杏酚C17 1与顺铂联用可促进肺癌耐药细胞的凋亡,流式细胞术结果进一步证实银杏酚C17 1增强肺癌耐药细胞对顺铂的敏感性,并使凋亡增加。
总之,本研究结果表明顺铂与银杏酚C17 1体外同时作用能对A549/DDP耐药细胞的增殖、迁移、侵袭、耐药蛋白及抗凋亡蛋白产生明显的抑制效果,辅助增敏作用显著。
[参考文献]
[1]Zhang Y,Wang X,Han L,et al.Green tea polyphenol EGCG reverse cisplatin resistance of A549/DDP cell line through candidate genes demethylation[J].Biomed Pharmacother,2015,69:285-290.
[2]Wu T,Wang MC,Jing L,et al.Autophagy facilitates lung adenocarcinoma resistance to cisplatin treatment by activation of AMPK/mTOR signaling pathway[J].Drug Des Devel Ther,2015,9:6421-6431.
[3]赵瑛.中药抗肿瘤药理作用研究进展[J].现代中西医结合杂志,2012,21(33):3752-3753.
[4]Suzuki T,Motohashi H,Yamamoto M.Toward clinical application of the Keap1-Nrf2 pathway[J].Trends Pharmacol Sci,2013,34(6):340-346.
[5]Xia C,Bai X,Hou X,etal.Cryptotanshinone reverses cisplatin resistance of human lung carcinoma A549 cells through down-regulating Nrf2 pathway[J].Cell Physiol Biochem,2015,37(2):816-824.
[6]Ji L,LiH,Gao P,etal.Nrf2 pathway regulatesmultidrug-resistance-associated protein 1 in small cell lung cancer[J].PLoSOne,2013,8(5):e63404.
[7]Taguchi K,Yamamoto M.The KEAP1-NRF2 system in cancer[J].Front Oncol,2017,7:85.
[8]Hayes JD,McMahon M.NRF2 and KEAP1 mutations:permanent activation of an adaptive response in cancer[J].Trends Biochem Sci,2009,34(4):176-188.
[9]Kennedy DO,Wightman EL.Herbal extracts and phytochemicals:plant secondarymetabolites and the enhancement of human brain function[J].Adv Nutr,2011,2(1):32-50.
[10]王云飞,杨小明,李月英,等.银杏酚对 SMMC-7721肝癌细胞和荷H22肝癌小鼠的抗癌作用[J].江苏大学学报(医学版),2013,23(3):233-237.
[11]Li Y,Liu J,Liu Y,et al.Inhibitory effect of Ginkgol C17 1 on the biological behavior of tumor cells[J].Oncol Lett,2017,13(3):1873-1879.
[12]Liu J,Li Y,Yang X,et al.Effects of ginkgol C17 1 on cisplatin induced autophagy and apoptosis in HepG2 cells[J].Oncol Lett,2018,15(1):1021-1029.
[13]Troncome M,Cargnelli SM,Villani LA,et al.Targetingmetabolism and AMP-activated kinasewithmetformin to sensitize non-small cell lung cancer(NSCLC)to cytotoxic therapy:translational biology and rationale for current clinical trials[J].Oncotarget,2017,8(34):57733-57754.
[14]Mei N,Guo X,Ren Z,et al.Review of Ginkgo bilobainduced toxicity,from experimental studies to human case reports[J].J Environ Sci Health C Environ Carcinog Ecotoxicol Rev,2017,35(1):1-28.
[15]Ramer R,Bublitz K,Freimuth N,et al.Cannabidiol inhibits lung cancer cell invasion and metastasis via intercellular adhesion molecule-1[J].FASEB J,2012,26(4):1535-1548.
[16]Swerts K,De Moerloose B,Dhooge C,etal.Prognostic significance of multidrug resistance-related proteins in childhood acute lymphoblastic leukaemia[J].Eur J Cancer,2006,42(3):295-309.
[17]Yamadori T,IshiiY,Homma S,etal.Molecularmechanisms for the regulation of Nrf2-mediated cell proliferation in non-small-cell lung cancers[J].Oncogene,2012,31(45):4768-4777.
[18]Renault TT,Dejean LM,Manon S.A brewing understanding of the regulation of Bax function by Bcl-xL and Bcl-2[J].Mech Ageing Dev,2017,161(Pt B):201-210.
[19]Paul I,Jones JM.Apoptosis block as a barrier to effective therapy in non small cell lung cancer[J].World J Clin Oncol,2014,5(4):588-594.
