GST pull-down方法寻找组蛋白去乙酰化酶的互作蛋白研究
2018-04-02宫艳超张荟赵伟伟
宫艳超,张荟,赵伟伟
(天津渤海职业技术学院生物与环境工程系,天津300402)
蛋白质的翻译后修饰与基因转录有着密切的关系,其中,蛋白质的乙酰化与去乙酰化修饰是由组蛋白去乙酰化酶(HDACs)和组蛋白乙酰化酶(HAT)协同调控的。它们通过调节赖氨酸残基末端的电荷状态,改变蛋白质的结构与功能[1]。
目前,组蛋白去乙酰化酶根据其与酵母同源物被分为四种类型[2,3]。I型HDACs成员包括HDAC 1,HDAC 2,HDAC 3,HDAC 8,与酵母 Rpd3 同源,长度是350~500个氨基酸,主要位于细胞核中;II型HDACs成员包括:IIa类,HDAC 4,HDAC 5,HDAC 7和 HDAC 9;IIb 类,HDAC 6 和 HDAC 10,与酵母Hda1同源;IV型成员主要包括HDAC11,主要是酶活中心与I型、II型不同,也是Zn2+依赖型的水解酶[4]。HDAC与多种人类重大疑难疾病密切相关,包括癌症、心脏疾病、神经退行性疾病和自身免疫性疾病等[5]。
本研究选择I类HDAC成员HDAC8作为研究对象,采用GST pull-down的方法寻找组蛋白去乙酰化酶的互作蛋白[6]。
1 实验部分
1.1 实验材料
实验中所用的HDAC8质粒pGEX-6p-1-hHDAC8由实验室保存,用于质粒扩增的菌株E.coli trans 5α(DH 5α)感受态细胞和用于表达蛋白的菌株BL21(DE3)感受态细胞购买于全式金生物技术有限公司,所用细胞株Hela细胞由实验室冻存。
1.2 仪器与试剂
Millipore型纯水仪(苏州赛恩斯仪器有限公司)、BS124S天平(德国 Sartorius)、YC-2层析实验冷柜(北京博医康实验仪器有限公司)、AKTA蛋白纯化仪(通用医疗生命科学上海有限公司)、Hitrap Q离子交换柱(通用医疗生命科学上海有限公司)、Superdex 200分子筛柱(通用医疗生命科学上海有限公司)、还原型谷胱甘肽(上海生工生物工程有限公司)、氯化钠(上海生工生物工程有限公司)、胰蛋白胨(上海生工生物工程有限公司)、酵母粉(上海生工生物工程有限公司)
1.3 实验方法
1.3.1 pGEX-6p-1-hHDAC8的表达纯化
取20μL HDAC8蛋白甘油菌于5 mL含氨苄(100 mg/L LB)液体培养基中,37℃220 rpm振荡培养12 h。次日将过夜培养菌加入1 L LB液体培养基(含氨苄 100 mg/L)中,于 37℃振荡培养,4~6 h后加入0.4 mM IPTG诱导表达,继续16℃培养18 h后收取菌体。取6 L收集好的溶解在平衡液中的菌体,待其解冻,在冰浴中超声破碎40%功率,超4 s,停6 s,30 min,每隔10 min将菌液搅拌均匀,最后将超声好的菌液放到高速离心管里,18000 rpm 4℃离心40 min,保留上清,弃去沉淀。
使用GST-HDAC8平衡缓冲液平衡GST柱三次,每次一到两个柱体积,放于4℃。将高速所得的菌液上清流经GST柱三遍,用高低盐洗杂缓冲液进行交替洗杂,取20 μL的洗杂液和80 μL的G250混合,直至G250不变蓝,洗杂结束,然后用2×GSH洗脱目的蛋白。取20 μL的洗脱液和80 μL的G250混合,直至G250不变蓝,洗脱结束,用10 KD的浓缩管将GST-HDAC8蛋白浓缩到小体积,备用。
离子交换层析(Hitrap Q柱),按系统操作执行进行洗泵,结束后将泵头A、B分别放入到抽滤过的His-HDAC8离子交换低盐缓冲液和GST-HDAC8离子交换高盐缓冲液中。设置流速,接离子柱,高低盐各处理离子柱三次,最后用缓冲液平衡离子柱。上样,待样品进入系统内后,将模式由Inject改为Load。用0%~50%质量分数的GST-HDAC8离子交换高盐缓冲液进行梯度洗脱,1 mL/tube进行适当收集。SDS-PAGE跑胶鉴定。
凝胶过滤层析(Superdex 200),按系统操作执行进行洗泵,结束后将泵头A、B放入到抽滤过的GST-HDAC8分子筛缓冲液中。设置流速,接柱,用GST-HDAC8分子筛缓冲液平衡Superdex 200。上样,收集0.5 mL/tube。SDS-PAGE跑胶鉴定。
1.3.2 GST pull-down的方法寻找互作蛋白
Hela细胞的收集与裂解,刮下细胞,离心,冰PBS清洗三次,置于冰上。用RIPA裂解液,取适量加入细胞中冰上裂解30 min,离心,取上清备用。GST-HDAC8和GST标签蛋白的固化,介质混匀。取200 μL介质悬液分别于至1.5 mL EP管中,标为A、B管,4000 rmp离心5 min,小心弃掉上清。洗杂。重复以上步骤3次。根据蛋白定量将等量的GST-HDAC8蛋白和GST标签蛋白移入预冷的装有谷胱甘肽介质的A、B管中,4℃,旋转结合3h。取出EP管,小心弃掉上清。往EP管中加入1 mL PBS,轻轻颠倒混匀,4℃,4000 rmp离心 5 min,小心弃掉上清。按1:500的比例加入Hela细胞的总蛋白裂解液,轻轻颠倒混匀,4℃,结合12 h。次日,用2×GSH将融合蛋白洗脱,各步骤取样跑胶,质谱鉴定。
2 结果与讨论
2.1 pGEX-6p-1-hHDAC8的表达纯化
本实验将pGEX-6p-1-hHDAC8蛋白,经超声破碎前后,分别取全菌、上清、沉淀、穿透、洗杂、洗杂后的柱料、洗脱、洗脱后的柱料的样,洗脱步骤可以完全洗脱下目的蛋白,几乎无目的蛋白残留于柱料上,pGEX-6p-1-hHDAC8蛋白的亲和层析各步骤的结果如图1。
结果如下:由于HDAC8蛋白与GST融合蛋白相对分子质量是67 KD左右,所以由亲和层析图可以看出,HDAC8融合蛋白出现在洗脱样品中,可以进行下一步的实验。我们将洗脱液经过换buffer之后浓缩到1.5 mL,采用阴离子交换柱Hitrap Q进行纯化,平衡离子柱用低盐缓冲液,蛋白洗脱将盐浓度由0 mM拉至500 mM NaCl,初期的上样过程蛋白有穿透峰,当电导为24 mS/cm左右时,即开始出现目的蛋白峰,如图2,SDS-PAGE结果显示34管-46管均为目的蛋白,取37-46管进行下一步纯化,如图3。
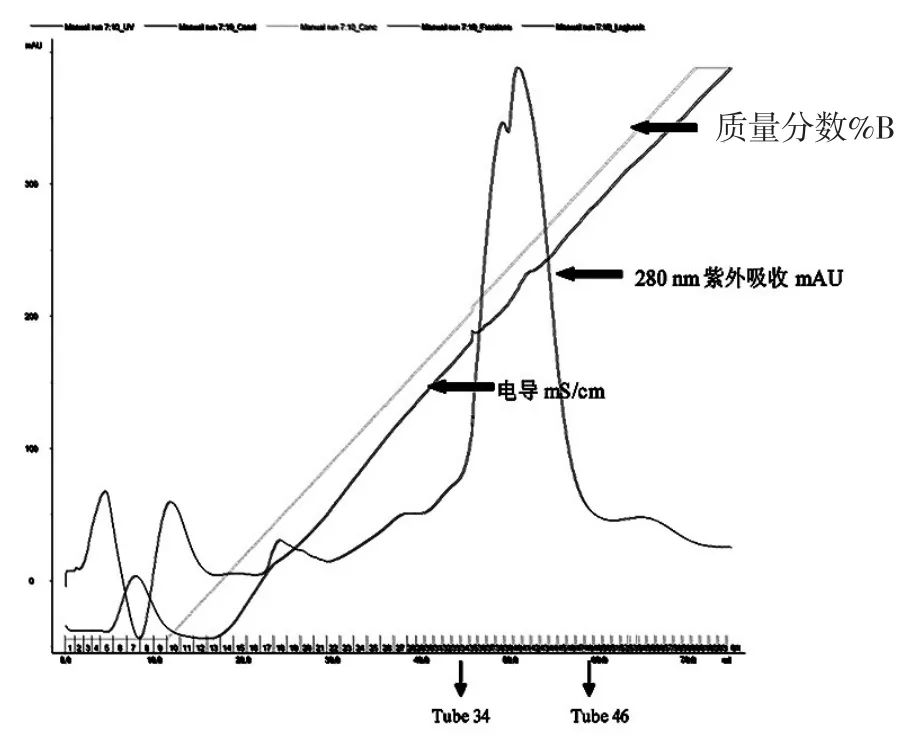
图2pGEX-6p-1-hHDAC8 Hitrap Q阴离子交换峰形图

图3pGEX-6p-1-hHDAC8 Hitrap Q阴离子交换SDS-PAGE结果
取第37~46管用10 KD浓缩管进行浓缩,浓缩到500 μL左右的时候,使用Superdex 200进行进一步的纯化,平衡Superdex 200,保持离子浓度在150 mM NaCl,上样,洗脱,从10 mL到13 mL出现了杂峰,14 mL左右开始出现目的蛋白峰,峰形单一对称,按照峰宽收集蛋白跑胶,如图4,SDS-PAGE结果显示 14~26 管均为目的蛋白 HDAC8(67 KDa),取第18~26管进行浓缩,-80℃备用。
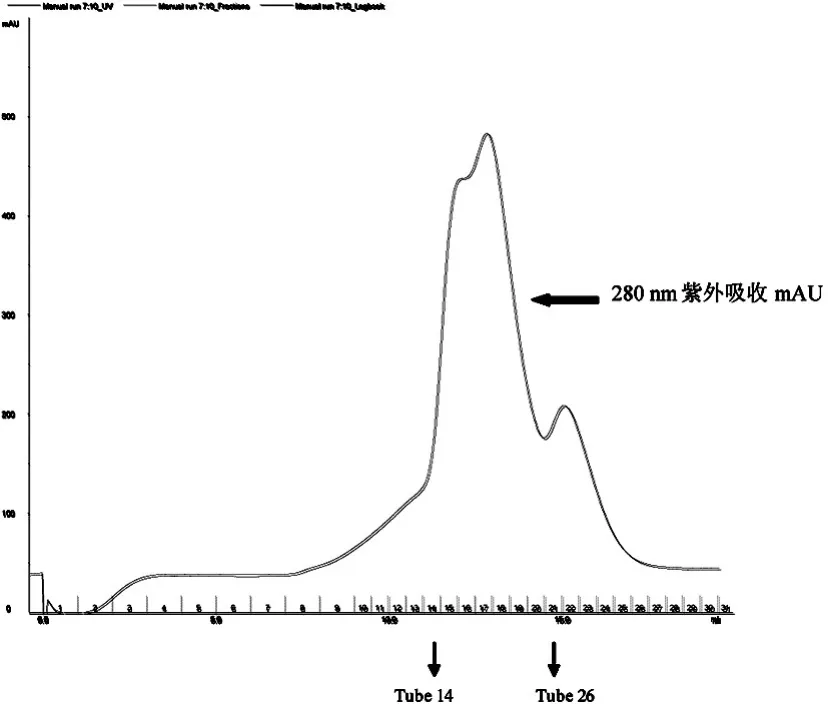
图4 pGEX-6p-1-hHDAC8 Superdex 200分子筛峰形图
2.2 GST标签蛋白的纯化
本实验将GST标签蛋白,经超声破碎前后,分别取全菌、上清、沉淀、穿透、洗杂、洗杂后的柱料、洗脱、洗脱后的柱料的样,洗脱步骤可以完全洗脱下目的蛋白,几乎无目的蛋白残留于柱料上,GST标签蛋白的亲和层析各步骤的结果如图6。白,取2-32管进行下一步纯化备用,如图8。

图5pGEX-6p-1-hHDAC8 Superdex 200分子筛SDS-PAGE结果

图6GST标签蛋白亲和层析SDS-PAGE结果

图7 GST标签蛋白hitrap Q阴离子交换峰形图
结果如下:由于GST蛋白的相对分子质量25 KD左右,所以由亲和层析图可以看出,GST蛋白出现在洗脱样品中,可以进行下一步的离子交换实验如图7。SDS-PAGE结果显示2-32管均为目的蛋
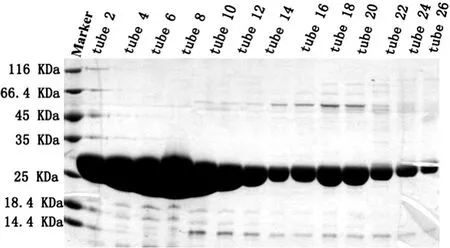
图8 GST标签蛋白hitrap Q阴离子交换SDS-PAGE结果
2.3 GST pull-down的方法寻找互作蛋白
本实验将GST pull-down各个步骤取样,SDSPAGE跑胶,结果如图9。

图9GST pull-down寻找HDAC8互作蛋白
将样品GST-HDAC8+全细胞的样进行质谱送样,结果如图10。

图10GST pull-down寻找HDAC8互作蛋白质谱结果图
我们除了发现文献中报道的蛋白,还发现了多个未见报道的蛋白,如糖代谢过程中发挥重要作用的烯醇酶ENO1,第一次验证了ENO1可能作为HDAC8复合物发挥作用过程中的其中之一蛋白。
3 结论
我们开展了GST pull-down实验,GST pulldown实验结果,除了发现文献中报道的蛋白,还发现了多个未见报道的蛋白,如糖代谢过程中发挥重要作用的烯醇酶ENO1,第一次验证了ENO1可能作为HDAC8复合物发挥作用过程中的其中之一蛋白。与其他寻找HDAC8互作蛋白的方法相比较,作为参照与互补,GST pull-down实验存在的缺点,主要是因为GST标签蛋白占据了HDAC8蛋白的表位,影响了酶的拓扑结构,造成假阴性和假阳性的结果,我们将在今后提出方法模拟酶过渡态设计的底物抑制剂分子,一方面,抑制剂分子占据了酶活中心,没有占据其它位点,不影响酶的拓扑结构;另一方面,该抑制剂分子和HDAC8的结合模拟了底物与酶结合的过程,使“抓取”到的互作蛋白结果更加可靠,本实验的目的是通过pull-down发现一些未被发现的互作蛋白,同时,可以将此方法平移到其它HDAC亚型。
ENO1是发现的未知互作蛋白,我们后期再通过“凸凹互补”的亲和柱实验继续验证此类蛋白,是否与HDAC8存在互作关系。
参考文献:
[1]Berger S L.The complex language of chromatin regulation during transcription[J].Nature,2007,447(7143):407-412.
[2]De Ruijter A J,Van Gennip A H,Caron H N,et al.Histone deacet⁃ylases(HDACs):characterization of the classical HDAC family[J].Biochemical Journal,2003,370(3):737-749.
[3]Gregoretti I,Lee Y-M,Goodson H V.Molecular evolution of the histone deacetylase family:functional implications of phylogenetic analysis[J].Journal of molecular biology,2004,338(1):17-31.
[4]Fischle W,Kiermer V,Dequiedt F,et al.The emerging role of class II histone deacetylases[J].Biochemistry and Cell Biology,2001,79(3):337-348.
[5]柴政斌,张更林,韩金祥.GST pull-down技术在研究蛋白质相互作用中的应用[J].中国生物制品学杂志,2013.
[6]王学政,张更林,崔亚洲,等.牙本质基质蛋白1功能片段的融合表达及细胞定位[J].中国生物制品学杂志,2013;26(4):491-494.
