2型糖尿病大鼠心功能变化及RAGE表达增强和钙调控异常*
2018-04-02练飞鸿邝素娟陈肖燕吴飞龙张梦珍麦丽萍林秋雄单志新邓春玉1
练飞鸿,饶 芳,邝素娟,陈肖燕,杨 慧,吴飞龙,张梦珍,麦丽萍,林秋雄,单志新,杨 敏,邓春玉1,△
(1华南理工大学医学院,广东 广州 510006; 2广东省心血管病研究所,广东省人民医院医学研究部,广东省医学科学院,广东 广州 510080)
糖尿病的发病率在全世界范围内呈逐年上升的状态。我国糖尿病的发病人数高达9 240万人,另有约1亿4 820万的成年人处于糖尿病前期状态[1]。糖尿病患者的长期高血糖状态使得身体各组织和器官都受到严重影响,糖尿病是冠心病、房颤和心力衰竭等心血管疾病的主要危险因素[2],使患者死亡率明显增高。
糖尿病心肌病(diabetic cardiomyopathy,DCM)是糖尿病患者的一种独特的心肌病,表现为与高血压、冠心病、瓣膜病和先天性心脏病无关的心室功能不全。其突出的病理变为心肌细胞肥大、间质纤维化及收缩和舒张功能不全。目前关于糖尿病是如何导致心肌细胞肥大,进而进展为糖尿病心肌病的机制研究,包括晚期糖基化终末期产物(advanced glycation end products,AGEs)增加,血管周围和肌纤维间的纤维化、炎症反应增强、自噬和细胞凋亡的增加、肾素-血管紧张素-醛固酮系统的激活、脂质的堆积、钙调控紊乱、线粒体功能异常、胰岛素抵抗和氧化应激的增强等等[3-4]。在一系列研究中都能反复观察到糖尿病可以影响啮齿类动物模型心脏的电复苏,具体表现为心肌细胞的动作电位延长和QT间期延长等电生理改变[5-6]。这普遍被认为是心肌细胞内钙调控异常和兴奋收缩偶联异常所致。因此,进一步明确心肌细胞对高血糖状态的复杂的电生理适应机制,对了解糖尿病是如何导致心肌细胞肥大的有着重要意义。
本研究将以自发性2型糖尿病大鼠作为2型糖尿病模型,探讨糖尿病引起的钙调控紊乱对心肌细胞肥大的影响。
材 料 和 方 法
1 实验动物与饲养环境
SPF级,7周龄雄性Zucker糖尿病肥胖(Zucker diabetic fatty,ZDF;fa/fa)大鼠和Zucker lean (ZL;fa/+)大鼠各15只购自北京维通利华实验动物技术有限公司,生产许可证号为SCXK(高)2012-0001,饲养于中山大学北校区动物中心,恒温(22±2) ℃,恒湿(55±5)%,人工光照明暗各12 h/d,噪声<50 dB,24 h自由取食和饮水。本研究所有动物实验已通过广东省人民医院(广东省医学科学院)的动物实验伦理审查(No.GDREC201208A)。
2 试剂与仪器
抗β-肌球蛋白重链(β-myosin heavy chain,β-MHC)、心房钠尿肽(atrial natriuretic peptide,ANP)、晚期糖基化终产物受体(receptor for advanced glycation end products,RAGE)和GAPDH抗体(Cell Signaling Technology);抗CaV1.2抗体(Alomone Labs);辣根过氧化物酶标记的山羊抗兔IgG(Invitrogen);封闭牛奶和loading buffer(Bio-Rad);PVDF膜(Millipore);麦胚凝集素(wheat germ agglutinin,WGA)琼脂糖(Vector Laboratories); Advatage血糖仪和血糖试纸(Roche)。Vevo 2100彩色多普勒小动物超声诊断仪(Visual Sonic)。
3 主要方法
3.12型糖尿病动物模型的建立按不同的基因型分为2组,ZDF组大鼠共15只予以Purina 5008饲料(蛋白质23.75%、总脂肪7.55%、粗纤维4.00%和消化能14.6 kJ/kg)喂养作为模型组;ZL大鼠予以普通饲料喂养作为对照组。大鼠饲养1周后,使用罗氏血糖检测试纸和血糖仪,通过尾静脉采血法定期对2组大鼠进行血糖的测量,利用电子天平测量大鼠的体重值。之后分别在9、10、12、14、16、18和22周龄对2组大鼠的血糖和体重进行测量。
3.2大鼠心功能的测定在ZDF大鼠18周龄时进行超声心动图检测。大鼠取左侧卧位,使用异氟烷麻醉同时持续低流量给氧,使其保持轻度镇静状态(异氟烷浓度为3.0%,氧流量为1 L/min)。选用21 MHz高频探头,换取胸骨旁短轴左心室乳头肌水平切面图像,记录3个完整心动周期的二维图像。每只大鼠各取3个心动周期的平均数值为其所得的检测值。检测指标包括左室前壁舒张末期厚度(left ventricular end-diastolic anterior wall thickness,LVAWd)、左室前壁收缩末期厚度(left ventricular end-systolic anterior wall thickness,LVAWs)、左室后壁舒张末期厚度(left ventricular end-diastolic posterior wall thickness,LVPWd)、左室后壁收缩末期厚度(left ventricular end-systolic posterior wall thickness,LVPWs)、左室收缩末期内径(left ventricular end-systolic internal dimension,LVIDs)、左室舒张末期内径(left ventricular end-diastolic internal dimension,LVIDd)、左室射血分数(left ventricular ejection fraction,LVEF)、左室短轴缩短率(left ventricular fractional shortening,LVFS)、左室舒张期容积(left ventricular diastolic volume,LVd)和左室收缩期容积(left ventricular systolic volume,LVs)。
3.3心脏组织WGA染色和细胞表面积计算采用颈椎脱臼法处死大鼠,后取心室组织用PBS冲洗,4%甲醛固定24 h,脱水石蜡包埋切片。常规脱蜡水合,室温下用PBS孵育水化后滴加胰酶工作液50 μL,37 ℃湿盒孵育15 min,PBS漂洗终止消化,滴加WGA-AF488工作液(1∶100稀释),避光孵育2 h,PBS漂洗和封固剂封片,光学显微镜下拍照。应用Image-Pro Plus 6.0软件以400倍标尺为标准,选取合适的视野,测量出视野内组织的面积及总细胞核的总数,得出单个细胞面积(mm2)=组织面积(mm2)/细胞核总数。
3.4Western blot 检测相关蛋白的表达量的变化用研磨棒对心肌组织研磨、离心、去沉淀后,使用含有蛋白酶抑制剂的蛋白裂解液提取心肌细胞的总蛋白,利用BCA法测定蛋白浓度。将各样品配至终浓度为1 g/L,加入4×SDS上样缓冲液,沸水水浴10 min,使蛋白质变性。SDS-PAGE分离、转膜。5%脱脂奶粉常温缓慢摇荡1 h封闭。将NC膜放入杂交袋中,加入足量稀释的 I 抗,置于4 ℃摇床孵育过夜;TBST洗膜,常温下3次,每次10 min。根据 I 抗来源选择合适 II 抗(辣根过氧化物酶标记的抗小鼠和抗兔的 II 抗),以1∶1 000比例稀释于5% 脱脂奶粉中,常温轻摇1 h;TBST洗膜,常温下3次,每次10 min。用ECL试剂盒显影蛋白条带,ImageJ图像分析软件定量分析目的蛋白及内参照β-actin的灰度值,算出比值进行统计分析。
4 统计学处理
用SPSS 19.0 统计软件进行分析,计量资料以均数±标准差(mean±SD)方式表示,采用t检验进行2组间比较,以P<0.05表示差异有统计学意义。
结 果
1 2型糖尿病大鼠模型建立
将7周龄ZL和ZDF大鼠适应性喂养7 d后,ZDF大鼠改为Purina 5008饲料喂养。在10周龄后,ZDF组大鼠血糖和体重均显著高于ZL组(P<0.01)。
2 超声心动图检测ZDF大鼠心功能的变化
M型超声心动图检测结果发现,2组大鼠的心脏结构和心功能均存在显著差异,见图1。与ZL大鼠相比,ZDF大鼠的LVAWd、LVAWs、LVPWd和LVPWs显著增加(P<0.05或P<0.01),而LVIDs和LVIDd与对照组相比明显缩小(P<0.05),提示左心室肥厚。在心功能方面,ZDF大鼠的LVEF和LVFS显著升高(P<0.05),提示ZDF组大鼠出现心功能代偿性增强现象,见表1。
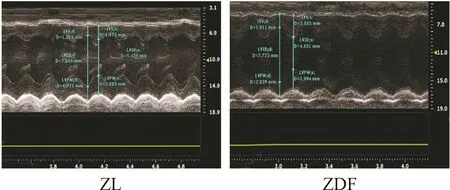
Figure 1.The images of M-mode echocardiography for the 18-week-old ZDF and ZL rats.
图118周龄ZDF大鼠与ZL大鼠的M型超声心动图谱
表118周龄ZDF大鼠心脏功能的变化
Table 1.Echocardiographic parameters obtained from the 18-week-old ZDF and ZL rats (Mean±SD.n=15)

IndexZLZDFLVAWd(mm)1.54±0.172.11±0.26∗LVAWs(mm)2.22±0.203.14±0.28∗LVIDd(mm)8.09±0.887.13±0.49∗LVIDs(mm)5.65±0.774.44±0.50∗LVd(μL)334.27±52.43268.10±41.66∗LVs(μL)157.25±33.4091.20±24.87∗LVEF(%)55.73±5.4766.34±5.09∗LVFS(%)32.26±3.5138.76±2.37∗LVPWd(mm)1.74±0.322.15±0.32∗∗LVPWs(mm)2.42±0.313.02±0.29∗
*P<0.05,**P<0.01vsZL group.
3 ZDF大鼠左心室心肌细胞表面积明显增加
WGA染色结果显示,ZDF大鼠与ZL大鼠相比,心肌细胞表面积明显增加(P<0.05),提示出现心肌细胞肥厚,见图2。
4 ZDF大鼠心肌细胞肥大相关蛋白β-MHC和ANP表达的变化
利用Western blot检测心肌细胞肥大相关标志蛋白β-MHC和ANP。结果显示,与对照组ZL大鼠相比,ZDF大鼠心脏组织中的β-MHC和ANP的蛋白表达显著升高(P<0.05),见图3。
5 ZDF大鼠RAGE以及钙调控相关蛋白CaV1.2和Orai1表达的变化
ZDF组大鼠的RAGE表达与对照组相比明显升高(P<0.05),见图4。在有关维持钙稳态的钙离子通道表达上,与对照组大鼠相比,ZDF 组的CaV1.2表达下降,Orai1表达升高(P<0.05),见图5。

Figure 2.Immunofluorescence staining (WGA staining) showed the size of cardiomyocytes in the left ventricle of 18-week-old ZL and ZDF rats (×400).Mean±SD.n=6.*P<0.05vsZL group.
图2WGA染色显示ZDF大鼠左心室肌细胞表面积增大
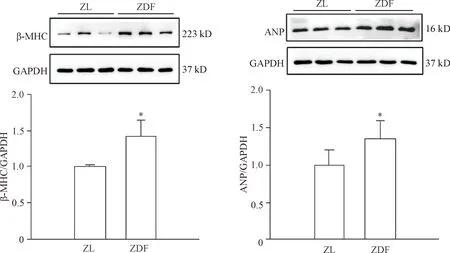
Figure 3.The protein expression of β-MHC and ANP in the ZDF rats.Mean±SD.n=6.*P<0.05vsZL group.
图3ZDF大鼠β-MHC和ANP蛋白的表达量增加

Figure 4.The protein expression of RAGE in the ZDF rats.Mean±SD.n=6.*P<0.05vsZL group.
图4ZDF大鼠RAGE蛋白的表达增加
讨 论
1 2型糖尿病模型的建立及心功能的变化
良好的糖尿病动物模型能够更好地模拟疾病在人体的发生发展过程。ZDF大鼠是由遗传性肥胖基因突变导致胰岛素抵抗、进一步引起葡萄糖耐量受损的2型糖尿病模型,其特征为肥胖、高血糖、高脂血症、高胰岛素血症和胰岛素抵抗等[7-8],与人类2型糖尿病发病情况非常相似。此外,在ZDF大鼠中与疾病相关的预测蛋白酶活性与人类心血管疾病的预测活动有较高的相似性[9]。所以ZDF大鼠是目前用于研究2型糖尿病及相关心血管疾病并发症的理想模型。我们在实验中观察到ZDF大鼠在经过Purina 5008饲料饲养后,在10周龄出现了随机血糖显著升高,提示ZDF组大鼠出现了2型糖尿病。此外,在18周龄时超声心动图显示ZDF组大鼠的左室前壁和后壁均出现明显肥厚,心室腔缩小,其FS与EF值代偿性增高。WGA染色显示模型组大鼠的心室肌细胞普遍肥大,且心肌组织中的ANP和β-MHC蛋白表达明显上调。上述结果显示,在长期持续的高血糖状态刺激下,ZDF鼠出现心脏结构重构和舒张功能障碍,这种情况与临床上的射血分数保留的糖尿病病人的心功能改变相似。
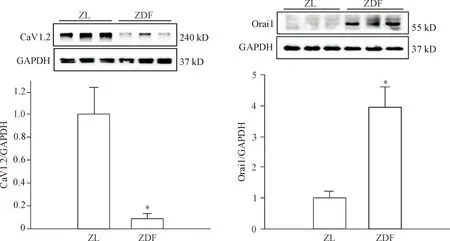
Figure 5.The protein expression of CaV1.2 and Orai1 in the ZDF rats.Mean±SD.n=6.*P<0.05vsZL group.
图5ZDF大鼠CaV1.2和Orai1蛋白表达的变化
2 AGEs参与了2型糖尿病导致细胞肥大的过程
晚期糖基化终末产物是过量的糖和蛋白质结合的产物,糖尿病状态下过量的糖和蛋白质在体内合成AGEs,AGEs可与人体各种组织蛋白相结合并破坏这些组织蛋白,使组织胶原降解的能力受损,从而增加纤维化,最终导致心肌僵硬度增加和心脏舒张功能受损[10]。AGEs也通过与RAGE结合发挥其活性。糖尿病患者心脏组织中,AGEs和RAGE增加,可激活核因子κB信号通路,使β-MHC表达增加[11],进而引起心肌细胞肥厚。我们的实验中也证实,ZDF组大鼠的RAGE表达较对照组相比显著增加,同时其肥大相关标志物β-MHC和ANP亦显著增加,且ZDF大鼠的心室明显肥厚,并出现舒张功能不全和心功能代偿性增强。因此,糖尿病状态下AGEs/RAGE轴增强可能参与了心肌细胞肥大,进而导致DCM。
3 糖尿病导致心肌细胞内Ca2+调控紊乱可能是心肌肥厚的重要因素
心肌细胞的钙调控过程是细胞的兴奋收缩偶联过程中细胞内钙离子的波动。当心肌细胞兴奋时,心肌L-型钙通道介导Ca2+内流,激活肌质网内Ca2+的释放,引起心肌细胞收缩;细胞舒张时,是由细胞膜钙泵和钠钙转运体、内质网膜上钙泵将胞质内钙离子排出,这是经典的钙调控过程。有研究发现,高血糖可使心肌细胞的动作电位延长,并随着时间的推移逐渐出现心功能不全。而高血糖对心肌细胞钙调控的干扰可能是导致心肌细胞动作电位延长的重要原因。另有研究显示持续高血糖可通过减少钙离子从L型钙通道的流入、影响肌质网钙离子的释放、减慢钙再摄取的速度、使钙外流增加,从而改变心肌细胞内钙稳态[12]。我们对2组大鼠心室组织的L型钙通道蛋白表达检测也发现,ZDF组大鼠的CaV1.2的蛋白表达是显著下降的。这与Meo等[13]在利用链脲霉素诱导的糖尿小鼠模型上检测到心肌细胞L型钙电流减少的结果相一致。除了传统的L型钙通道以外,目前普遍认为Oria1介导的钙库操纵性钙通道也参与了心肌细胞的钙调控。在糖尿病模型中,不管是心肌细胞还是平滑肌细胞的Orai1表达都是升高的[14-15]。我们的实验结果也显示,ZDF组大鼠心肌细胞的Orai1表达相对于对照组是明显升高的。Orai1的表达增高可介导SOCE通道的钙电流内流增加从而参与心肌细胞的钙调控,而这可能是由于高血糖通过激活钙调磷酸酶/NFATc3信号通路的结果[15]。在L型钙通道钙内流减少的情况下,细胞内钙依然存在着钙超载的表现,除了内质网钙泵作用的减弱以外,经Oria1介导的SOCE通道的钙离子内流增加可能起着重要的作用。这或许是细胞的一个代偿性机制,但其引起的钙超载或许进一步导致了细胞肥大相关转录因子的表达,从而促进心肌的肥厚的发生。
高血糖导致心功能改变和心肌细胞肥大的机制很复杂,钙调控紊乱和AGEs/RAGE轴的增强无疑起着重要作用,与其它影响因素之间相互又存在着关联作用,进一步导致了糖尿病心肌病的形成。而进一步的研究有助于阐明这些机制形成和发展,理清其上下游的关系是保护糖尿病心脏的一个不可或缺的环节。
[参考文献]
[1]Yang SH,Dou KF,Song WJ.Prevalence of diabetes among men and women in China[J].N Engl J Med,2010,362(25):2425-2426.
[2]Mozaffarian D,Benjamin EJ,Go AS,et al.Heart disease and stroke statistics-2016 update:a report from the American Heart Association[J].Circulation,2016,133(4):e38-e360.
[3]Bugger H,Abel ED.Molecular mechanisms of diabetic cardiomyopathy[J].Diabetologia,2014,57(4):660-671.
[4]胡波,张晓刚,曾琳琳.糖基化终产物诱导心肌细胞炎症反应的研究[J].中国病理生理杂志,2007,23(12):2341-2345.
[5]Gruden G,Giunti S,Barutta F,et al.QTc interval prolongation is independently associated with severe hypoglycemic attacks in type 1 diabetes from the EURODIAB IDDM complications study[J].Diabetes Care,2012,35(1):125-127.
[6]李健,刘彤,李广平.糖尿病心肌离子通道重构的研究进展[J].中国病理生理杂志,2012,28(4):751-754,759.
[7]Tikellis C,Wookey PJ,Candido R,et al.Improved islet morphology after blockade of the renin-angiotensin system in the ZDF rat[J].Diabetes,2004,53(4):989-997.
[8]Pamarthi MF,Rudd MA,Bukoski RD.Normal perivascular sensory dilator nerve function in arteries of Zucker diabetic fatty rats[J].Am J Hypertens,2002,15(4 Pt 1):310-315.
[9]Siwy J,Zoja C,Klein J,et al.Evaluation of the Zucker diabetic fatty (ZDF) rat as a model for human disease based on urinary peptidomic profiles[J].PLoS One,2012,7(12):e51334.
[10] Norton GR,Candy G,Woodiwiss AJ.Aminoguanidine prevents the decreased myocardial compliance produced by streptozotocin-induced diabetes mellitus in rats[J].Circulation,1996,93(10):1905-1912.
[11] Aragno M,Mastrocola R,Medana C,et al.Oxidative stress-dependent impairment of cardiac-specific transcription factors in experimental diabetes[J].Endocrinology,2006,147(12):5967-5974.
[12] Pereira L,Matthes J,Schuster I,et al.Mechanisms of [Ca2+]itransient decrease in cardiomyopathy ofdb/dbtype 2 diabetic mice[J].Diabetes,2006,55(3):608-615.
[13] Meo M,Meste O,Signore S,et al.Reduction in Kv current enhances the temporal dispersion of the action potential in diabetic myocytes:insights from a novel repolarization algorithm[J].J Am Heart Assoc,2016,5(2):e003078.
[14] Sung HH,Kam SC,Lee JH,et al.Molecular and functional characterization of ORAI and STIM in human corporeal smooth muscle cells and effects of the transfer of their dominant-negative mutant genes into diabetic rats[J].J Urol,2012,187(5):1903-1910.
[15] Daskoulidou N,Zeng B,Berglund LM,et al.High glucose enhances store-operated calcium entry by upregula-ting ORAI/STIM via calcineurin-NFAT signalling[J].J Mol Med (Berl),2015,93(5):511-521.
