间充质干细胞条件培养基在动脉粥样硬化治疗中的研究进展
2018-04-02陈雪晴周迎春
陈雪晴 周迎春
动脉粥样硬化(atherosclerosis,AS)是导致心脑血管疾病最重要的危险因素,但其发病机制尚不完全清楚。各种危险因素(如高脂血症、高血压病和糖尿病等)导致动脉内膜受损时[1],在活性氧、高血糖和脂多糖等活性因子的刺激下,血管壁产生炎症反应,导致内皮细胞、单核细胞、巨噬细胞和淋巴细胞等表面特性发生改变,释放大量炎性介质和氧化代谢产物,加速AS的发展。而血管钙化、斑块破裂、管腔内血栓形成和斑块内出血等则会导致严重的心血管事件[2]。
近年来,研究发现间充质干细胞(mesenchymal stem cells,MSCs)具有抑制炎症反应,修复组织损伤的潜能,而各类干细胞技术的发展则为加速干细胞制剂的临床应用提供了可能[3-4]。MSCs是人体内来源较丰富的一类成体干细胞,广泛存在于骨髓、脂肪、表皮和血液等组织,易于分离培养[5];此外,MSCs还具有低免疫原性的特点,同种异体移植不容易引起免疫排斥反应[6-7]。将MSCs应用于AS,移植的MSCs可通过趋化因子梯度迁移至损伤区域,分化为内皮细胞,修复损伤,抑制动脉狭窄的形成[8]。然而体外输注的MSCs寿命相对短暂,只有少数会分化形成新的细胞或组织[9],且分化机制尚不明确,分化过程难以控制;另一方面,血管内膜损伤后,骨髓MSCs会归巢到受损血管局部,分化为血管平滑肌细胞,参与再狭窄或动脉斑块钙化的形成,这些瓶颈促使研究者们把目光转向了MSCs的替代治疗。
研究发现,MSCs能够合成、分泌多种生长因子、细胞因子和趋化因子。在动物模型中,尽管体外输注的MSCs远离实际损伤部位,但仍可以促进伤口愈合[10],提示MSCs可通过旁分泌发挥抗炎、抗凋亡和促进新生血管形成的治疗作用[11]。Shabbir等[12]将MSCs注射至仓鼠腿肌腱内,采用示踪技术,虽然未在其它组织中发现移植细胞,但心肌梗死仓鼠的心室功能得到改善,多种生长因子表达增强,细胞凋亡和心肌纤维化程度减轻,出现心肌再生迹象。
由此,含有多种MSCs自体分泌因子的条件培养基(conditioned medium,CM)引起了人们极大兴趣。近年来,Timmers等[13]发现应用间充质干细胞条件培养基(mesenchymal stem cell conditioned medium,MSC-CM)可改善大鼠心肌梗死后的心脏功能。Chen等[14]报道了MSC- CM通过抑制炎症和保护窦内皮细胞来预防放射性肝损伤。Tamari等[15]发现MSC-CM能够加速伤口愈合。因此,应用MSC-CM既可避免直接输注MSCs引起的不良反应,又可发挥MSCs分泌因子的治疗作用。
随着对MSC-CM的深入研究,越来越多的研究者们把目光转向了MSC-CM对AS的治疗作用。本文综述了应用MSC-CM治疗AS的最新进展,希望为深入研究MSC- CM的应用前景提供参考。
一、MSC-CM
MSC-CM是指将MSCs的培养基上清液,直接用于培养其他细胞或作为其他细胞培养基的添加成分,利用MSCs分泌的各类细胞因子达到影响待培养细胞生长、分化和功能发挥的目的。采用去血清的MSC-CM直接输注于人体,是拟将MSC-CM用于临床的新途径。已有动物实验证实,从人胎盘组织中提取的MSCs,使用无血清培养基进行原代培养,待细胞生长密度达80﹪时收集的培养基上清液具有稳定的治疗效果[16]。
近年来,随着蛋白质组学技术的发展,MSC-CM的成分也逐渐被阐明[17],包括各种细胞因子、趋化因子、生长因子、蛋白酶以及微小核糖核酸(microRNA,miRNAs)。这些活性成分促进细胞增殖、促进血管再生和减轻炎症反应的作用为其临床应用提供了理论依据。一方面,输注含有自体分泌因子的条件培养基可降低移植干细胞带来的致瘤风险,避开异体移植带来的免疫相容等问题[18];另一方面,通过体外干预,控制MSCs分泌因子的成分和含量为将MSC-CM应用于个体化精准治疗开拓了新方向。
二、MSC-CM用于AS治疗的研究基础
MSCs是一群中胚层来源的具有自我更新及多向分化潜能的干细胞。在应用MSCs治疗AS过程中,一方面,移植的MSCs能够向血管损伤部位募集,分化为内皮细胞,修复损伤;另一方面,MSCs亦可分化为平滑肌细胞,参与血管增生、再狭窄或者斑块钙化。AS是一种病因复杂的血管壁慢性炎症性疾病,其发病机制尚未完全阐明,机体内环境、免疫功能强弱、移植细胞量和移植方式等都会影响MSCs治疗效果。
在AS模型小鼠中,Yoshimasa等[19]发现尾静脉输注脂肪来源的MSC-CM可以减少小鼠主动脉根部粥样斑块的面积,而将MSC-CM作用于内皮细胞,可以降低细胞黏附分子(cell adhesion molecule,CAM)的表达,抑制巨噬细胞募集,减轻单核细胞的黏附作用。Basmaeil等[20]则发现将胎盘来源的MSC-CM作用于内皮细胞可以修复过氧化损伤内皮细胞的增殖、分化、以及血管新生功能。而Alshabibi等[21]则发现蜕膜来源的MSC-CM可以增强内皮细胞谷胱甘肽和硫氧还蛋白还原酶的活性,减轻单核细胞对内皮细胞的损伤。Doherty等[22]发现在AS和糖尿病中,MSC-CM具有潜在的抗炎活性。而Frodermann等[23]则报道了输注MSCs可以降低血中甘油三酯和胆固醇水平,提出使用“泵疗法”持续输注MSC-CM降低血脂的构想,解决输注MSCs被拦截在肺、肝、肾的问题。国内研究人员采用P3代MSC-CM作用于氧化损伤的肺脏上皮细胞,上皮细胞的凋亡促进基因Bax蛋白表达减弱,凋亡抑制基因Bcl-2蛋白表达增强,提示MSC-CM可以通过抑制细胞凋亡机制,发挥保护内皮细胞免于AS进程中氧化损伤的作用[16]。
Chen等[24]发现骨髓MSC-CM中血管内皮生长因子(vascular endothelial growth factor,VEGF)、胰岛素样生长因子(insulin-like growth factor,IGF)、表皮生长因子(epidermal growth factor,EGF)、角质细胞生长因子(keratinocyte growth factor,KGF)、促血管生成素 1(angiopoietin,Ang-1)、基质细胞衍生因子(stromal cell-derived factor,SDF-1)、促红细胞生成素(erythropoietin,EPO)等表达水平提高,提示MSC- CM中存在多种有益血管生长的活性物质。Kim等[25]发现脂肪干细胞条件培养基含有多种生长因子,具有再生功能,可以保护细胞免受化学物质和辐射因素带来的氧化损伤。在AS的进程中,氧化应激是血管损伤、斑块形成的主要机制之一,而条件培养基中含有的营养物质可以减轻氧化损伤,保护血管。Takanori等[26]证实了牙髓来源的干细胞条件培养基可以促进内源性神经元祖细胞的迁移和分化,诱导血管再生,改善大脑中动脉闭塞后的缺血性脑损伤,提示在动脉狭窄,缺血缺氧引起的心脑损伤中,条件培养基不仅可以用于治疗AS,还可以促进心肌细胞和神经元细胞的迁移,改善预后。浙江大学中心实验室发现骨髓来源的MSC- CM可以通过阻断BMP2-Smad1/5/8信号通路抑制血管钙化[27],提示MSC-CM可以作为治疗AS晚期并发症的新靶点。
三、MSC-CM治疗AS的机制研究
AS病因复杂,发病机制尚不完全清楚。在AS起始阶段,脂类沉积于内膜,持续的免疫反应导致内皮细胞、单核细胞、巨噬细胞和淋巴细胞等表面特性发生改变,释放大量炎性介质和氧化代谢产物。内皮细胞表达细胞黏附分子和炎症介质,促使单核细胞黏附于内皮细胞,中膜平滑肌细胞迁入内膜,单核细胞通过清道夫受体吞噬氧化修饰的低密度脂蛋白,并合成大量细胞外基质和活性氧自由基(reactive oxygen species,ROS),形成 AS 斑块。
随着AS的发展,动脉内-中膜增厚,管腔中的弥散氧相对不足,引起血管壁缺血、缺氧,进而触发内皮细胞释放多种细胞因子,导致细胞增殖、迁移,重塑形成新生毛细血管。而动脉钙化是晚期AS的并发症,是引起心血管事件的重要原因。血管平滑肌细胞(vascular smooth muscle cells,VSMCs)向成骨细胞的分化在动脉钙化中起重要作用,产生的脂蛋白和磷脂复合物会加重血管损伤。衰老、慢性肾病、糖尿病、高血压和高血脂会加速钙化过程,减轻血管钙化可以从根本上减少心血管恶性事件的发生。AS是多细胞,多因素参与的,伴随着炎症反应和内皮细胞功能改变的血管损伤性疾病,应用MSC-CM治疗AS的机制可以从改善内皮细胞功能、抑制炎症反应和减轻血管钙化等方面来阐述。
(一)MSC-CM对内皮细胞的抗氧化与抗凋亡作用
研究发现,当移植的MSCs进入机体后,会通过分泌抗炎因子及抗氧化酶类物质,减轻炎症及氧化刺激,从而减轻组织损伤。因此认为MSC-CM同样可发挥抗氧化和组织修复能力[28-29]。研究也证实了MSC-CM具有一定的氧自由基清除能力,其抗氧化能力相当于100 μmol/L维生素C[16]。
MSC-CM不仅可通过提高内皮细胞谷胱甘肽和硫氧还蛋白还原酶的活性来发挥抗氧化功能[21],将MSC-CM作用于氧化损伤的肺上皮细胞,Nrf2-Keap1-ARE信号通路中Nrf2蛋白表达增强,Keap1分子表达减弱,提示MSCCM还可能通过激活Nrf2-Keap1-ARE信号通路发挥抗氧化作用[16]。
缺氧情况下得到的Akt-MSC条件培养基,可减少大鼠的心肌梗死面积,改善心室功能。其中表达上调的肝细胞生长因子(hepatocyte growth factor,HGF)VEGF、IGF-1等,可抑制低氧诱导的大鼠心肌细胞凋亡,并下调凋亡促进基因Bax的表达,上调凋亡抑制基因Bcl-2的表达,提示MSCCM可通过自体细胞因子发挥抗凋亡作用[30-31]。
持续高糖环境可增加血管内膜内皮细胞的通透性使其易于凋亡[32],而MSC-CM可通过下调内皮细胞中促细胞通透性的基因,如ALOX5[33]和NPPB[34]的表达,同时上调抗细胞通透性的基因,如NPR1[35]的表达来逆转高糖环境诱导的内皮细胞凋亡。Xagorari等[36]发现MSC-CM可以通过激活FGL1来预防急性肝损伤后的肝细胞凋亡,而Huang等[37]则称MSCs的旁分泌因子可以保护星形胶质细胞免于凋亡。
(二)MSC-CM调节内皮细胞功能基因的表达
糖尿病,高脂血症,氧化损伤等会导致内皮细胞活性下降、凋亡增多、迁移能力下降、增殖受损、血管新生能力下降和单核细胞浸润增强等,而这些因素又促进了AS进程。MSC-CM通过旁分泌作用调节内皮细胞功能基因的表达,从分子水平直接影响内皮细胞功能,调节内皮细胞血管新生能力,减少炎症细胞浸润,减缓AS进程。
迁移是早期动脉硬化内皮细胞损伤的重要标志,也是影响血管新生的初始阶段。MSC-CM作用于内皮细胞可下调增殖抑制基因CAV1[38]的表达,同时上调促增殖基因PLAT[39]和PDGFRA[40]的表达,提示MSC-CM可从分子水平提高内皮细胞的生存率。MSC-CM作用于内皮细胞后可 上 调 EDN1[41]、PF4[42]、ICAM1[43],SPHK1[44]等 基 因,而这些基因的表达产物可以促进内皮细胞迁移。血管新生通常伴随着细胞因子的趋化作用,将MSC-CM作用于内皮细胞,白介素 -6(interleukin,IL-6)[45]、IL-8[46-47]、IL-10[48]、IL-11[49]、PDGF-Rβ[50]等细胞因子的表达增加。在葡萄糖诱导内皮细胞损伤后加入MSC-CM,各种抗血管生成基因,包括AGT[50]和COL18A1[51]的表达下调;多种促血管生成基因,包括 F2R[52]、ICAM1[43,53]、PGF[54]、CCL2[55]的表达上调,为将MSC-CM应用于改善血管功能打下基础。
另一方面,MSC-CM 对细胞凋亡(FASLG[56]),损伤(ENG[57]、CX3CL1[58]、F3[59]、THBD[59]、AGTR1[60]), 炎 症(IL3[61]、ALOX5[62]、FLT1[63])也具有调控作用。研究发现,MSC-CM可以逆转葡萄糖诱导的内皮细胞损伤、凋亡并通过提高细胞生存率,促进细胞增殖、迁移和血管生成,降低葡萄糖对内皮细胞通透性和单核细胞浸润的刺激作用来修复葡萄糖诱导的内皮细胞功能损伤(图1)。流行病学调查显示,高血脂诱发的AS人群中多数伴随糖尿病,而MSC-CM对葡萄糖损伤的逆转作用为将MSC-CM应用于AS的治疗开辟了广阔的前景。
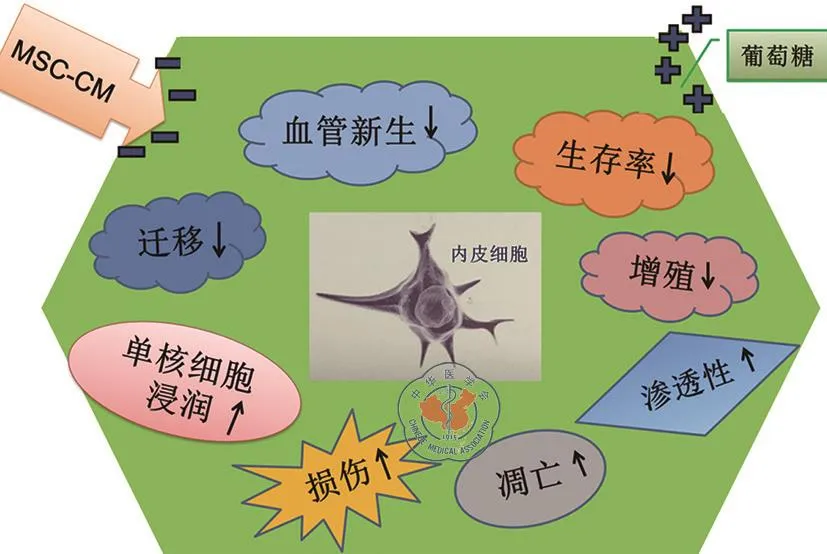
图1 MSC-CM逆转葡萄糖对内皮细胞功能的影响
(三)MSC-CM减少炎症细胞的黏附及炎症因子的表达
在AS中,氧化损伤会带来持续性的炎症反应,而MSC- CM的免疫调节功能发挥了一定的代偿作用。输注MSC-CM至AS模型小鼠中,体循环中的单核细胞、巨噬细胞和T细胞的数量有所降低。
将MSC-CM作用于人主动脉内皮细胞(human aortic endothelial cells,HAOECs),MSC-CM 中含有的 HGF 抑制了单核细胞对内皮细胞的黏附。HGF可抑制NFκB通路,下调HAOECs中E-选择素的表达,同时减弱外周血单核细胞系来源的单核-巨噬细胞(THP-1细胞)对内皮细胞的黏附。HGF还可以抑制平滑肌细胞中的JNK通路的活化,抑制脂多糖诱导的血管细胞黏附分子-1(vascular cell adhesion molecule,VCAM-1)表达,因此JNK(MAPK)和 NFκB 是HGF在内皮细胞中发挥抗炎作用的下游靶点,除了HGF,MSC-CM还含有其他多种细胞因子,包括小分子化合物和细胞外囊泡(extracellular vesicles,EVs),可能也发挥一定抗炎作用。
研究发现,MSC-CM和超滤MSC-CM后得到的EVs可以减少肿瘤坏死因子(tumor necrosis factor,TNF)诱导炎症损伤内皮细胞中黏附分子的表达。在TNF-α刺激下,内皮细胞中JNK(MAPK)和NFκB信号通路被激活,而MSC- CM和EVs可以抑制JNK(MAPK)和NFκB的磷酸化,逆转TNF-α对内皮细胞的损伤。
另一方面,MSC-CM含有的肿瘤生长因子-β(tumor growth factor,TGF-β),IL-27,TNF-α 刺 激基因 6 和 IL-10也发挥了免疫调节和抗炎作用。MSC-CM中的IGF-1也可以抑制血管壁的炎症反应,过氧化损伤以及斑块的形成。然而IGF-1并不能减少VCAM-1和细胞间黏附分子-1(intercellular cell adhesion molecule,ICAM-1)的表达,因此IGF-1在改善内皮细胞功能中发挥的具体作用及其机制有待进一步研究。
MSC-CM还可增强M2型巨噬细胞活性,并减弱M1型巨噬细胞活性。AS小鼠主动脉弓的冰冻切片染色显示,在斑块形成最初4周,以单核细胞聚集为主,而在斑块形成后,巨噬细胞增殖、聚集进一步加重了炎症反应。在细胞因子和脂质等因素的刺激下,巨噬细胞分化为不同的表型,M1型巨噬细胞分泌促炎细胞因子,M2型巨噬细胞分泌抗炎细胞因子。研究发现,将MSC-CM作用于刺激后的巨噬细胞,可下调M1型巨噬细胞表面标记物的表达,如TNF-α,IL-6和Arg-2,同时上调M2型巨噬细胞表面标记物的表达,如SRA1、MRC1和Arg-1。应用MSC-CM培养骨髓来源的巨噬细胞,MSC-CM中的HGF通过激活转录激活因子3(activator of transcriptional,STAT3),抑制 JNK 和 NFκB 通路来调节巨噬细胞M1/M2之间的类型转换,减轻炎症反应。而对脂多糖活化的脾来源巨噬细胞,MSC-EVs可以下调TNF-α的表达,同时上调IL-10的表达。MSC-CM对内皮细胞和巨噬细胞的影响是不同的,MSC-CM可以促进巨噬细胞对低密度脂蛋白的摄取,却对内皮细胞发挥保护作用,这可能是其减轻AS的作用机制之一,但阐明其中的具体机制还有待深入研究。
(四)MSC-CM抑制血管钙化
随着AS的发展,冠状动脉中的钙沉积,加重了AS斑块的不稳定性,常导致急性冠状动脉综合征的发生。VSMCs向骨(软骨)细胞的转化及其去分化是血管钙化的重要环节,但其发生机制尚不明确。MSC-CM通过阻断BMP2- Smad1/5/8信号通路抑制β-甘油磷酸(glycerol phosphate,β-GP)诱导的血管钙化,发挥关键性的保护作用[27]。MSC-CM可降低VSMCs中的钙含量和碱性磷酸酶活性,减少VSMCs表面成骨细胞标志物的表达,如:Msx2、Runx2和骨钙蛋白(osteocalcin,OC),提示MSC-CM可被用于预防或治疗血管钙化。
炎症是动脉钙沉积的关键因素,钙化本身已被确定为活跃的炎症过程,在不同血管部位(内膜,中膜,外膜),不同程度的钙沉积是AS中非常普遍的现象[64-66]。研究也证实了血管钙化是多种炎症因子共同参与的过程:TNF通过促进骨形态蛋白-2(bone morphogenetic protein,BMP-2)的释放、增强BMP-2的活性来加速VSMCs中的钙沉积;IL-1可以增强非组织特异性碱性磷酸酶的活性,而IL-6可以通过抑制基质γ羧基谷氨酸蛋白(matrix gamma carboxyglutamic acid protein,MGP)来增强BMP-2的活性。研究发现,MSC-CM中的TNF-α刺激基因-6,前列腺素E2,吲哚胺-2, 3-双加氧酶,一氧化氮合酶和IL-10发挥了抗炎作用。同时MSC-CM下调了TNF、IL-1和IL-6的表达,这可能也是MSC-CM减轻钙化的机制之一。而MSC-CM中含有的其他细胞因子,如IGF-1和VEGF可能也在减轻钙化中发挥了重要作用。
四、结论
采用不同预处理方法得到的MSC-CM中可能含有不同的细胞因子,如低氧预处理MSCs,可提高MSC-CM中VEGF、IGF-1、HGF 和 Ang-1的含量[67];以细胞因子预处理MSCs,也可以诱导MSC-CM中活性成分的改变,如VEGF的表达上调[68];而采用三维球体技术培养MSCs,可上调 MSC-CM 中趋化因子(CXCR4)、抗癌蛋白(TRAIL、IL- 24、CD82)和抗炎蛋白(TSG-6)的表达[69]。
将MSC-CM作为干细胞治疗的替代疗法应用于临床,有助于克服干细胞治疗带来的致瘤隐患。现阶段,应用干细胞治疗疾病的前提是干细胞在移植后依然保持其移植前的特性,然而考虑到机体环境复杂,疾病成因的“土壤学说”,很难确保干细胞在不同土壤中的最终结局。应用条件培养基,不仅过程可控,结果也是可以预期的,并在剂量和给药方式上有更大的灵活性。然而,输注MSC-CM确实难以模拟移植MSCs对活性因子持续、动态的分泌。此外,条件培养基含有动物血清以及死细胞(凋亡细胞)释放的蛋白质[70],直接输注或有一定风险。因此,将MSC-CM治疗AS真正用于临床前,还需要更多的体内(体外)实验探究MSC-CM中具体的活性成分及其作用机制。
