外泌体MicroRNA-1246促进星形胶质瘤细胞增殖与侵袭的研究
2018-04-02解学军张冰
解学军 张冰
神经胶质瘤是最常见的高致死率恶性脑部肿瘤,尽管手术切除、化疗与放疗等手段已经极大地改善了患者的预后,但患者的生存期仍然较短[1-2]。预后较差的主要原因之一是胶质瘤细胞常常会侵入中枢神经系统,造成肿瘤细胞的侵袭和转移,给治疗带来很多困难[3-4]。近年来,大量研究已经表明microRNA(miRNA)的异常表达在恶性神经胶质瘤的发生与发展过程中起到重要作用,miRNA通过调节关键蛋白的表达,能够极大地影响肿瘤的增殖与侵袭。
越来越多的研究表明,外泌体在细胞间起到了重要的通讯作用[5]。外泌体进入血液循环后,其携带的miRNA等物质会影响癌症的发展和转移等过程[6]。细胞黏附分子1(cell adhesion molecule 1,CADM1)介导细胞的接触抑制作用,抑制肿瘤细胞的转移和增殖,因此是一种肿瘤抑制因子[7-8]。研究显示,miRNA-1246可促进肝癌的转移与侵袭[9],因此胶质瘤的高侵袭性,是由miRNA-1246介导的CADM1表达水平变化导致。本研究旨在探究血液循环中胶质瘤来源的外泌体,是否通过miRNA-1246作用于CADM1促进胶质瘤的增殖与迁移,为胶质瘤的早期诊断与治疗提供新的靶点。
材料与方法
一、实验材料
1.组织样本:从赤峰学院附属医院2015至2017年住院的恶性胶质瘤患者中随机挑选30位与健康志愿者中随机挑选30位纳为本次研究对象。排除标准:(1)严重心脏、肝脏、肾脏、肺功能不全;(2)合并感染、肿瘤、免疫性疾病;(3)合并血液系统疾病。该研究通过了赤峰学院附属医院伦理委员会的批准,所有患者都签署了知情同意书。所有组织在切除后立即冰冻并保存于-80℃,以备进一步实验。
2.细胞系:U-118 MG人脑星形胶质母细胞瘤(北京北纳生物公司)。
3.实验试剂:DMEM培养基(美国Gibco公司),Lipofectamine 2000(美国 Invitrogen公司),外泌体分离试剂(美国Invitrogen公司),双萤光素酶报告基因检测试剂盒,RIPA裂解液,PMSF,BCA蛋白浓度测定试剂盒,SDS-PAGE蛋白上样缓冲液,CCK8试剂盒,cDNA第一链合成试剂盒与Trizol(上海碧云天生物公司),CADM1一抗(武汉博士德公司),HRP标记的二抗(武汉博士德公司)。
二、实验方法
1.胶质瘤细胞系培养与转染:U-118 MG细胞培养于含10﹪胎牛血清与1﹪青霉素-链霉素的高糖DMEM培养基中,培养环境37 ℃,含5﹪CO2。在细胞生长至90﹪密度时,以Lipofectamine 2000作为转染试剂按照操作说明将miRNA-1246模拟物或抑制剂转染至细胞内,每孔加入50 μl培养基稀释的 2 μl Lipofectamine 2000。
2.外泌体提取与鉴定:使用外泌体分离试剂从人血清中分离外泌体。500 μl血清2 000×g离心30 min 去除杂质,吸取 300 μl与 60 μl分离试剂混合,4 ℃孵育30 min,室温下10 000×g离心10 min,吸弃上清液,加入150 μl PBS重悬,4 ℃保存备用。外泌体多聚甲醛固定后滴加到铜网上,乙酸双氧铀负染,使用透射电子显微镜观察外泌体的形态。
3.细胞侵袭实验:使用Matrigel基质胶包被的Transwell小室测定U-118 MG细胞的侵袭迁移能力。实验分为对照组、miRNA-1246抑制剂组与miRNA-1246模拟物组,各组设6个复孔。加100 μl无血清培养基细胞悬液至Transwell上室,600 μl培养基(10﹪血清)加入下室。24 h后取出小室,PBS溶液洗涤后甲醇固定30 min,0.1﹪结晶紫染色20 min,镜下观察。
4.细胞增殖检测:使用CCK-8试剂盒检测细胞增殖。实验分为对照组、miRNA-1246抑制剂组与miRNA-1246模拟物组,各组设6个复孔。U-118 MG细胞贴壁于96孔板并培养48 h后,每孔加入10 μl CCK-8试剂,继续培养2 h,使用酶标仪测定450 nm处吸光度值。
5.Western Blot:在冰上使用RIPA裂解液裂解组织标本或U-118MG细胞,4 ℃条件下12 000×g离心20 min后收集上清液,使用BCA试剂盒测定蛋白浓度。混合蛋白与上样缓冲液后进行SDS- PAGE电泳分离蛋白。随后转至PVDF膜,封闭液封闭,CADM1一抗4 ℃孵育过夜,HRP标记的二抗室温孵育2 h。化学发光底物工作液处理后,置于Tanon-5200化学发光分析系统内显影。使用GAPDH作为内参。
6.RNA提取与定量RT-PCR:使用Trizol按照常规方式提取组织与细胞或外泌体中的RNA[10]。使用cDNA合成试剂盒合成cDNA第一链。随后使用SYBR Green I染料在CFX Connect 荧光定量 PCR检测系统中进行RT-PCR,以GAPDH做归一化处理。使用2-ΔΔCt法对RNA水平进行相对定量。miRNA的荧光定量使用miRNAqRT- PCR系列试剂盒进行。引物序列如下:GAPDH上游引 物:5'-CTCAGTTGCTGAGGAGTCCC-3',下游:5'-ATCGAGAGAAGGGAGGGCT-3';CADM1上 游:5'-TCAACACGCCGTACTGTCTG-3',下游:5'-GTGGGAGGAGGGATAGTTGTG-3';miRNA-1246:5'-AATGGATTTTTGGAGCAGG-3'。
7.报告基因构建与荧光报告实验:包含CADM1 3'非翻译区的报告基因pGL3载体质粒由吉玛基因合成(CADM1-WT)。同时也合成了结合位点突变的报告基因(CADM1-Mut)。细胞在24 孔板培养至贴壁后,以100 ng每孔的浓度转染至U-118MG细胞,同时转染的还有miRNA-1246模拟物和模拟物对照组,每组设置3个复孔。转染24 h后使用双萤光素酶报告基因检测试剂盒检测各组荧光强度。
三、统计学分析方法
采用SPSS 19.0 软件进行统计分析,蛋白水平、RNA水平、侵袭细胞数量、450 nm吸光度和荧光强度以表示,两组间比较采用t检验,CADM1蛋白与miRNA-1246含量的关系采用直线相关法分析多组间及两两比较采用方差分析和SNK-q检验,线性回归分析检测负相关性。以P< 0.05为差异具有统计学意义。
结 果
一、恶性胶质瘤患者血液外泌体中miRNA-1246含量检测
从患者和健康志愿者血液中提取外泌体并进行观察。透射电子显微镜结果表明,外泌体呈球形,直径约40 ~ 100 nm(图1)。随后使用Western Blot检测了外泌体的特异性表面标志蛋白CD63与HSG101(图2)。定量RT-PCR检测外泌体内miRNA-1246水平,结果表明患者来源外泌体内miRNA-1246 浓度高于对照组(P< 0.05,图 3)。

图1 透射电镜观察外泌体(×1000)
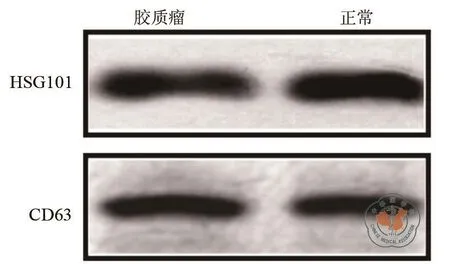
图2 Western Blot检测表面标志蛋白CD63与HSG101
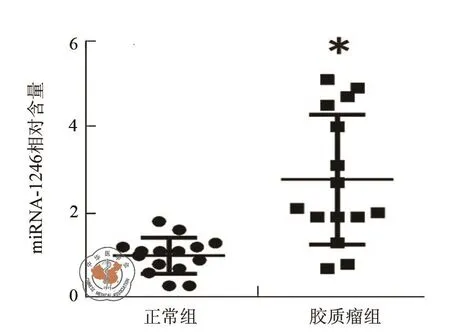
图3 外泌体miRNA-1246水平检测
二、U-118MG细胞增殖与侵袭检测

图4 普通显微镜下观察胶质瘤细胞侵袭能力(结晶紫染色,×200)
CCK-8实验检测了U-118 MG细胞在转染了miRNA-1246模拟物或抑制剂之后增殖能力,结果表明,转染了miRNA-1246模拟物的细胞增殖能力高于未转染的对照组;相反,转染抑制剂之后细胞增殖能力则降低(P< 0.01,表 1)。Transwell实验结果也表明,miRNA-1246模拟物会提高U-118 MG细胞侵袭能力,miRNA-1246抑制剂则相反(P< 0.01,图 4,表 1)。

表1 U-118 MG细胞转染后侵袭数量与CCK-8实验(x± s)
三、荧光素酶报告实验检测
使用荧光素酶报告实验检测miRNA-1246是否作用于CADM1。将CADM1-WT或CADM1-Mut转染至事先转染了miRNA-1246模拟物或模拟物对照组的U-118 MG细胞48 h后检测各组的荧光强度。结果表明,转染CADM1-WT后,miRNA-1246模拟物组的细胞相对荧光强度为4.98±1.86,低于miRNA-1246模拟物对照组10.34±2.60(t= 7.235,P= 0.006),而转染了CADM1-Mut的细胞间比较差异没有统计学意义(miRNA-1246模拟物对照组:9.71±1.62,miRNA-1246模拟物组:9.53±1.47)。为了检测miRNA-1246是否会影响CADM1的表达,测定了U-118 MG细胞转染miRNA-1246抑制剂前后CADM1的mRNA和蛋白水平。结果表明,转染miRNA-1246抑制剂后CADM1 mRNA水平没有变化,miR-1246抑制剂对照组蛋白含量为1.17±0.11,低 于 miR-1246抑 制 剂 组 1.84±0.15(t= 11.68,P= 0.014)。
四、胶质瘤样本蛋白与基因水平检测
检测了胶质瘤样本与癌旁正常样本中CADM1蛋白的含量,并研究其与对应患者血液外泌体中miRNA-1246含量的关系。结果表明,相对于癌旁正常组织1.00±0.26,胶质瘤组织中CADM1蛋白含量降低0.48±0.31(P= 0.004)。在胶质瘤组织中,CADM1蛋白含量与miRNA-1246水平也呈负相关关系(r= -0.88,P< 0.05,图 5)。

图5 质瘤组织中CADM1蛋白含量与外泌体miRNA-1246水平的关系
讨 论
星形胶质细胞瘤是最常见的胶质瘤,具有较高侵袭性,导致难以完全手术切除[11]。外泌体近年来成为研究热点,许多研究已经证明其在肿瘤的发生、发展与转移过程中起到重要作用。肿瘤细胞分泌的外泌体携带特异性小分子或RNA,能够影响其他细胞的生物学功能,从而调节癌症进程[12]。miRNA作为一种长度不超过25个核苷酸的非编码单链RNA分子,能够参与转录后基因表达调控[13]。研究表明,肿瘤细胞来源的外泌体中携带有各种miRNA,例如,非小细胞肺癌来源的外泌体携带miR-222-3p,会增强癌症耐药性,促进细胞的迁移侵袭能力[14]。miRNA-1246是一种促癌因子,研究表明其能够增强肝癌细胞的迁移与侵袭能力[15]。结直肠癌细胞分泌的囊泡含有miRNA-1246,能够促进肿瘤部位的血管生成[16]。本研究通过实验探究了胶质瘤细胞外泌体中的miRNA-1246是否能够抑制CADM1从而增强细胞的增殖与侵袭活性,影响恶性胶质瘤进展。
首先分离并分析了胶质瘤患者与正常人血液的外泌体,RT-PCR结果证明了患者来源的外泌体包含有更多的miRNA-1246。随后笔者用星形胶质瘤细胞系U-118 MG进行体外实验。在U-118 MG细胞转染miRNA-1246模拟物或者抑制剂后,使用Matrigel基质胶包被的Transwell实验检验其侵袭能力,结果表明miRNA-1246能够增强胶质瘤细胞的侵袭能力,而抑制miRNA-1246后,细胞的侵袭能力减弱。CCK-8实验结果也表明,miRNA-1246增强了胶质瘤细胞的增殖活性,抑制后则相反。为了验证miRNA-1246作用于CADM1的机制,笔者进行了荧光素酶报告基因实验,结果表明miRNA-1246能够作用于CADM1的3'非翻译区,从而抑制CADM1蛋白的表达。由于CADM1介导了细胞的接触抑制作用,抑制了肿瘤细胞的转移和增殖,因此CADM1蛋白表达被抑制后胶质瘤细胞的增殖与侵袭能力增强,促进了胶质瘤的转移。随后对胶质瘤样本的检测也进一步证明,患者胶质瘤组织内CADM1蛋白含量降低,与对应的外泌体内miRNA-1246含量成反比。
本文的研究证明,恶性星形胶质瘤分泌的外泌体中miRNA-1246含量增多,其可作用于CADM1 mRNA的3'非翻译端,抑制了CADM1蛋白的表达,从而导致胶质瘤细胞的增殖与侵袭能力增强,促进了恶性星形胶质瘤的转移。本研究发现了胶质瘤转移的分子机制,为胶质瘤的早期诊断与治疗提供新的靶点。
