人脐带间充质干细胞微囊减轻小鼠急性肾损伤的研究
2018-04-02张志远侯艳萍邹翔宇周瑾邢晓宇琚官群钟量孙杰
张志远 侯艳萍 邹翔宇 周瑾 邢晓宇 琚官群 钟量 孙杰
急性肾损伤(acute kidney injury,AKI)是一种涉及广泛的临床常见危重病,可由多种病因造成短期内肾功能急性减退[1-2]。以往认为AKI是一个自愈性疾病,但近年来的研究显示,AKI可导致肾脏不完全修复、持续慢性炎症和进展性纤维化,从而导致器官功能的慢性丧失[3]。不同研究报道显示,30﹪~ 70﹪的AKI存活病例进展为慢性肾脏病(chronic kidney disease,CKD),17﹪的 AKI患者1年内进展至终末期肾脏病(end stage renal disease,ESRD)[4]。目前针对CKD有效治疗措施少而且疗效欠佳,同时儿童肾脏由于易受低血流灌注、肾小球滤过率低、肾血管阻力大和高肾素活性等影响,一旦发生肾损伤预后较差,并发CKD的机率升高,死亡率增加[5-6]。因此,制定适宜的治疗方案显得十分迫切。
多数学者认为,肾小管上皮细胞向间质表型转化(epithelial-mesenchymal transition,EMT)是肾损伤后期纤维化发生的主要细胞机制[6-7]。在EMT进程中很多在组织器官发育过程中已经消失的基因重新出现并再次活化导致上皮细胞稳态被打破,其中Snail基因的再次出现和活化是驱动EMT的主要转录因子之一[8-9]。近年来,干细胞细胞外囊泡(extracellular vesicles,EVs)对 AKI的 治 疗 作用逐渐进入人们的视野,EVs是由细胞释放的、大小不一的囊泡(30 ~ 1 000 nm),包含受体(表面)、生物活性分子(蛋白质和脂质)、有效的遗传物质(microRNA和mRNA),被认为是细胞间信息交流的重要载体[10-11]。EVs能通过配体和受体结合识别靶细胞向其传递受体和生物活性分子。更重要的是EVs能投递microRNA及mRNA到靶细胞,传递遗传信息,调控其基因表达。最近的研究证实,间充质干细胞(mesenchymal stem cells,MSCs)来源的EVs作用效果类似MSCs,对多种器官组织的损伤具有良好修复效果[12-13]。在前期研究中,通过对单侧肾蒂阻断缺血再灌注损伤1 h的小鼠尾静脉注射人类脐带间质干细胞源性EVs,成功阻止了肾损伤引发的肾纤维化[14],还发现人成纤维细胞源性EVs并不具有抗纤维化效应,而经RNA酶处理过的人脐带MSCs源性EVs也丧失了抗纤维化性能[15]。据此认为人脐带MSCs源性EVs投递了某些特殊的RNA信息,并参与肾纤维化信号的调控。已有研究报道,Oct-4抑制促EMT信号Snail激活细胞内的上皮化程序[16]。
材料与方法
一、材料
1.实验动物:体重20 ~ 30 g健康雄性的清洁级C57BL/6小鼠(上海斯莱克实验动物有限公司)。本动物实验方案通过上海交通大学医学院附属上海儿童医学中心实验动物管理小组审查批准。
2.试剂和仪器:低糖DMEM(美国Thermo scienti fi c公司),原位细胞凋亡检测试剂盒(瑞士Roche公司),Masson染色试剂盒(上海哈灵生物科技有限公司),兔抗小鼠PCNA抗体( 美国Abcam公司),辣根过氧化物酶DAB显色试剂盒(美国Abcam有限公司),BrdU细胞增殖检测试剂盒(美国Sigma-Aldrich公司),美国ABI ViiATM 7实时荧光定量PCR系统(美国ABI公司),DMI3000B 荧光显微镜(德国Leica公司)。
二、实验方法
(一)建立单侧肾急性肾损伤的动物模型
切除雄性C57BL/6小鼠右肾,并使左肾缺血45 min。实验动物分组采用随机数字表法。根据不同的处理方式将动物分成不同的组,每组使用6只 小 鼠:(1)空 白 组(Vehicle);(2) EV 组(EVs);(3)Oct-4过表达组(EVs + Oct-4);(4)Oct-4 低敲组(EVs – Oct-4)。肾功能测定中增加开腹后直接关腹组作为假手术组(Sham组)。再灌注后立即通过尾静脉向空白组注射1 ml磷酸盐缓冲液,向EV组,Oct-4过表达组及Oct-4低敲组分别注射1 ml提取自人脐带MSCs,提取自过表达Oct-4基因后的人脐带MSCs及提取自敲低Oct-4基因的人脐带MSCs的EVs悬液。
(二)细胞培养
人脐带均来源于上海交通大学附属第一人民医院的足月剖宫产婴儿,无菌获取脐带后,储存在Dulbecco's改良Eagle培养基(DMEM)中,在4 h内完成细胞分离[17]。具体步骤如下:洗净脐带后,去掉脐动脉和静脉,脐带粉碎成1 ~ 2 mm3的碎片,并转移到含10﹪胎牛血清低糖DMEM(DMED-LG)培养皿中,并置于含有5﹪ CO2的37 ℃恒温恒湿细胞培养箱中。两天更换培养液1次。两周后,用0.25﹪胰蛋白酶消化收获贴壁细胞并传代培养。待MSCs培养至第3代并鉴定,第3 ~ 6代的细胞用于后续实验。
综上所述,尿糖与尿微量白蛋白联合检测显著提高了糖尿病早期肾损伤的检出效果,更有利于疾病的早发现、早治疗。
肾小管上皮细胞来自C57BL/6小鼠,无菌环境下取小鼠肾脏,去掉表面筋膜,PBS冲洗后剪碎并移入离心管中,使用0.2﹪Ⅰ型胶原酶,37 ℃振摇消化1 h后胎牛血清终止消化,过滤离心重悬后培养于低糖DMEM培养液中,获取稳定传代的肾小管上皮细胞后,对肾小管上皮细胞进行缺氧处理,将培养皿放入缺氧处理盒中,点燃蜡烛后将盒子密封,5 s后蜡烛可将盒子内氧气消耗完而熄灭;将整个盒子放回培养箱中,1 h后打开盒子取出培养皿,各组细胞分别加入相应的外泌体或PBS,然后放回培养箱中继续培养。
(三)人脐带MSCs OCT-4基因的过表达和敲低
1.shRNA 慢病毒重组质粒的构建:根据GenBank提供的靶基因序列,结合RNA干扰序列设计原则,设计Oct-4的RNA干扰靶点序列。再分别设计并合成shRNA寡聚单链DNA。将寡聚单链DNA退火成双链,将双链的shRNA oligo分别插入到shRNA慢病毒载体(pGMLV-SC5 RNAi)中,构建shRNA慢病毒重组质粒,并转化至感受态细胞DH5α。测序检测shRNA干扰载体是否成功。
2.慢病毒转染人脐带MSCs:将上述慢病毒颗粒与另外两种同源辅助质粒(pHelper 1.0和pHelper 2.0)一起包装到293T细胞中并收获慢病毒。包装后的慢病毒载体用于转染对数生长期的人脐带MSCs。3 d后获得OCT-4过表达或敲低的人脐带MSCs。
(四)EVs的分离
人脐带MSCs经分离培养3 ~ 6代,细胞融合至70﹪时,加无血清低糖DMEM培养基(含0.5﹪BSA)培养 16 ~ 18 h后(过夜),收集细胞培养上清液(即条件培养基)-80 ℃冻存备用,剩余细胞经台盼蓝染色鉴定细胞活力大于99﹪,且经TUNEL染色鉴定无凋亡,并计数。收集的条件培养基在4 ℃ 2 000×g离心20 min,去除死细胞及细胞碎片等,保留上清液;将上清液应用超高速离心机4 ℃l00 000×g离心60 min,小心去除上清液,以适量M199培养基重悬,即为制备好的细胞外囊泡悬液,冻存于-80 ℃冰箱[18]。
(五)肾功能测定
术后14 d后通过心脏采血抽取小鼠血液样品用于测量血清尿素氮和肌酐。血清样本送上海儿童医学中心检验科采用化学发光法测定。
(六)细胞或组织的染色
1.肾组织免疫染色:将肾组织用4﹪多聚甲醛固定后包埋于石蜡中。切片分别孵育抗小鼠PCNA抗体(1:100稀释)、再孵育辣根过氧化物酶(HRP)偶联的二抗。使用二氨基联苯胺(DAB)试剂作为底物,最后以苏木素进行复染。肾组织冰冻切片后用4﹪多聚甲醛固定,再用HEPES-250 Triton×100缓冲液破膜。4 ℃孵育兔抗鼠α-SMA一抗(1:100稀释)过夜。PBS冲洗后孵育荧光标记二抗。DAPI套染细胞核。计量每组切片10个随机高倍视野的阳性细胞个数作为统计指标。
2.肾小管上皮细胞免疫组化染色:将缺氧损伤的肾小管上皮细胞置于含有EVs或对照培养液的培养腔室玻片上孵育48 h。将载玻片在4﹪多聚甲醛固定,并用HEPES-250 Triton×100缓冲液破膜。加入抗小鼠PCNA抗体(1:1 000稀释)作为一抗。苏木素复染细胞核。计量每组切片10个随机高倍视野的阳性细胞个数作为统计指标。
3.Masson染色:采用Masson染色评估胶原在肾间质中的沉积情况。组织固定于Bouin氏液,流水冲洗一夜,第二天常规脱水包埋并切片。切片脱蜡至水后,Weiger氏铁苏木素染5 ~ 10 min,流水稍微冲洗后以1﹪盐酸酒精分化1 min;流水冲洗约25 min后,丽春红酸性品红液染5 ~ 10 min;蒸馏水稍冲洗后以1﹪磷钼酸水溶液处理5 min,然后直接用苯胺蓝液复染5 min;1﹪冰醋酸处理1 min。最后常规梯度脱水封片。上述染色后的组织予以半定量评分。0:没有病变;1:少于33﹪肾实质(或细胞)受影响;2:33﹪~ 67﹪肾实质(或细胞)受影响;3:66﹪以上肾实质(或细胞)受影响。采用观察者盲法,让该观察者对每只小鼠的100个随机高倍视野进行评分。取所评分之和作为总评分。
4.TUNEL染色:本实验釆用商业化的原位细胞凋亡检测试剂盒,在加荧光素标记的dUTP之后孵育HRP标记的二抗,使用DAB使其显色;按照试剂盒制造商提供的产品说明书,简要步骤如下:组织石蜡切片复水通透后,每张切片滴加蛋白酶K工作液,确保覆盖全部组织,室温孵育20 min后冲洗;取TUNEL试剂盒内适量试剂1(TdT)和试剂 2(dUTP)按1:9混合滴于组织,切片平放于湿盒内,37 ℃水浴锅孵育2 h。使用甲醇配制的3﹪过氧化氢溶液封闭内源性过氧化物酶。切片冲洗稍甩干后,每张切片加适量试剂3(converter-POD)覆盖组织,切片平放于湿盒内,37 ℃温箱孵育30 min。冲洗后加新鲜配制的DAB显色液,显微镜下控制显色时间,阳性为细胞核呈棕黄色,自来水冲洗切片终止显色。最后苏木素复染并完成封片。计量每组切片10个随机高倍视野的阳性细胞个数作为统计指标。
(七)RT-qPCR检测
应用TRIZOL试剂提取组织总RNA,并反转录合成cDNA,定量PCR通过Taqman探针法检测小鼠Snail基因的表达。引物由捷瑞(上海,中国)公司合成,序列如下:Mice Snail:Forward 5,- CTGGTTCCTGCTTGGCTCTCTT-3,Reverse 5,GTGGGTTGGCTTTAGTTCTATGGC -3。
三、统计学分析方法
采用SPSS 19.0软件进行数据处理,染色结果以每高倍镜视野(HPF)中阳性细胞计数,或阳性染色面积占视野总面积表示。3次独立实验的结果以±s表示。多组间比较采用方差分析,两组间比较采用SNK-q检验,以P< 0.05为差异具有统计学意义。
结 果
一、人脐带MSCs减轻肾小管细胞缺氧导致的细胞凋亡并促进其再生
对4组肾小管上皮细胞进行缺氧处理,随后通过TUNEL及BrdU染色观察对比肾小管上皮细胞在缺氧后的凋亡与增殖情况,结果显示,48 h之后,4组肾小管上皮细胞都存在着不同程度的凋亡情况,凋亡程度从高到低分别是空白组(10±2)/HPF,Oct-4 低 敲 组(7±1)/HPF,EVs组(2±1)/HPF,Oct-4过表达组(0 ~ 1)/HPF。其中空白组凋亡情况最明显,而其他3组低于空白组(P<0.05),另外3组中,Oct-4过表达组又低于另外2组(P<0.05)。BrdU可在细胞分裂时嵌入到DNA中,从而使增殖的细胞发出荧光,实验显示,48h低氧处理后,细胞增殖情况由高到底分别是,Oct-4过表达组(7±2)/HPF,EVs 组(4±1)/HPF,Oct-4 低 敲组(2±1)/HPF,空白组(0 ~ 1)/HPF;空白组的增殖情况最差,其他3组的增殖情况均高于空白组(P<0.05),Oct-4过表达组高于正常 EVs组(P<0.01),正常 EVs组也高于敲低组(P<0.01)(图 1,表 1)。
表1 各组肾损伤48 h后TUNEL和BrdU染色情况比较( ± s,/HPF)
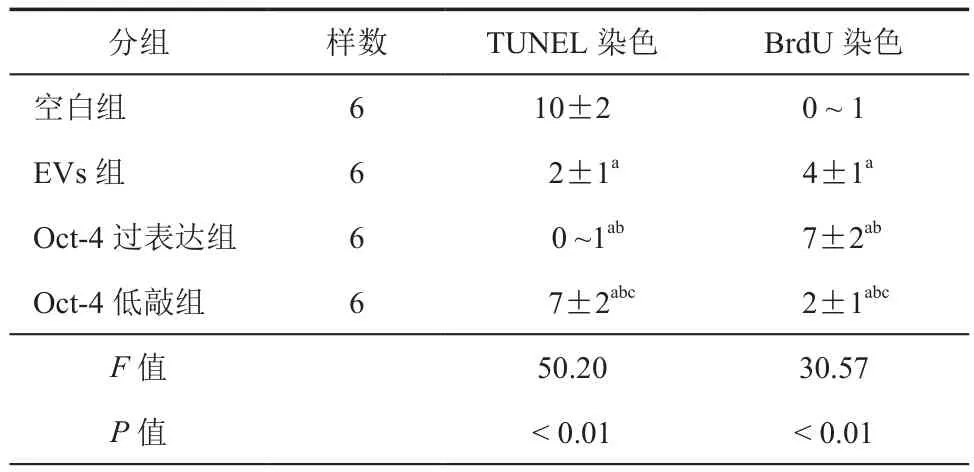
表1 各组肾损伤48 h后TUNEL和BrdU染色情况比较( ± s,/HPF)
注:与空白组比较,aP< 0.05;与EVs组比较,bP< 0.05;与Oct-4过表达组比较,cP< 0.01
分组 样数 TUNEL染色 BrdU染色空白组 6 10±2 0 ~ 1 EVs组 6 2±1a 4±1a Oct-4 过表达组 6 0 ~1ab 7±2ab Oct-4低敲组 6 7±2abc 2±1abc F值 50.20 30.57 P值 < 0.01 < 0.01
二、人脐带MSCs减轻急性损伤后肾脏细胞凋亡并促进其再生
缺氧再灌注后,肾脏细胞出现凋亡,实验发现在损伤48h及2周后,空白组小鼠损伤后细胞的凋亡情况最为明显,分别为(224±25)/HPF和(145±20)/HPF。而3组EVs处理组的小鼠肾脏凋亡都存在一定程度的减轻,且都与空白组比较差异具有统计学意义(P<0.01)。这其中,以Oct-4过表达组凋亡减轻情况最明显,损伤48h后为(2±1)/HPF,损伤 2周后为(3±2)/HPF,与另外2组比较差异具有统计学意义(P<0.05),而 EVs组与Oct-4敲低组的凋亡减轻情况差异没有统计学意义(图 2,表 2)。
肾组织损伤后,还通过标记PCNA检测了肾脏细胞的增殖情况。与肾脏细胞凋亡减轻的情况相似,4组的结果仍然是Oct-4过表达组细胞增殖的情况最为明显,其损伤48h后为(70±7)/HPF,2周后为(21±4)/HPF,与其他3组比较差异具有统计学意义(P<0.01)。EVs组的细胞增殖情况也高于Oct-4敲低组(P<0.05)。空白组增殖情况最差,其损伤48h 后为(5±2)/HPF,2 周后为(2±1)/HPF,与其他组比较差异具有统计学意义(P<0.001)(图3,表 2)。
图1 荧光显微镜下观察缺氧处理后肾小管上皮细胞TUNEL和BrdU染色(×200)
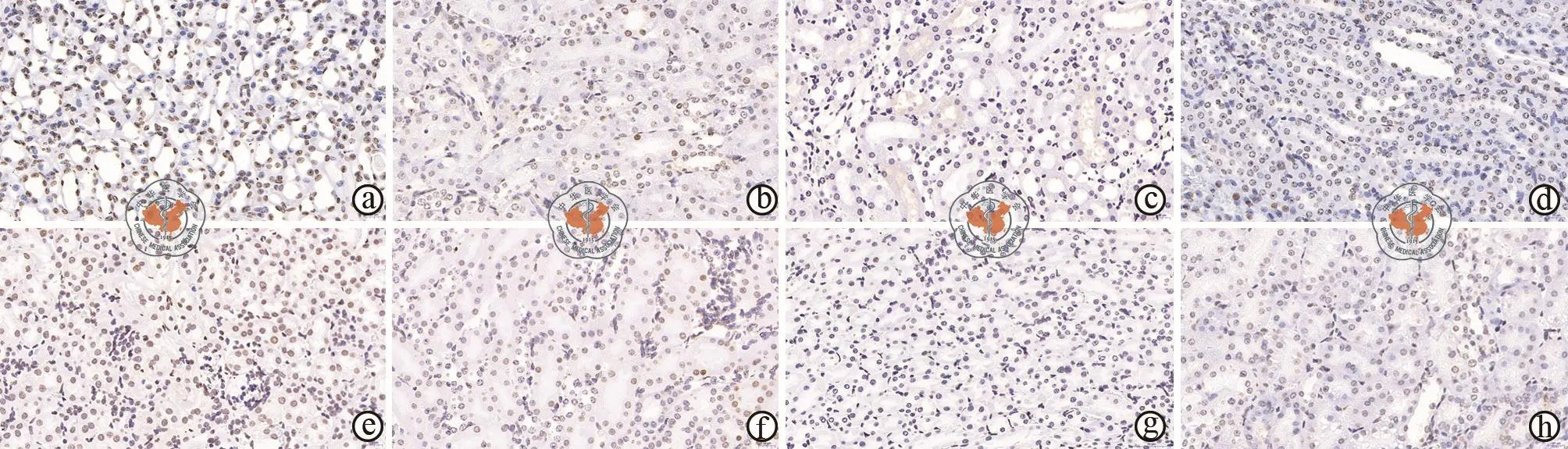
图2 光学显微镜下观察缺氧再灌注后各组小鼠的细胞凋亡情况(TUNEL染色,×200)
表2 各组肾损伤48 h 及2周后TUNEL和BrdU染色情况比较( ± s,/HPF)

表2 各组肾损伤48 h 及2周后TUNEL和BrdU染色情况比较( ± s,/HPF)
注:与空白组比较,aP < 0.01;与 EVs组比较,bP < 0.05;与 Oct-4 过表达组比较,cP < 0.01
TUNEL染色 PCNA染色48 h 2周 48 h 2周空白组 6 224±25 145±20 5± 2 2±1 EVs组 6 114±23a 88±12a 51± 6a 10±2a Oct-4 过表达组 6 2± 1ab 3± 2ab 70± 7ab 21±4ab Oct-4 低敲组 6 134±12ac 107±14abc 29±10abc 5±2bc F值 153.74 116.29 99.93 66.88 P 值 < 0.01 < 0.01 < 0.01 < 0.01分组 样数

图3 光学显微镜下观察急性肾损伤后各组细胞的增殖情况(PCNA染色,×200)
三、EVs处理对实验后肾功能的影响
为了检测肾损伤后的肾功能变化,实验进行后2周收集了小鼠的血液进行了血尿素氮和肌酐值的检测。Sham组小鼠的血尿素氮及血肌酐水平可以被认为与正常生理状态下的小鼠血尿素氮与血肌酐水平相同。假手术组小鼠血尿素氮为(9.8±0.9)mmol/L。实验发现肾损伤后 48h,空白组尿素氮水平最高,为(18.5±0.8)mmol/L,2周后依然为各组中最高(16.7±0.7)mmol/L;上述结果与Sham组小鼠间比较差异具有统计意义(P<0.05)。肾损伤后48h Oct-4过表达组血尿素氮水平较Sham组小鼠无明显变化(9.6±0.4)mmol/L(P=0.55),2周后Oct-4过表达组血尿素氮水平轻度升高(12.6±0.2)mmol/L(P<0.01)。Sham 组小鼠血肌酐为(21.3±1.5)mmol/L,AKI后 48h,空白组血肌酐水平最高(46.3±1.5)mmol/L,与Sham组小鼠相比差异具有统计学意义(P<0.01);AKI后 2周,血肌酐最高的组别为Oct-4敲低组(35.7±1.2)mmol/L,相比Sham组小鼠值(P<0.01)。Oct-4过表达组在AKI后48h及2周后血肌酐水平较Sham组小鼠显著,分别为(17.2±1.4)mmol/L(P=0.02)和(17.1±2.0)mmol/L(P=0.03,图 4)。
四、EVs处理对肾脏纤维化的影响
通过检测α-SMA的情况与Masson染色评估肾损伤之后肾脏纤维化情况的变化。结果显示,肾损伤2周后四组肾脏均存在一定程度的纤维化情况。空白组纤维化最为明显(9.2±1.0)﹪,而其他三组纤维化情况均低于空白组(P<0.05)。Oct-4敲低组的纤维化情况与EVs组差异无统计学意义。Oct-4过表达组的纤维化面积(3.2±1.0)﹪低于另外两个 EVs处理后的组(P< 0.05,图 5)。
五、EVs处理对Snail表达的影响
为了明确肾脏组织中Oct-4与Snail基因的关系,通过PCR的方法检测了四组肾损伤后肾组织中Snail基因的表达量差异。结果显示,空白组的Snail表达量最高(2.3±0.2),其他三组均低于该组。但Oct-4敲低组的Snail表达量(1.8±0.1)与EVs组Snail表达量(1.8±0.1)之间差异无统计学意义(P=0.37),Oct-4过表达组 Snail表达量(0.7±0.1)低于 EVs组 Snail表达(P<0.01,图 6)。
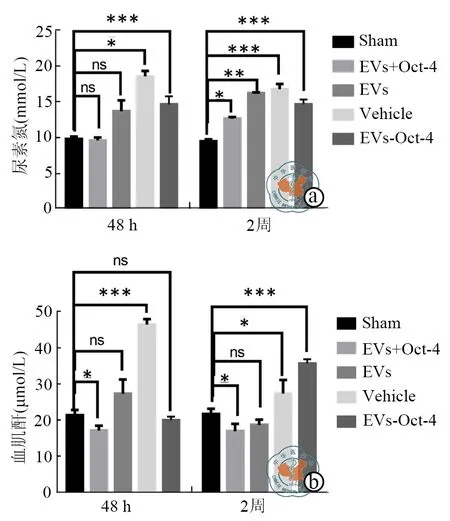
图4 急性肾损伤48 h及2周后小鼠血尿素氮及肌酐含量
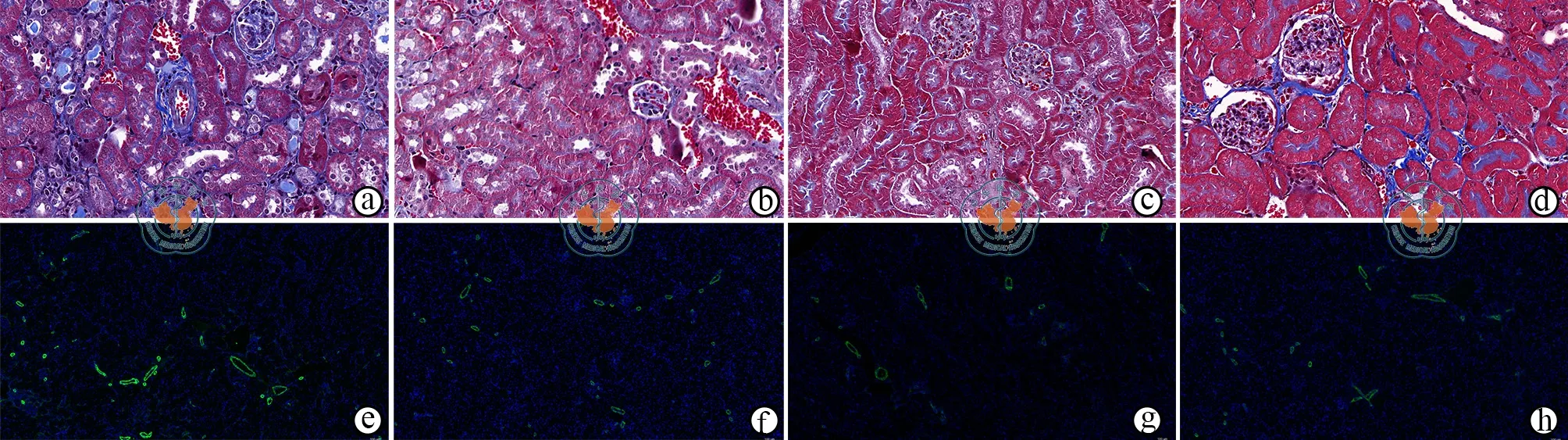
图5 光学显微镜下观察急性肾损伤后各组肾脏纤维化情况(×200)
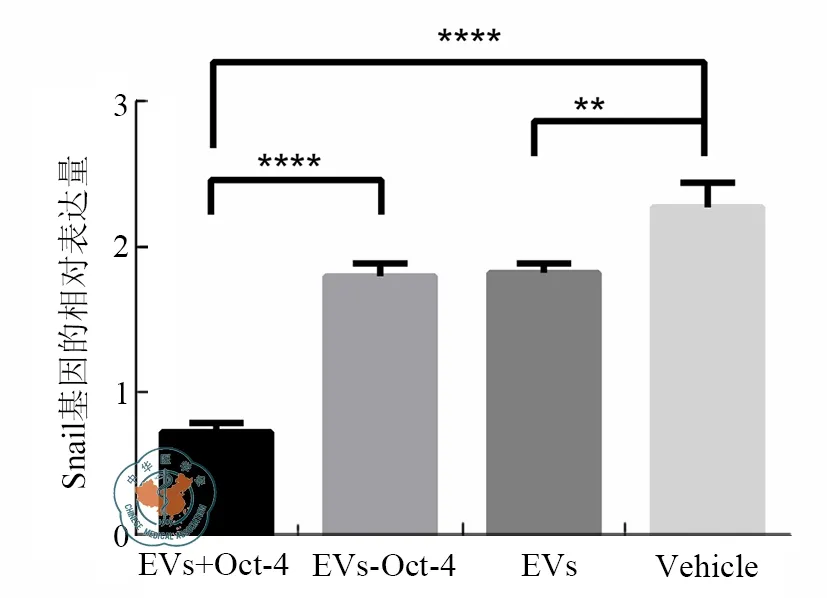
图6 RT-qPCR检测急性肾损伤后肾组织中Snail基因表达结果
讨 论
急性肾损伤及随后发生的肾脏纤维化过程涉及多个机制,其中肾小管细胞增殖的停滞及凋亡的激活,炎症因子的大量释放,活性氧的产生与释放,肾小管上皮DNA损伤与TGF-β1的激活,最终都会导致肾小管上皮细胞的非正常增殖反应与纤维性修复的过度调控[19]。
既往研究表明,MSCs通过旁分泌方式减轻肾损伤[20-21],而EVs在细胞旁分泌中扮演着重要的角色,本课题组前期曾证明MSCs的EVs可通过抑制CX3CL1减少巨噬细胞聚集[18],通过抑制NOX2降低氧化应激反应[22],通过投递miR-30减轻线粒体碎裂[23],减轻急性肾损伤并减轻纤维化,说明间质干细胞EVs可能是通过多种途径治疗急性肾损伤的,本研究将关注点放在OCT-4对于肾损伤的作用上,通过增加与减少EVs中的OCT-4观察了干细胞细胞外囊泡中OCT-4对肾损伤后肾脏的影响,结果发现,过表达OCT-4的EVs可降低体外缺氧引起的肾小管上皮细胞凋亡,并促进肾小管上皮细胞缺氧后的增殖。而在动物试验中,高表达OCT- 4 EVs对于损伤后的肾脏细胞也起到了相似的抑制凋亡促进增殖的后果。除此之外,本研究还检测了不同实验组肾损伤后2周的纤维化情况,结果显示,过表达OCT-4的EVs可抑制肾损伤导致的纤维化,而敲低OCT-4的干细胞EVs,虽然也能从一定程度上抑制肾脏的纤维化,但其效果大打折扣,不仅弱于过表达OCT-4的EVs,也弱于正常MSCsEVs,说明EVs中的OCT-4mRNA在抑制肾损伤后纤维化中扮演着重要的作用。而Li等[24]人发现OCT-4可通过抑制成纤维细胞中的snail基因的表达从而促进MET过程,导致成纤维细胞转变为iPSCs的。
为了探讨EVs中OCT-4mRNA影响肾损伤后纤维化的机制,课题组尝试探索了它与Snail的关系,Snail是一种锌指转录蛋白,可以跟E-钙黏蛋白(E-cadherin)启动子E-boxes结合从而抑制E-cadherin的表达,它主要通过触发EMT参与胚肾发育、纤维化、上皮肿瘤形成,在成体肾脏中Snail基因是缺乏的,而在纤维化肾脏、肾囊肿及肾癌中大量表达[18,20]。已有研究报道,Snail触发EMT后可导致上皮细胞标志物的下降如钙粘素-16、E-Cadherin、细胞角蛋白等,间质细胞标志物明显上升如波形蛋白、α-平滑肌肌动蛋白等,随之Ⅰ型胶原、纤连蛋白等纤维化相关因子成分增加,细胞外基质过度沉积,最终导致组织器官结构破坏、功能损害[25],而本研究结果发现,在损伤后的肾脏中,正常MSCs的EVs可降肾组织Snail的表达,而增加EVs中oct-4 mRNA的数量可放大EVs对Snail表达的抑制作用,减少EVs中OCT-4的量,则减弱EVs对Snail表达的抑制作用。说明OCT-4可能是通过抑制肾损伤中Snail的表达抑制纤维化形成的。
综上所述,认为EVs可通过抑制凋亡促进增殖、抑制纤维化治疗肾损伤,而这其中EVs包含的OCT-4 mRNA可通过抑制肾损伤后Snail基因的表达来抑制肾脏纤维化的形成。
