CHOP双重调控衣霉素诱导的DU-145细胞凋亡及自噬的研究
2018-04-02雷艳詹世淮陈俊秋董会月林榕陈津王水良黄梁浒
雷艳 詹世淮 陈俊秋 董会月 林榕 陈津 王水良 黄梁浒
研究发现C/EBP同源蛋白(C/EBP-homologous protein,CHOP)为许多基因的直接调节产物,与细胞自噬关系密切。CHOP表达上调可以直接抑制丝氨酸蛋白激酶Akt的活性使得mTOR也被抑制,随后激活自噬感应复合物ULK1[1],另一方面还能协同ATF4促进自噬基因Atg5、LC3B的转录[2-3]。以上证据说明CHOP涉及到细胞凋亡与自噬两个复杂的反应过程,但CHOP与自噬之间的功能关系还不清楚。本研究旨在研究内质网应激状态下CHOP调控DU-145细胞的凋亡与自噬,初步阐明其中的分子机制,为后续研究打下基础。
材料与方法
一、试剂与细胞
3-甲基腺嘌呤(3-MA),雷帕霉素(Rapamycin,美国Sigma公司)。衣霉素(tunicamycin,瑞士Enzo Life Sciences公司)。DMEM HIGH Glucose培养基(美国Hyclone公司)。胎牛血清(FBS,美国Gibco公司),抗体 Grp78,p-eIF2α,CHOP,PARP,LC3B,Atg5,Beclin1,PI3K,p-AKt,p-P70S6K,p-4EBP1,p-mTOR,Grp94,eIF2α,mTOR,P70S6K,4EBP1,AKt,β-actin(美 国 Cell Signaling Technology 公司)。PierceTMBCA 蛋白定量试剂盒与Rabbit IgG、Mouse IgG(美国Thermo公司)。ECL蛋白显色液(德国Advansta公司)。FITC Annexin Ⅴ凋亡检测试剂盒(美国BD公司)。
293T细胞和DU-145细胞(中国科学院上海细胞生物学研究所)。
二、方法
1.shCHOP与shLC3B稳定转染细胞株的建立:将生工公司合成的小鼠CHOP与LC3B shRNA序列(表1)插入pLKO.1-TRC克隆载体,抽提质粒DNA备用。经慢病毒包装的方式将shCHOP与shLC3B 10 μg、包装质粒 psPAX27.5 μg、包膜质粒pMD2.G 2.5 μg在PEI的作用下形成的聚合体2.5 m加入50﹪~ 60﹪细胞生长密度的293T细胞中,18 h后更换5 ml新鲜的DF12完全培养基,于24 h后收5 ml病毒上清,48 h后第2次收取5 ml病毒上清。将经0.4 μm滤器过滤后的病毒上清转染DU-145细胞18 h后,连续7 ~ 10 d加入嘌呤霉素(终浓度:1 μg/ml)筛选建立能稳定传代的shCHOP DU-145细胞和shLC3B DU-145细胞。
2.Western Blot检测蛋白表达:收集的总蛋白经BCA法检测蛋白浓度,随后取30 μg蛋白样品进行SDS-PAGE电泳,并转移至PVDF膜上。室温下4﹪BSA摇床上封闭1 h后,与1 : 1000稀释的 一 抗4 ℃孵育过夜。TBST洗膜3次,加入不同比例稀释的HRP标记的二抗,室温孵育1 h,经TBST、PBS各洗膜3次后,加入ECL发光液暗室曝光。
3.FACS检测细胞凋亡:DU-145细胞经0.8 μg/ ml衣霉素分别处理 0、8、12、24 h,胰酶消化后收集细胞沉淀,预冷的PBS洗涤2次,加入试剂盒中的结合液 100 μl重悬,每管加入 5 μl FITC AnnexinⅤ避光染色 15 min后,再加入 5 μl PI染色5 min,每管加入400 μl结合液重悬后即可上机检测。同时设置正常组细胞不染色调电压,经FITC Annexin Ⅴ和PI分别单染的细胞调补偿。

表1 小鼠CHOP与LC3B干扰目标序列
4.细胞免疫荧光检测:DU-145细胞经处理,4﹪多聚甲醛室温固定30 min,PBS洗3次,加入抗体稀释液封闭2 h,加LC3B的一抗4 ℃孵育过夜,含0.1﹪Triton X-100的PBS洗3次后加入二抗,避光孵育1 h,PBS洗后,1 mg/ml DAPI染色5 min后荧光显微镜拍照观察。
三、统计学分析方法
采用SPSS 16.0软件分析结果,荧光定量PCR实验重复3次,每次3个复孔,取各次实验的均值± s为最后结果,两组数据比较采用t检验,以P< 0.05为差异具有统计学意义。
结 果
一、衣霉素诱导DU-145细胞产生ERS并诱导凋亡
如图1a所示0.8 μg/ml衣霉素作用DU-145细胞不同时间均能诱导ERS相关蛋白Grp78、Grp94、p-eIF2α和CHOP表达上调,这表明衣霉素能诱导DU-145细胞产生ERS。促凋亡基因CHOP诱导PARP蛋白表达增加(图1b);如图2流式细胞术AnnexinⅤ和PI双染检测细胞凋亡的结果显示衣霉素处理8 h细胞凋亡率为3.27﹪±1.02﹪,与对照组0.27﹪±0.05﹪相比差异具有统计学意义(P=0.0484),衣霉素处理12 h和24 h的细胞凋亡率分别为8.97﹪±0.71﹪和11.67﹪±1.41﹪,与对照组比较差异具有统计学意义(P< 0.01,图2)。这表明衣霉素诱导细胞凋亡具有一定的时间依赖性。
二、衣霉素抑制PI3K/AKt/mTOR信号通路诱导ERS状态下DU-145细胞自噬
0.8 μg/ml衣霉素促进自噬标志性蛋白LC3Ⅱ的表达,并能促进自噬相关蛋白Atg5和Beclin的表达,提示衣霉素诱导DU-145产生了自噬(图3a)。与对照组相比,0.8 μg/ml衣霉素作用细胞8、12、24 h后,PI3K、p-AKt及其下游蛋白 p-mTOR、p-p70s6K和 p-4EBP1表达均减弱;AKt、mTOR、p70s6K和4EBP1蛋白无明显改变(图3b)。这表明PI3K/AKt/mTOR信号通路负调控衣霉素诱导的DU-145细胞自噬。
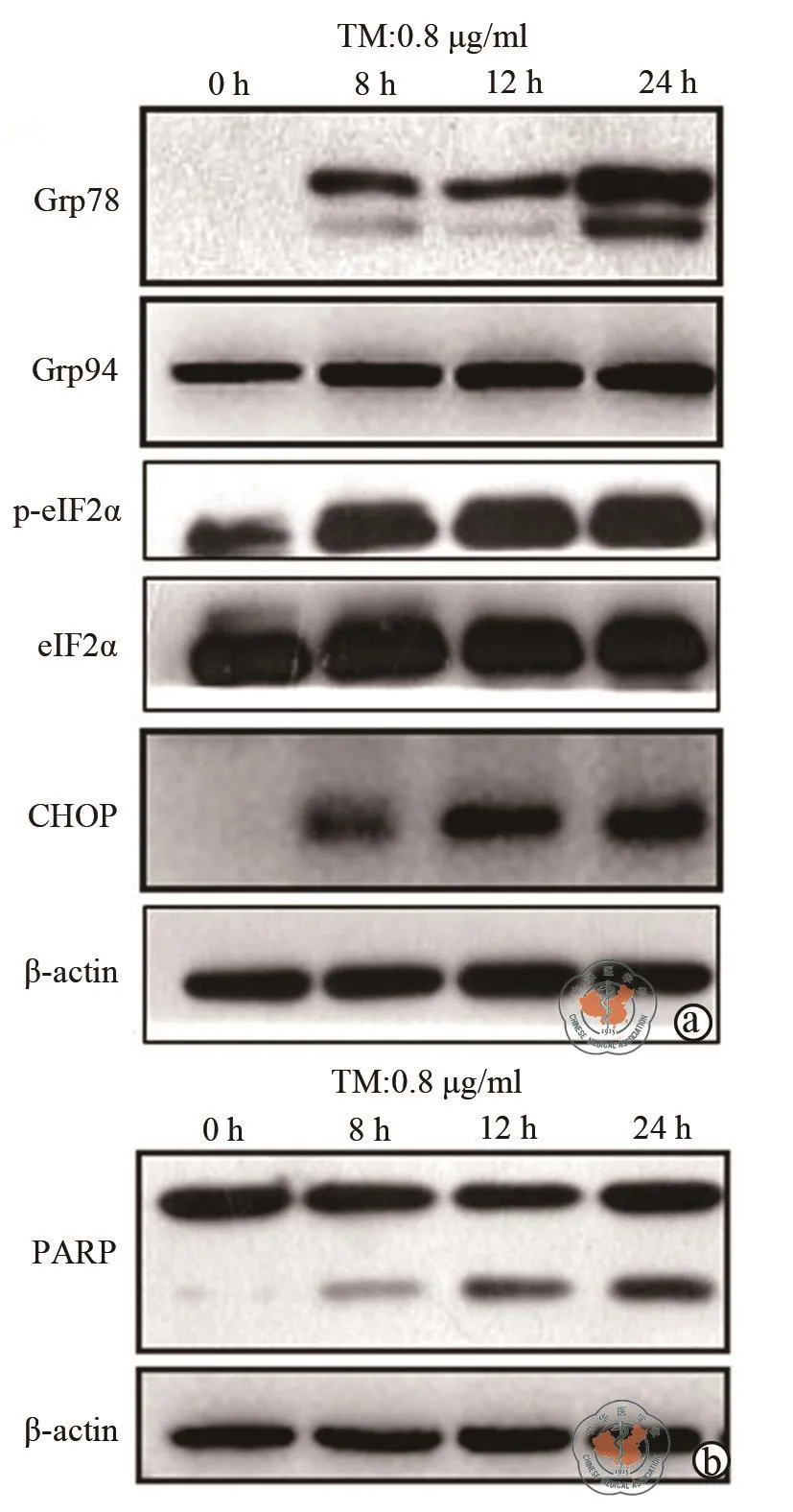
图1 衣霉素诱导DU-145细胞产生ERS并诱导凋亡
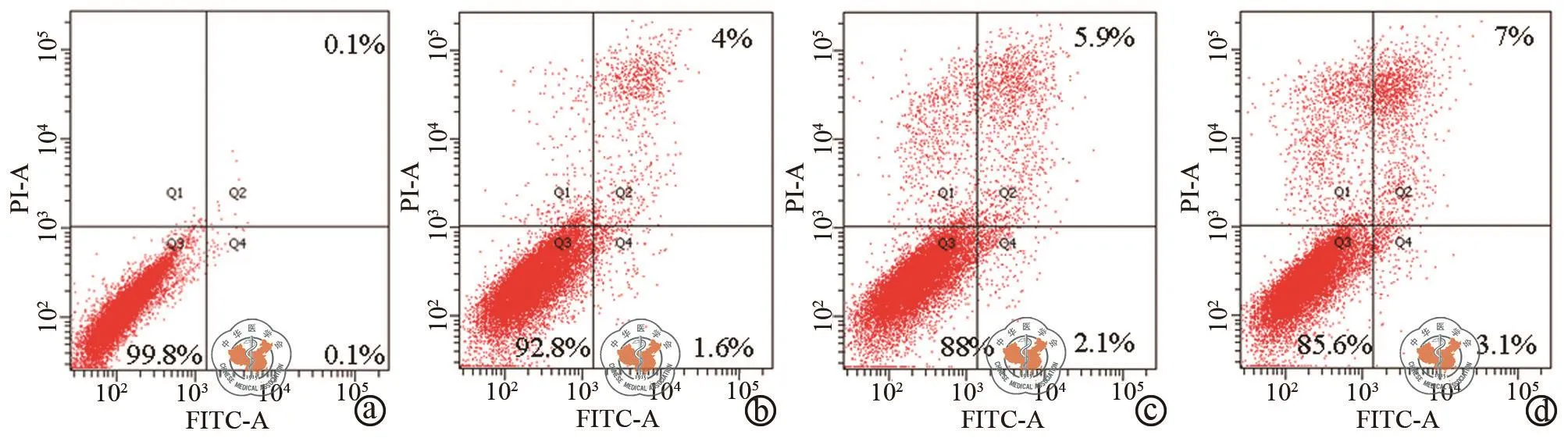
图2 流式细胞术检测细胞凋亡结果

图3 衣霉素通过抑制PI3K/AKt/mTOR激酶活性诱导自噬
三、CHOP基因沉默减轻ERS状态下DU-145细胞凋亡
如图4a所示,shCHOP-1与shCHOP-2的稳定转染细胞株中CHOP的表达均降低,提示CHOP基因沉默效果显著。Western Blot检测结果表明CHOP基因沉默时凋亡蛋白PARP及Caspase3的活性降低(图4b)。如图5所示,CHOP基因沉默时,shCtrl组细胞凋亡率为 32.17﹪±3.93﹪,shCHOP-1组细胞凋亡率为 23.53﹪±3.41﹪,两组相比差异具有统计学意义(P< 0.05)。这表明CHOP基因沉默减轻ERS状态下DU-145细胞凋亡。
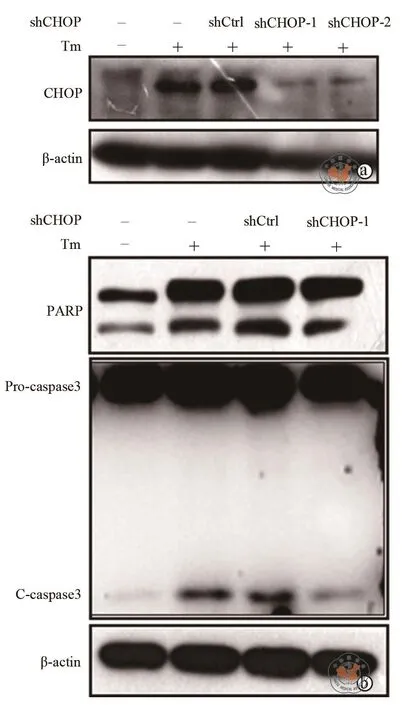
图4 CHOP基因沉默减轻DU-145细胞凋亡
四、CHOP基因沉默促进DU-145细胞自噬
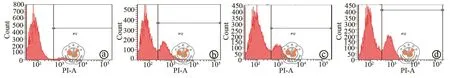
图5 CHOP基因沉默时流式细胞术检测细胞凋亡
图6a荧光定量PCR结果表明,与shCtrl组相比,shCHOP组LC3B的表达增强;CHOP基因沉默时自噬标志性蛋白LC3B的表达高于对照组(图6b)。此外,如图7细胞免疫荧光的结果显示,shCHOP组LC3B的绿色荧光强度高于对照组,这表明CHOP基因沉默促进DU-145细胞自噬。
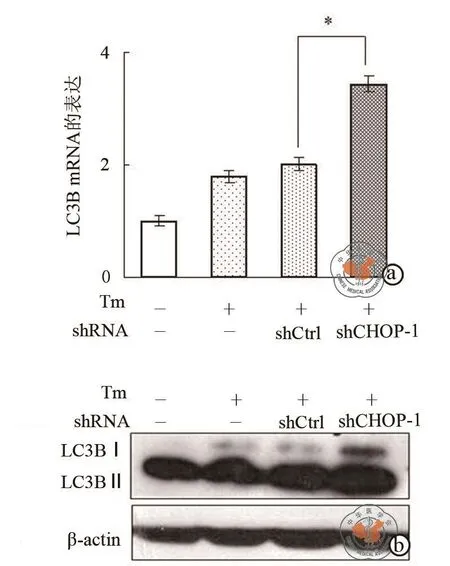
图6 CHOP基因沉默促进DU-145细胞自噬
讨 论
当细胞受到外界过度刺激,细胞内稳态被打破时,会发生内质网应激。内质网应激的3条信号通路都有助于激活细胞自噬:PERK-ATF4通路能抑制AKt的活性激活ULK1;IRE1-XBP1通路激活JNK信号通路后迅速磷酸化Beclin2,使其与Beclin1分离,活化的Beclin1参与自噬体复合物的形成[1,4];ATF6通过上调分子伴侣GRP78的表达来抑制AKt磷酸化,从而增强自噬[5]。
本研究中衣霉素能诱导DU-145细胞产生内质网应激,相关的分子 Grp78、Grp94、p-eIF2α和CHOP表达上调,并能诱导细胞凋亡。此外,在内质网应激的状态下细胞自噬蛋白LC3B、Atg5、Beclin1等大量表达,自噬被激活。研究已经表明CHOP在调控细胞凋亡过程中发挥重要作用,它通过激活GADD34和Ero1-Lα介导细胞凋亡;转录调控抑制抗凋亡蛋白Bcl-2的表达,并促进凋亡蛋白Bim、Bax表达上调及启动Caspase凋亡信号通路[6]。CHOP基因沉默减缓衣霉素诱导的HCT116细胞凋亡[7],先前的究也表明CHOP基因沉默能减缓肝癌细胞Hepa1-6凋亡[8,14],本研究中CHOP基因沉默抑制了DU-145细胞凋亡。
内质网应激状态下,细胞自噬被激活,CHOP除了在调控细胞凋亡方面发挥重要作用之外,它也能调控自噬,弄清分子机制有助于更好的研究凋亡与自噬之间的相互影响。
CHOP在调控自噬方面有不同的报道,一方面有研究表明CHOP基因沉默减缓肝癌细胞自噬,CHOP过表达时能逆转4-PBA对自噬的抑制[9];另一方面也有研究表明CHOP基因沉默对衣霉素诱导的自噬激活没有任何影响,而是内质网应激的ATF分子基因沉默完全抑制了自噬[10];然而也有大量的研究发现CHOP基因沉默时促进自噬的发生,如B'chir等[11]研究表明,CHOP在氨基酸饥饿诱导的自噬和凋亡之间相互影响,一方面CHOP被抑制时减缓细胞凋亡,另一方面CHOP被抑制时促进细胞自噬。Tang等[12]研究发现CHOP基因沉默能减轻LCA诱导的非小细胞癌NSCLC的凋亡,但自噬蛋白LC3B的表达却上调。Shin等[13]研究发现CHOP在类风湿性关节炎滑膜成纤维细胞RASF内质网应激过程中涉及到调控细胞自噬与凋亡,CHOP基因沉默增强自噬并抑制细胞凋亡。之前研究衣霉素诱导Hepa1-6细胞内质网应激诱导的细胞凋亡和自噬过程中发现,CHOP基因沉默减缓了细胞凋亡,且shCHOP组的Hepa1-6自噬活性明显增强[14]。本研究中,CHOP基因沉默时,不仅细胞凋亡减轻,且细胞自噬活性增强,这表明CHOP在内质网应激诱导的细胞凋亡与自噬这两个复杂的生理过程中发挥着双重调节作用。而且基于细胞自噬发挥保护作用,笔者提出设想,即CHOP基因沉默时细胞凋亡减轻可能是因为自噬活性的增强,这是接下来研究中想要关注的重点。
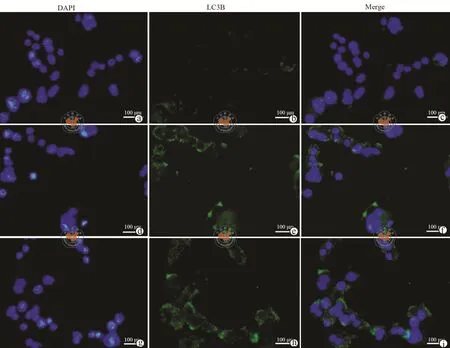
图7 荧光显微镜下检测细胞自噬分子LC3B的荧光强度(×200)
综上所述,本研究发现衣霉素诱导DU-145细胞内质网应激状态下,CHOP基因发挥双重调控作用,一方面促进细胞凋亡,另一方面抑制细胞自噬。
