尼罗罗非鱼主要组织相容性复合体Ⅱβ(MHC Ⅱ β)基因的克隆、表达和多态性*
2018-04-02何佳男罗文娜刘晓春林浩然
何佳男,罗文娜,刘晓春,林浩然
(有害生物控制与资源利用国家重点实验室∥中山大学生命科学学院,广东 广州 510275)
主要组织相容性复合体(major histocompatibility complex,MHC)是一系列位于染色体上与免疫功能密切相关的基因家族,具有高度多态性,编码产物是免疫系统中极为复杂的细胞表面膜蛋白。MHC编码的糖蛋白广泛分布于细胞表面,参与抗原递呈,直接参与病原入侵机体后的免疫应答和调控,维持机体自身的功能。根据结构和功能的不同,MHC基因编码的蛋白产物可以分为两类:MHCⅠ类分子和MHCⅡ类分子,哺乳动物中还存在MHCⅢ类分子。鱼类MHCⅠ类MHCⅡ类均与哺乳动物相似,都是由α链和β链组成的异二聚体。MHCⅠ类分子是由MHCⅠ类基因编码的重链(α链)和非MHCⅠ类基因编码,由位于不同染色体的β2微球蛋白基因编码的轻链(β链)以非共价键形成的二聚体,主要参与内源性抗原加工递呈途径。而MHCⅡ类分子的重链(α链)和轻链(β链)都是由MHCⅡ类基因编码,主要参与外源性抗原递呈[1]。
自1990年人们克隆出鲤鱼[2]的MHC基因部分序列以来,目前已对多种鱼类的MHC基因进行了研究[3-13]。越来越多的研究表明,MHC基因的多态性和物种对疾病的抗性或易感具有相关性[14-22]。在牙鲆经过鳗弧菌攻毒后进行MHCⅡβ基因多态性分析时,发现等位基因g和h只出现在抗病个体中,而等位基因l只出现在感病群体中[23]。在鲤鱼中,病毒感染后,Cyca-DAB1-like的等位基因E表现出更高的抗病性,等位基因B、H、J表现出更容易被病毒所感染[24]。在三刺鱼的研究中发现,MHCⅡβ基因型多的家族对寄生虫的抗病性更强[25]。这些研究结果说明了MHC作为候选抗病基因的合理性,为筛选抗病基因进行鱼类抗病育种奠定了基础。
尼罗罗非鱼Oreochromisniloticus隶属于硬骨鱼纲Osteichthyes、鲈形目Perciformes、鲈形亚目Percoidei、丽鱼科Cichlidae。具有生长速度,产量高,食性杂,需氧低,适应能力高,繁殖快,肉质好等特点。目前罗非鱼养殖在世界各国都有,已经成为全球主要养殖品种之一,而中国是世界上最大的罗非鱼养殖国家。近年来,罗非鱼链球菌病的暴发已成为制约罗非鱼产业发展的瓶颈。2009年,广东、福建、广西、海南等我们南方罗非鱼养殖的主要地区都受到了链球菌病的困扰,发病率在20%以上,死亡率达80%以上[26]。因此开展罗非鱼抗病相关基因的研究对于罗非鱼病害防治、抗病选育具有潜在的重要意义。
本研究对尼罗罗非鱼的MHCⅡβ基因进行了基因序列克隆,通过MHCⅡβ基因编码的氨基酸序列构建了尼罗罗非鱼、人、鼠和其他鱼类的系统进化树,并分析了MHCⅡβ基因在正常的罗非鱼组织表达模式,以及在被海豚链球菌感染后MHCⅡβ基因在头肾中表达量的变化情况。同时,我们还通过克隆开放读码框初步分析了MHCⅡβ基因的多态性,并通过PCR-SSCP技术初步分析了在细菌感染后在易感个体和抗病个体中MHCⅡβ基因的第2外显子的多态性,发现了罗非鱼至少存在的MHCⅡβ基因型和基因座的数量,为进一步探讨基因型多态性和抗病相关关系分析打下了基础。
1 材料与方法
1.1 实验材料
实验动物为尼罗罗非鱼Oreochromisniloticus,体长约20 cm,取自广东省罗非鱼良种场。实验室暂养1 周,确定健康无病后开始实验。取样时,冰上麻醉罗非鱼,取垂体、脑、鳃、心脏、脾脏、胃、肾脏、肌肉、皮肤、肠、肝脏、胸腺、头肾等组织放于液氮速冻,至于-80 ℃保存备用,用于MHCⅡβ基因组织分布研究。取样用的所有解剖器械和玻璃器皿均经180 ℃烘烤3 h,存放样品的1.5 mL进口离心管,灭活RNA酶。另取300条体长约为12 cm的尼罗罗非鱼用于海豚链球菌Streptococcusiniae感染实验。
1.2 细菌感染实验
海豚链球菌StreptococcusiniaeTBY-1由中山大学水生经济动物研究所李安兴教授实验室保种。通过预实验,确定正式实验的攻毒浓度为4.8×108cfu/mL。将300尾实验用鱼随机分为10个组,其中对照组2个,实验组8个,实验组每尾鱼腹腔注射100 μL菌液,对照组注射等体积的PBS。攻毒实验开始后的0,6,12,24,48,72,96和120 h取对照组和实验组鱼的头肾样品,对照组每个时间点取6尾,共计48尾,实验组每个时间点取7尾,共计49尾,用于MHCⅡβ基因表达变化研究。攻毒后取抗病个体和易感个体的尾鳍组织保存于酒精中备用。
1.3 DNA和总RNA的提取及cDNA模板的制备
鱼鳍DNA提取参照TIANGEN公司海洋动物组织基因组DNA提取试剂盒说明书,w=1%的琼脂糖凝胶电泳检测DNA质量。各组织总RNA提取方法参照Trizol®reagent (Invitrogen,USA)说明书,w=1%琼脂糖凝胶电泳检测RNA的完整性,分光光度计测定RNA浓度。取1 μg总RNA样品,使用反转录试剂盒ReverTra Ace-α-TMFirst Strand cDNA Synthesis Kit合成第一链cDNA,用于表达模式分析或5′- RACE和3′- RACE,AP (所有引物见表1)用于5′-RACE和3′-RACE,Oligo(dT) 用于表达模式分析,PCR反应程序为42 ℃ 20 min;99 ℃ 5 min;4 ℃ 5 min。

表1 MHC基因克隆和Real-time PCR反应引物组合Table 1 Primer pairs of combination used in cloning andReal-time PCR
1.4 罗非鱼MHC Ⅱ β cDNA全长及基因组序列扩增
以反转录产物为模板,根据基因库中其他鱼类的MHCⅡβ的相对保守序列,设计引物MHCⅡβ-partial-F和MHCⅡβ-partial-R扩增中间片段。反应条件为:94 ℃,5 min;94 ℃,30 s;55 ℃,30 s;72 ℃,1 min(39cycles);72 ℃,10 min,PCR产物4 ℃保存。根据已获得的cDNA中间序列,分别设计用于扩增3′端和 5′端的巢式引物。
以反转录产物为模版,采用3′端特异性引物MHCⅡβ-race-F1和AUAP为接头引物进行第一轮PCR,一轮产物稀释10~100倍,采用嵌套引物MHCⅡβ-race-F2,MHCⅡβ-race-F3和AUAP进行第二轮扩增。反应条件为:94 ℃,5 min;94 ℃,30 s;52 ℃,30 s;72 ℃,1 min(39cycles);72 ℃,10 min。PCR产物4℃保存。
以5′-RACE反转录产物为模版,采用5′端特异性引物MHCⅡβ-race-R1和AAP为接头引物进行第一轮PCR,将一轮产物稀释10~100倍,采用嵌套引物MHCⅡβ-race-R2、MHCⅡβ-race-R3和AUAP进行第二轮扩增。反应条件与3′端相同。
将中间片段、3′-RACE、5′-RACE序列片段进行拼接,根据拼接获得的罗非鱼MHCⅡβ基因cDNA序列,在其序列两端非编码区选取保守片断设计特异引物MHCⅡβ-full-F和MHCⅡβ-Intron3,4-R进行ORF验证,检验拼接所得cDNA全长序列。获得cDNA全长后通过和其他脊椎动物的MHCⅡβ基因组序列比对,利用3组特异性引物对MHCⅡβ-Intron1-F和MHCⅡβ-Intron1-R、MHCⅡ β-Intron2-F和MHCⅡβ- partial -R、MHCⅡβ-Intron3,4-F和MHCⅡβ-Intron3,4-R,分别从同一个罗非鱼个体的基因组中进行内含子的PCR扩增。
1.5 序列分析与进化树的构建
开放读码框由DNAtools 6.0软件预测并翻译成相应的氨基酸序列;核苷酸同源性比对由NCBI(http:∥www.ncbi.nlm.nih.gov)上的BLAST程序完成;蛋白序列的多重比对使用Clustal X 1.8软件;进化树由Mega 4.0 软件构建完成;利用http:∥www.expasy.ch/cgi-bin/pi_tool对蛋白质的等电点及相对分子质量等信息进行分析;利用http:∥www.cbs.dtu.dk/services/TMHMM/对跨膜区分析,利用SignalP 3.0(http:∥www.cbs.dtu.dk/services/SignalP/)进行信号肽预测,利用SMART(http:∥smart.embl-heidelberg.de/)预测该蛋白质的结构域。
1.6 MHC Ⅱβ基因的组织分布及感染后表达量的变化
Real-time PCR用到特异性引物见表1中的MHCⅡβ-Intron3,4-F和MHCⅡβ-Intron3,4-R,以18 s作为内参,参照SYBR®Green Real-time PCR Master Mix (TOYOBO, Japan)试剂盒说明书。反应程序为:首先95 ℃预变性60 s,然后 95 ℃变性15 s,55 ℃退火15 s,72 ℃延伸25 s,共40个循环。最后进行溶解曲线分析,以确定PCR产物质量。荧光定量PCR结束后,读取标准品及待测样品的CT 值,并由系统给出标准曲线的斜率,将罗非鱼不同组织中MHCⅡβ基因的表达量和18 S基因的表达量所对应的CT值与标准曲线相比照,即可得到该样品所测基因表达量的相对浓度值。所有数据用平均值±标准差(means±S.E.M.)来表示。采用SPSS 13.0 (SPSS,Chicago,IL,USA)软件来分析数据,用Duncan’s multiple range test来检验统计差异,当P<0.05时认为差异显著。
1.7 MHC Ⅱ β多态性初步分析
以对照组反转录的cDNA为模版,利用引物MHCⅡβ-full-F和MHCⅡβ-Intron3,4-R扩增ORF,一共选取了25尾罗非鱼50个阳性克隆进行测序,用于分析MHCⅡβ基因的多态性。反应条件为:94 ℃,5 min;94 ℃,30 s;55 ℃,30 s;72 ℃,1 min(39cycles);72 ℃,10 min,PCR产物4 ℃保存。
利用引物MHCⅡβ-sscp-F和MHCⅡβ-sscp-R对易感个体和抗性个体罗非鱼的基因组进行PCR扩增,将10 μL PCR产物和等体积的变性缓冲液混合均匀,55 ℃变性5 min,变性样品在220 V,w=10%的非变性聚丙烯酰胺凝胶电泳过夜,银染显色,目的片段溶于DNA洗脱缓冲液过夜,扩增目的片段进行PCR纯化测序。
测序获得的目的基因序列由DNAtools 6.0 软件预测并翻译成相应的氨基酸序列;蛋白序列多重比对使用Clustal X 1.8 软件;进化树由Mega 4.0 软件构建。
2 结 果
2.1 罗非鱼MHC Ⅱ β cDNA全长及基因组序列分析
本实验获得的尼罗罗非鱼MHCⅡβ中间片段长度为415 bp,3′片段长度约为760 bp,5′片段长度约为300 bp,将已测序的罗非鱼的MHCⅡβ中间片段,3′片段和5′片段序列根据重叠部分碱基序列进行拼接,获得了罗非鱼MHCⅡβ的全长cDNA为1 142 bp,其中,5′非编码区24 bp,开放读码框(open reading frame, ORF)750 bp,3′非编码区368 bp。经BLAST比对后,确认为尼罗罗非鱼MHCⅡβ基因序列。
利用3组特异性引物,分别从同一个罗非鱼个体的基因组中进行内含子的PCR扩增,得到5个外显子和4个内含子。其中外显子1编码前导肽,内含子1为227 bp,外显子2和外显子3编码β结构域,内含子2为280 bp,内含子3为90 bp,外显子4为跨膜区,存在保守的GXXGXXXGXXXXXXG框,内含子4为259 bp,外显子5编码胞内区和3′UTR,并且有一个脊椎动物典型的加尾信号AATAAA和41 bp的PolyA尾巴(图1)。
罗非鱼MHCⅡβ的开放读码框为750 bp,编码249个氨基酸。预测的蛋白质的相对分子质量为27 990,理论的等电点为6.38。经过SignalP3.0分析发现1-18号氨基酸为信号肽序列。
根据Kelin等[27]的命名规则将其编码的氨基酸序列命名为Orni-DAB*0101,Orni是根据罗非鱼的拉丁学名Oreochromisniloticus的头两位字母,D是指MHCclass Ⅱ,A指基因家族命名,B指β链。

图1 罗非鱼MHCⅡβ基因结构及其推导的氨基酸序列。起始密码子、终止密码子、mRNA加尾信号用阴影表示。跨膜区用横线标出。Fig.1 Genomicsequence of Nile tilapia MHCⅡβ gene.The starting codon, stop codon and the mRNA polyadenylation signal (AATAAA) are shaded.Transmembrane domain marked by a line
2.2 同源性及系统进化树分析
采用Clustal X 1.8软件对该氨基酸序列和其他鱼类、鼠和人的MHCⅡβ氨基酸序列进行比对,再用Mega 4.0软件进行序列同源性比对和构建系统进化树(基因登陆号见表2)。同源性分析显示(表3),其中罗非鱼和鲈形目的驼背非鲫、斜带石斑鱼、舌齿鲈、大黄鱼的同源性分别为78.6%、70.8%、70.5%、70.1%,和鳉形目青鳉的同源性为69.7%,和鲽形目圆斑星鲽、半滑舌鳎的同源性分别为65.1%、66.4%,和刺鱼目三刺鱼的同源性为66.1%,和鲤形目、鲑形目的同源性相对较低,和人及鼠的同源性仅为30.6%和32.5%。
根据罗非鱼和部分硬骨鱼、鼠及人的MHCⅡβ氨基酸序列构建的系统进化树分析表明(图2),罗非鱼的MHCⅡβ基因与鲈形目(驼背非鲫、石斑鱼、舌齿鲈、大黄鱼)的进化关系最近,与鳉形目(青鳉),刺鱼目(三刺鱼)、鲽形目(圆斑星鲽、半滑舌鳎)的进化关系相对于鲑形目(大西洋鲑、虹鳟)、鲤形目(斑马鱼、鲤鱼)而言,进化关系更近,与鼠和人的进化关系最远。

表 2 用于系统树建立和序列比对的MHC氨基酸序列Table 2 The MHC amino acid sequences using for alignment and construction of phylogenic tree

表 3 罗非鱼MHCⅡβ与其它物种MHCⅡβ同源性比较Table 3 Identities of MHCⅡβ between Nile tilapia and other species %
2.3 MHC Ⅱβ基因组织分布及感染后表达量变化分析
根据设计的特异性引物,通过Real-time PCR进行目的片段扩增,对罗非鱼MHCⅡβ基因在不同组织中的表达进行分析,以18S rDNA作为内参。结果显示(图3),在健康的罗非鱼各组织中,MHCⅡβ较强的表达于鳃、心脏、脾脏、胃,中度表达于脑、垂体、肾脏、肌肉等组织中,在皮肤、肠、肝脏、胸腺等组织中表达较弱。
人工感染海豚链球菌后,头肾组织中MHCⅡβ基因发生了变化。从图中可以看出(图4),MHCⅡβ基因的表达量从0~6 h呈现下降趋势,12 h显著性下降,从24~48 h呈现上升趋势,在48 h与对照组表达量基本持平,但是之后继续下降,72 h出现显著性下降,一直到96 h和120 h都表现出显著性下降。

图 2 基于MEGA4.0软件中的邻接法构建,罗非鱼MHCⅡβ基因与其他物种的进化树分析,检验自展值(bootstrap)为1 000Fig.2 Phylogenetic analysis of MHCⅡβ in Nile tilapiaand other vertebrates.Phylogenetic analysis was done using MEGA 4.0 by performing the Neighbor-Joining method with 1 000 bootstrap replicates

图3 罗非鱼MHCⅡβ基因的组织表达特异性Real-time PCR分析Fig.3 Real-time PCR analysis of MHCⅡβ expression in various tissues of Nile tilapia
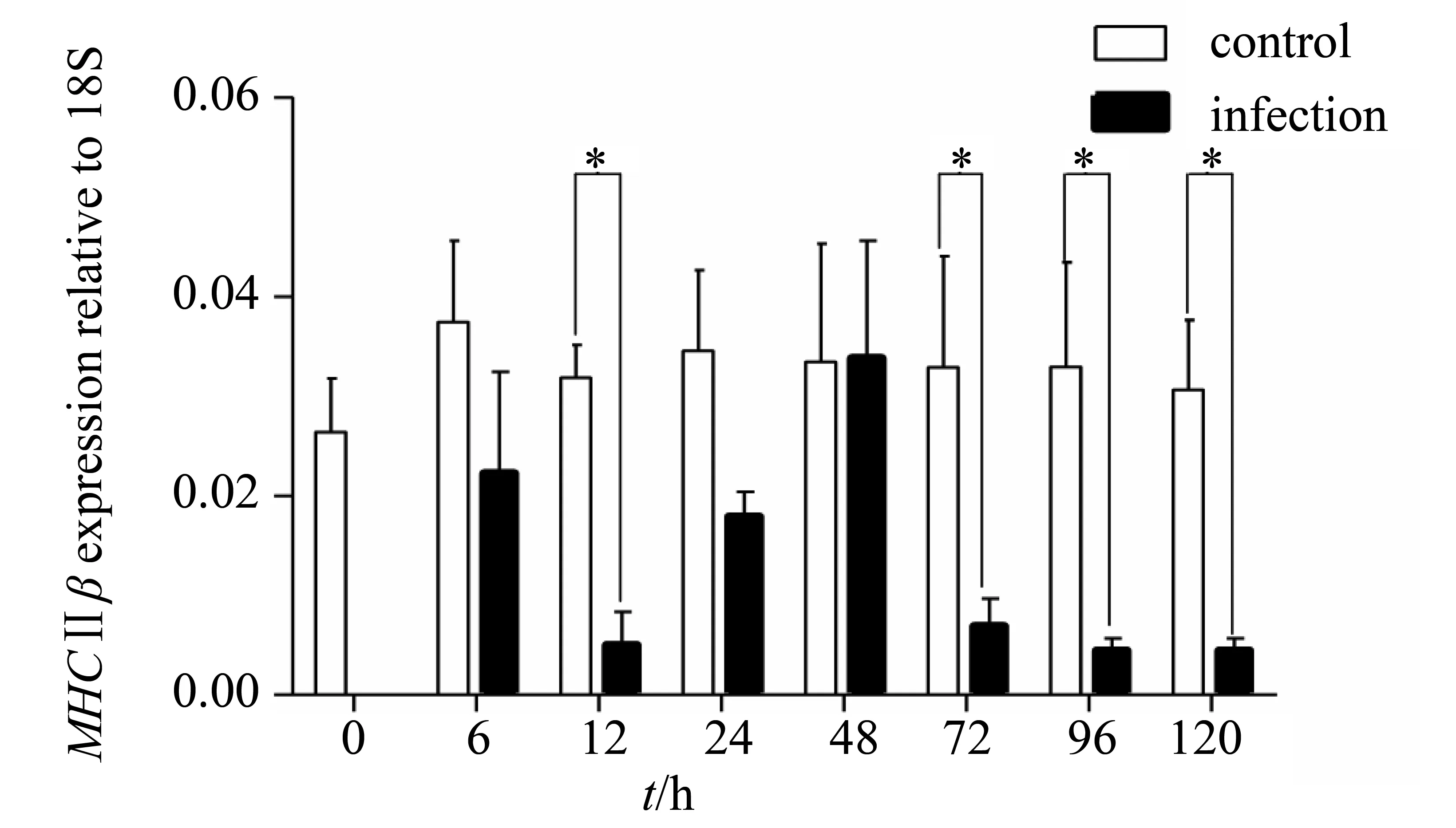
图4 攻毒后头肾组织MHCⅡβ基因表达量变化,*表示P<0.05Fig.4 Expression of MHCⅡβ in headkidney during challenging,*P<0.05
2.4 罗非鱼MHC Ⅱβ基因多态性初步分析
通过对25尾罗非鱼的开放读码框50个阳性克隆进行测序,结果显示(图5),有10种不同的MHCⅡβ核苷酸序列,分别编码10种不同的氨基酸序列,分别被命名为Orni-DAB0101、Orni-DAB0201、Orni-DAB0301、Orni-DAB0401、Orni-DAB0501、Orni-DAB0601、Orni-DAB0701、Orni-DAB0801、Orni-DAB0901、Orni-DAB1001。与其他9种氨基酸相比,Orni-DAB0601发现了4个氨基酸的增添。在开放读码框编码的249个氨基酸中,共出现104个多态位点,占编码的总氨基酸数的41.8%;第2外显子编码的氨基酸的多态点数为66个,占整个多态位点的63.5%。由此可见,罗非鱼的MHCⅡβ基因有丰富的多态性,而且在第2外显子上的多态性最高。
根据NJ法构建的10种氨基酸序列的系统进化树(图6),结果明显分为A和B两支(图6),分支A包括Orni-DAB0101、Orni-DAB0201、Orni-DAB0301、Orni-DAB0401、Orni-DAB0501、Orni-DAB0601、Orni-DAB0901,分支B包括Orni-DAB0701、Orni-DAB0801、Orni-DAB1001。同源性分析显示(表4),GroupA中,Orni-DAB0101和Orni-DAB0601,Orni-DAB0201,Orni-DAB0301,Orni-DAB0901,Orni-DAB0401,Orni-DAB0501的同源性分别为96.0%,98.8%,97.2%,83.3%,86.6%,80.2%,Group A中,序列之间的同源性比较高,而在Group B中,Orni-DAB0701和Orni-DAB0801,Orni-DAB1001的同源性为75.9%,78.3%,序列之间的同源性相对较低。

图5 罗非鱼MHCⅡβ基因的10种氨基酸序列比对Fig.5 Multiple alignments of MHCⅡβ amino acid sequences from Nile tilapia

表4 罗非鱼MHCⅡβ基因10种序列同源性比较Table 4 Identities of ten sequences of MHCⅡβ from Nile tilapia %
另外,通过全长验证引物从1尾罗非鱼中,扩增ORF,在选择的15个阳性克隆中,测序得到4个不同的序列,编码4种不同的氨基酸序列,这可能暗示着罗非鱼的MHCⅡβ基因可能至少存在2个不同的基因座(图7)。
利用引物MHCⅡβ-sscp-F和MHCⅡβ-sscp-R对易感个体和抗性个体罗非鱼的基因组进行PCR扩增,PCR产物55 ℃变性后进行SSCP电泳。出现2~12条不同的带型(图8),暗示存在至少3个基因座。通过对易感个体和抗病个体的PCR-SSCP产物回收测序,发现罗非鱼第2外显子存在较多的基因型,每个个体存在1~6个基因型,说明至少存在3个基因座(图9)。在易感个体和抗性个体出现了丰富的第2外显子基因型,为优化条件进一步筛选基因型提供了可能性。
3 讨 论
3.1 尼罗罗非鱼MHC Ⅱβ基因序列分析
MHC在适应性免疫过程中起着抗原递呈的作用,所以其在免疫系统中的作用十分重要。基因的克隆和序列分析是进行功能分析的基础工作。至今,多种鱼类的MHC基因已经被克隆和分析,包括牙鲆[12]、大菱鲆[13]、真鲷[28]、大西洋鲑[6]、鲤鱼[2]、虹鳟[3]等。本文克隆了尼罗罗非鱼MHCⅡβ基因的cDNA全长,获得了MHCⅡβ基因组序列,cDNA全长为1 142 bp,开放读码框为750 bp,编码249个氨基酸。基因组序列含有5个外显子和4个内含子,但是内含子的大小有明显不同。外显子和内含子的数目和半滑舌鳎[29]、大菱鲆[13]、牙鲆[12]一样,并且跨膜区含有GXXGXXXGXXXXXXG框,有学者研究表明该框和αβ二聚体的形成有关[30]。PANG等[31]研究发现尼罗罗非鱼的MHCⅡβcDNA 序列全长为1 119 bp,开放读码框为750 bp,也是编码249个氨基酸。但是含有6个外显子和5个内含子,与本文的主要差异在β2结构域是由2个外显子编码,中间被一个内含子隔离。这可能是因为两者使用的尼罗罗非鱼来源不同所致,也可能是因为尼罗罗非鱼MHCⅡβ多态性较丰富,导致了基因组序列的差异。
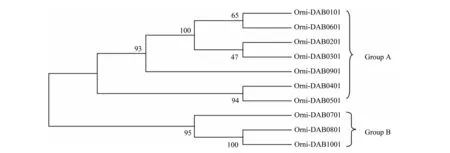
图6 基于MEGA4.0软件中的NJ方法,罗非鱼MHCⅡβ基因10种序列构建的进化树,检验自展值(bootstrap)为1 000Fig.6 Phylogenetic analysisof ten sequences MHCⅡβ in Nile tilapia.Phylogenetic analysis was done using MEGA 4.0 by performing the Neighbor-Joining method with 1 000 bootstrap replicates

图7 同一个体MHCⅡβ基因的氨基酸序列比对Fig.7 Multiple alignments of MHCⅡβ amino acid sequences in one individual

图8 罗非鱼第二外显子PCR-SSCP电泳图(数字代表条带数目)Fig.8 PCR-SSCP analysis of exon2 in different individuals(Figures represented the number of bands)

图9 同一个体MHCⅡβ基因的第2外显子编码的氨基酸序列比对Fig.9 Multiple alignments of amino acid sequence encoded by exon 2 in one individual
通过对尼罗罗非鱼MHCⅡβ基因的氨基酸与其他鱼类及人和鼠的进行系统进化树分析,罗非鱼的MHCⅡβ基因和鲈形目的MHCⅡβ基因同源性都在70%以上,和鳉形目、鲽形目、刺鱼形的同源性低于鲈形目,和哺乳动物如人和鼠的同源性最低。从进化树的总体来看,鱼类的MHCⅡβ基因聚类,哺乳类的MHCⅡβ基因聚类,罗非鱼和鲈形目鱼类的进化关系最近,和哺乳动物的进化关系最远,这个结果与罗非鱼的分类地位相一致。
3.2 MHC Ⅱ β基因组织表达分析
利用Real-time PCR技术,对健康尼罗罗非鱼组织中的MHCⅡβ基因的表达量进行了分析。结果发现,在罗非鱼中,鳃、心脏、脾脏、胃等组织中较强表达MHCⅡβ基因,皮肤、肝脏等组织表达最弱,脑、垂体等中度表达,这和在真鲷、牙鲆表达有相似的地方。真鲷[28]正常组织中,MHCⅡβ基因较强表达于鳃、脾脏、头肾、胃、小肠等组织中,肌肉中的表达最弱;牙鲆[12]中MHCⅡβ基因广泛表达于各个组织中,鳃、脾、头肾表达量较高,小肠较低。从中我们可以看出来,脾脏在很多鱼类中都较高表达MHCⅡβ基因,这可能是和脾脏是重要的免疫器官有关。另外,鱼的鳃组织中MHCⅡβ基因的表达量也比较高,这可能和鳃是黏膜免疫系统的重要组成部分,含有丰富的淋巴细胞有关[32]。当然,不同的种鱼MHCⅡβ基因的表达有着自身的特点。
人工感染海豚链球菌后,检测了MHCⅡβ基因在尼罗罗非鱼头肾中的表达变化。与对照组相比,整体呈现下降-上升-下降的变化趋势。从0~6 h,MHCⅡβ基因的表达量呈现下降趋势,12 h表达量显著下降,之后从24~48 h该基因表达量呈现上升趋势,在48 h表达量与对照组基本持平,但是之后继续下降,72 h出现显著性下降,一直到96 h和120 h都表现出显著性下降。鳗弧菌感染后,真鲷[28]的肝脏、脾脏、头肾肠等组织的MHCⅡβ基因表达量变化从5 h到72 h呈现下降趋势。在HINV病毒感染72 h后,虹鳟[33]脾脏和前肾的MHCⅡβ基因表达量发生了下降,192 h后逐渐恢复。大菱鲆[13]感染鳗弧菌后肝和肾组织中MHCⅡβ的表达量在24~48 h内出现下调,之后开始上升。本文的实验结果与前人的研究既有相似之处也有不同,MHCⅡβ基因的表达量发生了下调,但是最终未恢复到正常水平。这一方面可能是因为本文采用了高致死量对鱼类进行了攻毒,使免疫系统造成了一定的破坏,另一方面也有可能是与取样时间有关。至于MHCⅡβ基因在鱼体内发挥免疫功能的机理以及病原感染后MHCⅡβ基因表达量的变化都受哪些因素的影响等等这些问题,还有待于进一步研究。
3.3 MHC Ⅱ β基因多态性初步分析
鱼类MHC基因的多态性在种内和和种间都存在。本文通过25尾罗非鱼的50个ORF阳性克隆对MHC基因的多态性进行了初步分析,共获得10个MHCⅡβ等位基因,通过对它们编码的氨基酸进行比对和构建的系统进化树进行分析,发现MHCⅡβ基因的多态性主要集中在第2外显子上,在104个多态位点中,66个出现在第2外显子上。MHCⅡβ基因多态性在其他鱼类中也广泛存在,在长江草鱼[34]的3个群体的MHCⅡβ基因的克隆及测序分析中,共发现了34个等位基因。张玉喜等[12]从84尾牙鲆共411个克隆中得到了13个等位基因。
同时,从一个个体的ORF阳性克隆中共获得4条不同的核苷酸序列,分别编码不同的氨基酸,暗示着罗非鱼至少存在2个MHCⅡβ基因的座位。接下来的PCR-SSCP电泳结果显示了类似的结果,从银染后的结果可以看出,每个个体出现2~12条不同的带型,说明存在1到6个不同的等位基因,也说明了在罗非鱼中至少存在3个MHCⅡβ基因座。这个结果与Zhou等[35]在尼罗罗非鱼中得到的结果一致。而学者利用PCR-SSCP检测赤点石斑鱼各组织的多态性研究中,结果发现MHCⅡβ基因在各组织的表达都具有丰富的多态性,在心脏表达等位基因的数量最少,但依旧有8个等位基因[36]。同时MHC基因的多态性和物种对疾病的抗性或易感具有相关性[14-22],从这些实验结果可以看出,鱼类MHCⅡβ基因的这种高度的多态性为其作为抗病基因筛选提供了理论上的可能性。
国内学者陈松林等[37]在牙鲆的抗病基因筛选过程中,首先通过自然选择和人工选择筛选抗病的牙鲆鱼苗和苗种,牙鲆性成熟后与日本引进的有遗传多样性的牙鲆进行牙鲆家系建立,建立半同胞家系和全同胞家系63个,对不同家系进行鳗弧菌的感染实验,筛选出抗病家系和易感家系。这种家系选育和抗病选育相结合的方法更有利于筛选抗病基因。国外学者对大西洋鲑的研究也是采用家系选育和抗病基因相结合的方法。在大西洋鲑对细菌感染和病毒感染的抗病基因筛选中,先对50个家系进行细菌和病毒的感染实验,筛选出易感家系和抗病家系,结合MHC基因型的筛选,成功的筛选出抗病基因型,再进行F2带家系进行抗病家系和易感家系选育[21,38]。
而本文尝试着从易感个体和抗病个体MHCⅡβ基因的第2外显子分析中筛选出抗病基因,结果不尽人意。不过罗非鱼的个体存在1~6个不同的等位基因,说明了易感群体和抗病群体存在丰富的基因型。这可能是因为实验用鱼的遗传背景比较复杂,因此下一步需要从全同胞家系或者是半同胞家系的样品中进行分析。在以后的实验过程中应该根据前人的经验,结合家系选育和抗病基因筛选进行抗病育种工作。
参考文献:
[1]NIKOLICHZUGICH J,FREMONT D H, MILEY M J, et al. The role of mhc polymorphism in anti-microbial resistance[J].Microbes & Infection,2004,6(5):501-512.
[2]HASHIMOTO K, NAKANISHI T, KUROSAWA Y. Isolation of carp genes encoding major histocompatibility complex antigens[J]. Proceedings of the National Academy of Sciences of the United States of America, 1990, 87(17):6863-6867.
[3]GLAMANN J. Complete coding sequence of rainbow troutMHCⅡβchain[J].Scandinavian Journal of Immunology, 1995, 41(4):365-372.
[4]van ERP SHM,EGBERS E,STET R J.Characterization of class Ⅱ A and B genes in a Gynogeneticcarpclone [J]. Immunogenetics, 1996,44(3):192-202.
[5]SULMANNH,MAYERW,FIGUEROAF, et al. Organization of Mhc classⅡB genes in the zebrafish[J].Genomics,1994,23(1):1-14.
[6]GRIMHOLT U, OLSAKER I, LINDSTRØM C D V, et al. A study of variability in the MHC class Ⅱβ 1 and class I α 2 domain exons of Atlantic salmon,Salmosalar[J]. Animal Genetics, 1994, 25(3):147-153.
[7]WALKERRB,MCCONNELLTJ,WALKERRA.Variabilityinall MHC mosa classⅡbetachain-encoding gene in stripedbass(Moronesaxatilis)[J].Dev Comp Immunol,1994,l8(4):325-342.
[8]KRUISWIJK C P, HERMSEN T T, WESTPHAL A H,et al. A novel functional class I lineage in zebrafish (Daniorerio), carp (Cyprinuscarpio), and large barbus (Barbusintermedius) showing an unusual conservation of the peptide binding domains [J]. Journal of Immunology, 2002, 169(4): 1936-1947.
[9]夏春. 白鲢MHC Iα2基因克隆及序列分析[J]. 动物学报, 1999, 45(3): 345-349.
XIA C . Molecular cloning and sequence analysis of MHC class I α 2 domain from silvercarp(Hypophthalmichthysmolitrix)[J].Current Zoology, 1999, 45(3): 345-349.
[10]蔡完其, 轩兴荣, 王成辉,等. 红鲤4群体间主要组织相容性复合体的差异[J]. 水产学报, 2003, 27(2): 113-118.
CAI W Q, XUAN X R, WANG C H,et al.The variations of major histocompatibility complex in four populations of red common carp [J]. Journal of Fisheries of China, 2003, 27(2): 113-118.
[11]XU T J, CHEN S L, JI X S, et al. MHC polymorphism and disease resistance toVibrioanguillarumin 12 selective Japanese flounder (Paralichthysolivaceus) families [J]. Fish & Shellfish Immunology, 2008, 25(3):213-221.
[12]ZHANG Y X, CHEN S L, LIU Y G, et al. Major histocompatibility complex class ⅡB allele polymorphism and its association with resistance/susceptibility toVibrioanguillaruminJapanese flounder (Paralichthysolivaceus) [J]. Marine Biotechnology, 2006, 8(6):600-610.
[13]ZHANG Y X, CHEN S L. Molecular identification, polymorphism, and expression analysis of major histocompatibility complex class ⅡA and B genes of turbot (Scophthalmusmaximus)[J]. Marine Biotechnology, 2006, 8(6): 611-623.
[14]HILL A V, ALLSOPP C E, KWIATKOWSKI D, et al. Common West African HLA antigens are associated with protection from severe malaria[J]. Nature, 1991, 352(6336):595-600.
[15]MEDINA E, NORTH R J. Resistance ranking of some common inbred mouse strains toMycobacteriumtuberculosisand relationship to major histocompatibility complex haplotype and Nramp1 genotype [J]. Immunology, 1998, 93(2): 270-274.
[16]XU R, LI K, CHEN G, et al. Characterization of genetic Polymorphism of novel MHC B-LBⅡalleles inChineseindigenouschickens[J]. Acta Genetica Sinica, 2007, 34(2):109-118.
[17]LANGEFORS A, LOHM J, GRAHN M, et al. Association between major histocompatibility complex class ⅡB alleles and resistance toAeromonassalmonicidain Atlantic salmon [J]. Proceedings of the Royal Society B Biological Sciences, 2001, 268(1466):479-485.
[18]RAKUS K L,WIEGERTJES G F, JURECKA P,et al. Major histocompatibility (MH) class Ⅱ B gene polymorphism influences disease resistance of common carp (CyprinuscarpioL.) [J].Aquaculture, 2009, 288(1-2):44-50.
[19]HARSTAD H, LUKACS M F, BAKKE H G, et al. Multiple expressed MHC class Ⅱ loci in salmonids; details of one non-classical region in Atlantic salmon (Salmosalar) [J]. BMC Genomics, 2008, 9(1): 1-16.
[20]PALTI Y, NICHOLS K M, WALLER K I, et al. Association between DNA polymorphisms tightly linked to MHC class Ⅱ genes and IHN virus resistance in backcrosses of rainbow and cutthroat trout [J]. Aquaculture, 2001, 194(3):283-289.
[21]KJØGLUM S, LARSEN S, BAKKE H G, et al. How specific MHC class I and class Ⅱ combinations affect disease resistance against infectious salmon anaemia in Atlantic salmon (Salmosalar) [J]. Fish & Shellfish Immunology, 2006, 21(4):431-441.
[22]STET R J, VRIES B D, MUDDE K, et al. Unique haplotypes of co-segregating major histocompatibility class Ⅱ A, and class Ⅱ B, alleles in Atlantic salmon (Salmosalar) give rise to diverse class Ⅱ genotypes[J]. Immunogenetics, 2002, 54(5): 320-331.
[23]张玉喜, 陈松林. 牙鲆MHC class ⅡB基因多态性及其与鱼体抗病力关系的分析[J]. 水产学报, 2006, 30(5): 633-639.
ZHANG Y X, CHEN S L. Major histocompatibility complex class ⅡB allele polymorphismand its association with resistance/susceptibility toVibrioanguillarumin Japanese flounderParalichthysolivaceus[J]. Journal of Fisheries of China, 2006, 30(5): 633-639.
[24]RAKUS K L, WIEGERTJES G F, ADAMEK M, et al. Resistance of common carp (CyprinuscarpioL.) to Cyprinid herpesvirus-3 is influenced by major histocompatibility (MH) class Ⅱ B gene polymorphism [J]. Fish & Shellfish Immunology, 2009, 26(5):737-743.
[25]WEGNER K M, KALBE M, MILINSKI M, et al. Mortality selection during the 2003 European heat wave in three-spined sticklebacks: effects of parasites and MHC genotype[J]. BMC Evolutionary Biology, 2008, 8(1): 1-12.
[26]杨弘. 中国罗非鱼产业发展趋势与建议[J]. 海洋与渔业·水产前沿, 2011(5): 33-34.
YANG H. Development trend and suggestion of tilapia industry in China [J]. Ocean and Fishery, 2011(5): 33-34.
[27]KLEIN J, BONTROP R E, DAWKINS R L, et al. Nomenclaturefor the major histocompatibilitycomplexes of differentspecies: aproposal[J]. Immunogenetics, 1990, 31(4):217-219.
[28]CHEN S L, ZHANG Y X, XU M Y, et al. Molecular polymorphism and expression analysis of MHC class Ⅱ B gene from red sea bream (Chrysophrysmajor)[J]. Developmental & Comparative Immunology, 2006, 30(4):407-418.
[29]XU T J, CHEN S L, JI X S, et al. Molecular cloning, genomic structure, polymorphism and expression analysis of major histocompatibility complex class ⅡA and ⅡB genes of half-smooth tongue sole (Cynoglossussemilaevis) [J]. Fish & Shellfish Immunology, 2009, 27(2): 192-201.
[30]COSSON P, BONIFACINO J S. Role of transmembrane domain interactions in the assembly of class Ⅱ MHC molecules[J]. Science, 1992, 258(5082):659-662.
[31]PANG J C, GAO F Y, LU M X, et al. Major histocompatibility complex class ⅡA and ⅡB genes of Nile tilapia (Oreochromisniloticus): genomic structure, molecular polymorphism and expression patterns[J]. Fish & Shellfish Immunology, 2013, 34(2):486-496.
[32]罗晓春, 谢明权, 黄玮,等. 鱼类粘膜免疫研究进展[J]. 水产学报, 2005, 29(3): 411-416.
LUO X C,XIE M Q,HUANG W, et al.Review of fish mucosal immunity research[J]. Journal of Fisheries of China, 2005, 29(3): 411-416.
[33]HANSEN J D, LA P S. Induction of the rainbow trout MHC class I pathway during acute IHNV infection[J]. Immunogenetics, 2002, 54(9):654-661.
[34]张燕. 长江草鱼群体MHC ClassⅡB基因的克隆、表达及多态性分析[D]. 武汉:华中农业大学,2010.
ZHANG Y. The cloning, expression and polymorphism of MHC class Ⅱ B gene of Grass carp (Ctenopharyngodonidella) populations of Yangtze River[D]. Wuhan: Huazhong Agricultural University, 2010.
[35]ZHOU F N, DONG Z D, FU Y, et al. Molecular cloning, genomic structure, polymorphism and expression analysis of major histocompatibility complex class Ⅱ B gene of Nile tilapia (Oreochromisniloticus)[J]. Aquaculture, 2013, 372-375:149-157.
[36]丁少雄,张之文,杜佳莹,等. 赤点石斑鱼(Epinephelusakaara)MHC Ⅱ B基因的克隆与表达多态性分析[J]. 海洋学报(中文版), 2009, 31(2): 129-138.
DING S X,ZHANG Z W,DU J Y, et al. The cloning and polymorphism of MHC class ⅡB genefromEpinephelusakaara[J]. Acta Oceanologica Sinica, 2009, 31(2): 129-138.
[37]陈松林,田永胜, 徐田军,等. 牙鲆抗病群体和家系的建立及其生长和抗病性能初步测定[J]. 水产学报, 2008, 32(5): 665-673.
CHEN S L,TIAN Y S,XU T J, et al.Development and characterization for growth rate and disease resistance of disease-resistance population and family in Japanese flounder(Paralichthysolivaceus)[J]. Journal of Fisheries of China, 2008, 32(5): 665-673.
[38]GRIMHOLT U, LARSEN S, NORDMO R, et al. MHC polymorphism and disease resistance in Atlantic salmon (Salmosalar); facing pathogens with single expressed major histocompatibility class I and class Ⅱ loci [J]. Immunogenetics, 2003, 55(4):210-219.
