硬粒小麦染色体的FISH核型分析
2018-03-31,,,,,,,2,,2
, , , , ,, ,2, ,2
(1.贵州大学农学院, 贵阳 550025; 2.国家小麦改良中心贵州分中心, 贵州 贵阳 550025)
硬粒小麦(TriticumDurum,AABB,2 n=28)是世界重要的粮食作物之一,最早在美国和意大利种植较多,后来传播到北非、中东、欧洲等地并逐步扩散到世界各地。如今硬粒小麦播种面积约占世界小麦总面积的十分之一,仅次于普通小麦,居栽培小麦的第二位。硬粒小麦是一种四倍体栽培小麦[1],其籽粒蛋白质及面筋含量都较普通小麦高,面筋较普通小麦硬,不能拉长,适合生产琥珀色、耐煮、光滑可口的通心粉,用硬粒小麦做的面条耐煮且有韧劲,因此又叫通心粉小麦。硬粒小麦还可以与普通小麦搭配磨粉来生产优质面包和其它面食品。硬粒小麦是六倍体普通小麦的初级基因库,含有丰富的抗性基因,对条锈、叶锈、散黑穗病和腥黑穗病等病具有较好的抗性,具有较高的育种价值[2-3]。
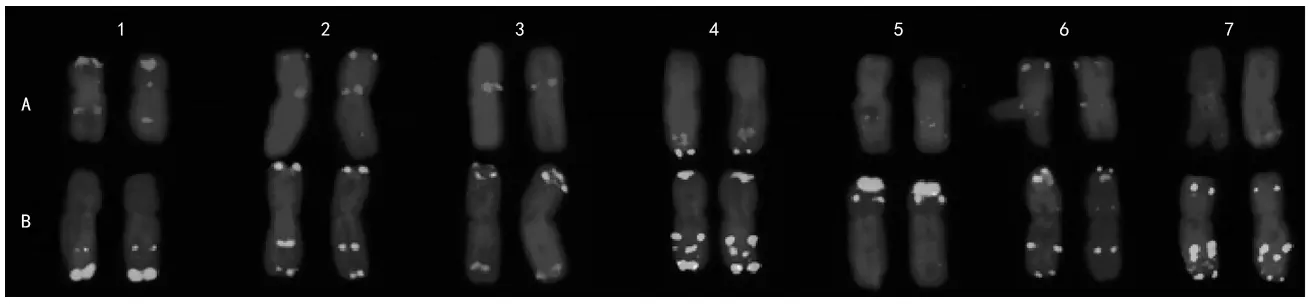
图2 硬粒小麦(Sauwne 20) 的A和B基因组的FISH核型
DNA重复序列可以用于染色体辨别、基因组组成及进化分析,外源遗传物质检测等多项研究。Mukai等[4]以高度重复序列pSc 119.2和pAs 1为探针识别了B组和D组所有染色体以及小麦的1 A、4 A和5 A 染色体,并创立了中国春小麦的B基因组和D基因组染色体核型模式图。Pedersen等[5]成功地使用pAsI和pHvG 38两个重复序列探针识别了小麦所有的21对染色体。 Cuadrado和Jouve[6]在黑麦染色体制片上用pTa 71、pTa 794、pSc 34、pSc 74和pSc 119.2重复序列探针进行了3次荧光原位杂交,从而识别了黑麦的全部染色体。目前,对硬粒小麦的FISH核型方面的研究鲜见报道。本研究拟对硬粒小麦染色体进行双色FISH分析,以期了解硬粒小麦染色体的FISH特点,建立其FISH核型,为硬粒小麦在小麦遗传育种上的利用和深入研究提供参考。
1 材料与方法
1.1 材 料
试验材料为从意大利引入的硬粒小麦品种Sauwne 20,该品种具有矮杆、千粒重大、白粒、全玻璃质等特点,并且对条、叶、秆锈病和白粉病等病表现高抗至免疫[7],是小麦白粉病抗性的鉴别寄主。
1.2 染色体制片
将种子置于铺有湿润滤纸的培养皿中于常温下发芽,待根长至2 cm左右时,剪取根尖用N2O处理2 h,在90%冰醋酸中固定10 min,用蒸馏水冲洗3遍后切取根尖分生区,酶解滴片,在OLMPUS BX 60显微镜下镜检,选取分裂相好的片子保存于-20 ℃冰箱备用。
1.3 荧光原位杂交分析
FISH技术参见Han等[8]方法。选择FISH效果好的细胞用Cellsens Standard摄像系统照相。选取5个分裂相好且染色清晰的细胞用于FISH核型分析,以得到准确可靠的数据。
2 结果与分析
以Oligo-pTa 535-2(红色)和Oligo-pSc 119.2-1(绿色)重复序列为探针对硬粒小麦Sauwne 20根尖细胞染色体进行双色FISH分析(图1),结果发现,Sauwne 20包括14对染色体,其染色体上的Oligo-pTa 535-2红色信号相对较弱且少,而Oligo-pSc 119.2-1绿色信号较强且丰富。
Sauwne 20的1 A染色体短臂端部和长臂中间分别具有Oligo-pTa 535-2信号(图2)。2 A染色体短臂端部及近着丝点处分别有明亮的Oligo-pTa 535-2信号。3 A染色体着丝点处有明亮的Oligo-pTa 535-2信号。4 A染色体长臂近端部有Oligo-pTa 535-2信号, 长臂端部有Oligo-pSc 119.2-1绿色信号。5 A染色体长臂中间存在2对弱的Oligo-pTa 535-2信号。6 A染色体短臂端部和近着丝点处分别有Oligo-pTa 535-2信号。7 A染色体长臂近端部和近着丝点处分别有微弱的Oligo-pTa 535-2信号。
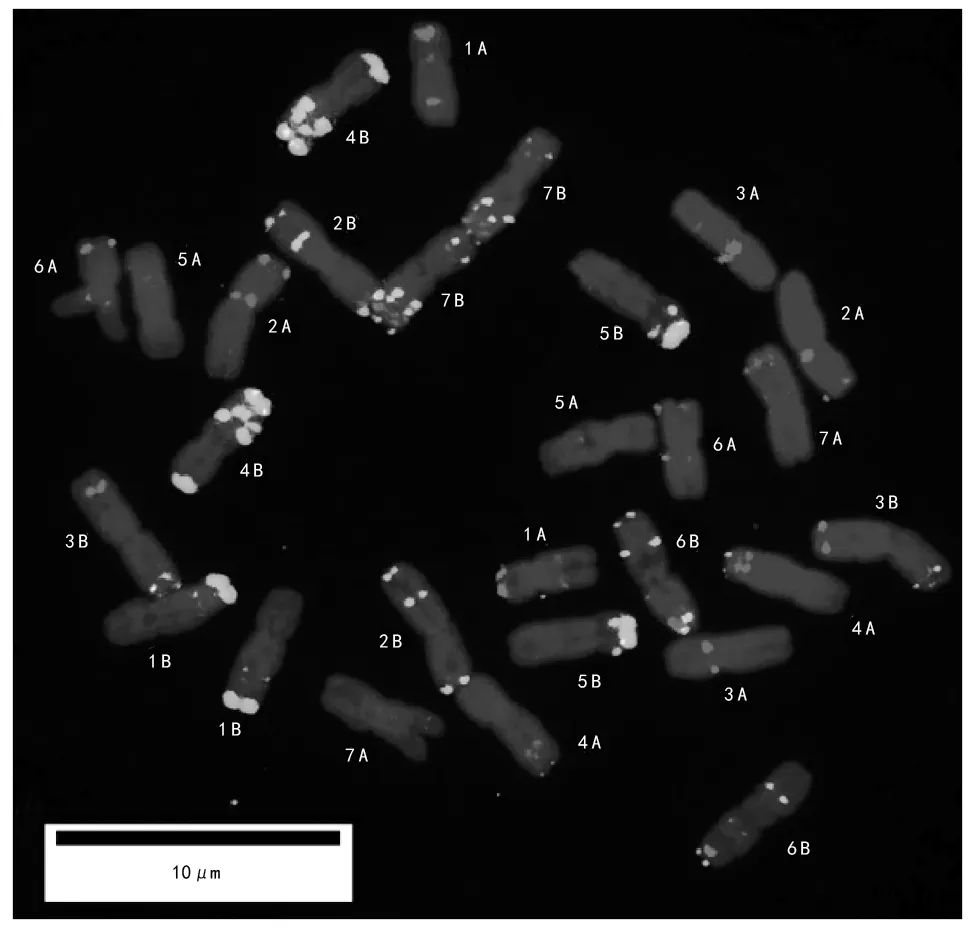
注:Oligo-pTa 535-2探针为红色,Oligo-pSc 119.2-1探针为绿色,背景染色体由DAPI复染为蓝色;比例尺为10 μm。下同。图1 硬粒小麦(Sauwne 20)根尖细胞染色体的FISH核型
Sauwne 20在1 B染色体长臂端部和中间分别有Oligo-pSc 119.2-1信号。2 B染色体长臂、短臂端部及长臂中间分别有Oligo-pSc 119.2-1信号。3 B染色体短臂端部有Oligo-pSc 119.2-1和Oligo-pTa 535-2两种信号,长臂端部有Oligo-pTa 535-2信号。4 B染色体上具有较丰富的Oligo-pSc 119.2-1信号,在短臂端部、长臂中间与端部分别具有较强的Oligo-pSc 119.2-1信号。5 B染色体短臂端部和近端部有较强的Oligo-pSc 119.2-1信号。6 B染色体长臂和短臂端部及长臂中间分别具有Oligo-pSc 119.2-1信号;短臂端部及中间分别有Oligo-pTa 535-2信号。7 B染色体在短臂近端处和长臂端部、中间分别有明显的Oligo-pSc 119.2-1信号;长、短臂近端处分别有Oligo-pTa 535-2信号。
硬粒小麦Sauwne 20与Tang等[9]报道的中国春普通小麦的A组和B组染色体的FISH核型基本相似,但又有一定的差别。Sauwne 20的1 B和4 B染色体长臂近端处比中国春小麦多1对Oligo-pTa 535-2信号。Sauwne 20的3 B染色体短臂近端处比中国春小麦多1对Oligo-pTa 535-2信号。Sauwne 20的6 B染色体短臂近端处比中国春小麦多1对Oligo-pSc 119.2-1信号信号。Sauwne 20的7 B染色体长臂端部和近端处分别比中国春小麦多1对Oligo-pSc 119.2-1和Oligo-pTa 535-2信号。
3 讨 论
建立植物的FISH核型对研究植物分类和进化具有重要的意义[10-11]。董磊等[12]对拟斯卑尔脱山羊草材料进行了FISH分析,发现Oligo-pTa 535信号主要分布在小麦的A组和D组染色体上,Oligo-pSc 119.2信号主要分布在小麦的B组染色体上,不同来源的拟斯卑尔脱山羊草与小麦B染色体组的FISH核型存在明显差异;认为拟斯卑尔脱山羊草染色体上含有丰富的与pSc 119.2高度同源的重复序列,分布上具有遗传多样性。葛群等[13]利用普通小麦品种绵阳11作母本,抗病的威宁黑麦(ScealecerealeL.)作父本,在其杂交和回交后代中分别鉴定出一个1 R和5 R单体附加系;研究发现黑麦染色体1 R和5 R单体附加系可以诱导小麦染色体变异。罗巧玲等[14]分析了390份小麦-黑麦种质材料,指出3份六倍体小黑麦与2份八倍体小黑麦所含的黑麦染色体不完全相同;八倍体小黑麦中有1对来源于黑麦的小染色体,而六倍体小黑麦中没有类似小染色体。Tang等[15]以Oligo-pTa 535-1和Oligo-pSc 119.2-1为探针进行FISH分析,并结合GISH技术对小黑麦衍生种的染色体结构变异进行了分析。刘成等[16]利用Oligo-pTa 535-1、Oligo-pSc 119.2-1和(GAA)8探针对智利大麦进行FISH分析,有效辨别了智利大麦的每一条染色体。Linc等[17]则以重复序列pSc 119.2和Afa family为探针将二倍体长穗偃麦草的7对染色体全部区分,建立了二倍体长穗偃麦草的FISH核型,并对其附加系进行了鉴定。
本研究利用双色FISH技术可在染色体水平上准确辨别硬粒小麦Sauwne 20的每一染色体,并建立Sauwne 20的FISH核型。Sauwne 20染色体上的Oligo-pTa 535-2红色信号相对较弱且少,而Oligo-pSc 119.2-1绿色信号较强且丰富。Sauwne 20的FISH核型与Tang等[9]报道的中国春小麦A和B组染色体的FISH核型相似,但又有一定的差别;其差异可能是由于试验材料不同,不同小麦材料间DNA重复序列具有遗传多样性。Sauwne 20染色体结构变异可能是该材料形成过程中,染色体发生重复、倒位、易位、缺失等现象而导致染色体重复序列的变化,从而形成FISH信号的多样性[18]。
参考文献:
[1]张正斌.小麦遗传学[M].北京:中国农业出版社,2001.
[2]Ma H,Singh R P,Abdalla O.Resistance to stripe rust in five durum wheat cultivars[J].Plant disease,1997,81(1):27-30.
[3]Kema G H J,Lange W,Van Silfhout C H.Differential suppression of stripe rust resistance in synthetic wheat hexaploids derived fromTriticumturgidumsubsp.dicoccoides andAegilopssquarrosa[J].Phytopathology,1995,85(4):425-429.
[4]Mukai Y,Nakahara Y,Yamamoto M.Simultaneous discrimination of the three genomes in hexaploid wheat by multicolor fluorescence in situ hybridization using total genomic and highly repeated DNA probes[J].Genome,1993,36(3):489.
[5]Pedersen C,Langridge P.Identification of the entire chromosome complement of bread wheat by two-colour FISH [J].Genome,1997,40(5):589-593.
[6]Cuadrado A,Jouve N.Mapping and organization of highly-repeated DNA sequences by means of simultaneous and sequential FISH and C-banding in 6 x Triticale[J].Chromosome Research,1994,2(4):331-338.
[7]张庆勤.普通小麦与硬粒小麦杂交研究[J].种子,1988,7(1):9-12.
[8]Han F P,Lamb J C,Birchler J A,High frequency of centromere inactivation resulting in stable dicentric chromosomes of maize[J].Proc Natl Acad Sci USA,2006,103:3 238-3 243.
[9]Tang Z,Yang Z,Fu S.Oligonucleotides replacing the roles of repetitive sequences pAs 1,pSc 119.2,pTa-535,pTa 71,CCS 1,and pAWRC.1 for FISH analysis[J].Journal of Applied Genetics,2014,55(3):313-318.
[10]Badaeva E D,Amosova A V,Muravenko O V,et al.Genome differentiation inAegilops.3.Evolution of the D-genome cluster[J].Plant Systematics and Evolution,2002,231(1):163-190.
[11]Badaeva E D,Amosova A V,Samatadze T E,et al.Genome differentiation inAegilops.4.Evolution of the U-genome cluster[J].Plant Systematics and Evolution,2004,246(1):45-76.
[12]董磊,董晴,张文利,等.拟斯卑尔脱山羊草的FISH核型分析[J].中国农业科学,2017,50(8):1 378-1 387.
[13]葛群,杨漫宇,晏本菊,等.黑麦染色体1R和5R单体附加诱导的小麦和黑麦染色体的变异和易位[J].麦类作物学报,2014,34(5):603-608.
[14]罗巧玲,郑琪,许云峰,等.390份小麦-黑麦种质材料主要农艺性状分析及优异材料的GISH与FISH鉴定[J].作物学报,2014(8):1 331-1 339.
[15]Tang Z,Li M,Chen L,et al.New types of wheat chromosomal structural variations in derivatives of wheat-rye hybrids[J].Plos One,2013,9(10):e 110 282.
[16]刘成,宫文英,李豪圣,等.智利大麦染色体的荧光原位杂交分析[J].山东农业科学,2015(5):10-14.
[17]Linc G,Sepsi A,Molnár-Láng M.A FISH karyotype to study chromosome polymorphisms for theElytrigiaelongataE genome[J].Cytogenetic & Genome Research,2012,136(2):138-144.
[18]Sumner A T.Chromosome banding[M].Unwin Hyma,London,1990.
3 讨 论
本研究以三白草作为材料分离AP1基因,通过RACE方法快速克隆出全长cDNA,获得全长cDNA,通过测序分析,确定该基因为1 076 bp的全长cDNA序列,共编码245个氨基酸。AP1基因既属于花分生组织特征基因,又是花器官形态特征基因,AP1基因具有促进植物开花的作用[6]。
AP1基因在花器官发育中起关键作用。在花发育的ABCDE模型中,AP1基因既属于A类基因,是萼片和花瓣正常发育所必需的,同时又能激活B类基因。AP1基因突变使一些花变成花序,导致萼片和花瓣发育异常。被子植物中有关花发育方面的研究主要集中在拟南芥、金鱼草和矮牵牛等模式植物中,AP1基因在这些高等真双子叶植物中的功能、表达以及氨基酸序列具有相似性。而在被子植物基部类群的三白草,其花序没有花萼和花瓣,但开花时顶端3片苞叶变白,通过RT-PCR基因表达分析,发现在白色花瓣状苞叶中AP1基因有表达。AP1在三白草植株开花时顶端苞片变白过程中有明显上调,而幼叶中几乎没有表达,这也许与A-class基因的异位表达有关系,所以在无被花的三白草中有可能出现花瓣异位表达的现象。
参考文献:
[1]Feng CM,Liu X,Yu Y,et al.Evolution of bract development and B-class MADS box gene expression in petaloid bracts of Cornus s.l.(Cornaceae)[J].New Phytologist,2012,196:631-643.
[2]Vekemans D,Viaene T,Caris P,et al.Transference of function shapes floral organ identity in the dove tree inflorescence.New Phytologist,2011,193:216-228.
[3]Bowman JL,Alvarez J,Weigel D,et al.Control of flower development in Arabidopsis thaliana byAPETALA1 and interacting genes[J].Development,1993,119:721-743 .
[4]Fernando DD and Zhang SL.Constitutive expression of the SAP1 gene from willow (Salix discolor) causes early flowering in Arabidopsis thaliana[J].Dev Genes Evol,2006,216:19-28.
[5]Sather DN,Golenberg EM.Duplication ofAP1 within theSpinaciaoleraceaL.AP1/FUL clade is followed by rapid amino acid and regulatory evolution.Planta,2009,229:507-521.
[6]吕晋慧,吴月亮,孙磊,等.AP1基因转化地被菊品种‘玉人面’的研究[J].林业科学,2007,43(9):128-132.
