青藤碱对佐剂诱导性关节炎模型大鼠炎症相关因子表达的影响*
2018-03-29刘伟伟李雪萍高永翔
赵 静,刘伟伟,李雪萍,高永翔
(成都中医药大学基础医学院病理生理学教研室,成都 610075)
类风湿关节炎(rheumatoid arthritis,RA)是一种常见的以关节慢性炎症为主要表现,伴有关节外的各系统损伤的自身免疫性疾病[1]。RA的病因及发病机制仍不甚明确,为多种因素共同作用的结果,包括:遗传因素、感染、基因突变、滑膜细胞的演变、炎性细胞浸润及促炎细胞因子和趋化因子的释放等。但自身免疫及细胞因子网络的紊乱在RA发生和发展中发挥的关键作用已经得到广泛的认可[2]。清风藤用于治疗风湿性疾病历史悠久,李时珍在《本草纲目》中称清风藤“主治风疾,治风湿流注、历节鹤膝”。青藤碱是清风藤的单体提取物。现代药理研究显示,青藤碱具有显著的镇痛镇静、抗炎、免疫抑制等药理作用,但青藤碱的免疫抑制和抗风湿的机制尚未完全阐明[3]。为进一步探讨青藤碱抗RA的作用及机制,本实验通过复制佐剂诱导性关节炎(AIA)大鼠模型,选取炎症相关细胞因子进行研究,探讨青藤碱对类风湿关节炎相关细胞因子的影响及其免疫调节机制。
1 材料与方法
1.1材料
1.1.1动物 清洁级SD大鼠96只,7周龄,雌雄各48只,体质量(200±10)g,购自成都达硕生物科技有限公司,质量合格证号No.0006045,许可证号SCXK(川)2008-11。
1.1.2药物 甲氨蝶呤,购自上海信谊药制药有限公司,批号H31020644。以临床常用量换算为大鼠等效剂量作为本实验剂量,每3天1次(0.51 mg·kg-1·d-1)。盐酸青藤碱,购自宝鸡市永嘉天然植物开发有限公司,批号YJ0110822A。参照陈奇编著《中药药理研究方法学》,在多次给药实验后,给药浓度确定为按临床用量240 mg进行折算后6.25倍作为中剂量组,本实验中盐酸青藤碱低、中、高剂量组分别设计给药量为30、60、120 mg·kg-1·d-1。
1.1.3试剂 完全弗式佐剂,Sigma公司,每瓶10 mL。卡介苗(BCG),成都生物制品研究所,每瓶5 mg;白细胞介素(IL)-1检测试剂盒(R&D公司,货号:CK-E30418R);IL-6检测试剂盒(R&D公司,货号:CK-E30646R);IL-10检测试剂盒(R&D公司,货号:CK-E30651R)。
1.1.4仪器 酶标仪:Thermo Mulliskan Ascant公司;显微镜:德国莱卡显微镜,德国莱卡病理图像分析系统DM2000。
1.2方法
1.2.1造模 SD大鼠常规条件下饲养,自由饮水,普通饮食,适应性喂养7 d后,取80只大鼠,雌雄各40只,参照文献[4]采用完全弗氏佐剂(CFA)诱导法复制类风湿关节炎大鼠模型,即取CFA每支10 mL,在冰浴下与卡介苗混合,配制成含卡介苗10 mg/mL的水包油乳剂,对大鼠予以每只0.1 mL左足趾皮下注射。取16只大鼠,雌雄各8只,予生理盐水以每只0.1 mL左足趾皮下注射。第14天加强免疫,操作方法同前,注射部位改为尾部皮下,制成AIA模型。
1.2.2分组和给药 加强免疫7 d后取注射CFA的80只大鼠,雌雄各40只,分成模型组、甲氨蝶呤组、青藤碱低剂量组、青藤碱中剂量组、青藤碱高剂量组;取注射生理盐水的16只大鼠为正常对照组。甲氨蝶呤组灌胃给药剂量为0.51 mg·kg-1·d-1,青藤碱低、中、高剂量组灌胃给药剂量分别为30、60、120 mg·kg-1·d-1,正常对照组和模型组给予10 mg·kg-1·d-1生理盐水灌胃,连续给药21 d。
1.2.3取材 末次给药后禁食禁水12 h,以10%水合氯醛0.3 mL/100 g腹腔注射,辅以乙醚吸入麻醉大鼠。每组选取大鼠6只,剖开大鼠腹腔,腹主动脉取血并处死大鼠,离断大鼠注射侧足髋关节,取包含踝关节的足部。血液经3 000 r/min离心10 min后取上清液备用,离断的大鼠含踝关节的足置于4%多聚甲醛中固定备用。
1.2.4指标检测
1.2.4.1病理观察及半定量评分 标本经乙醇逐级脱水,二甲苯透明,石蜡包埋,切片,行苏木素-伊红(HE)染色。光镜下观察关节的病理改变,根据滑膜炎病理改变:滑膜衬层细胞层数、血管翳形成、炎性细胞浸润、新生血管/毛细血管;骨/软骨破坏:骨侵蚀、软骨侵蚀、关节粘连、关节结构破坏;关节修复:新生骨、新生软骨10项基本病变的不同严重程度(正常、轻度、中度、中度)给予0~3分,进行病理学半定量分析。
1.2.4.2全自动血生化仪检测大鼠血清类风湿因子(RF)和C反应蛋白(CRP)水平 以标记后的血生化采血管(红色),从大鼠腹主动脉采取抗凝血3 mL。以全自动血生化仪检测各组大鼠RF和CRP的水平。
1.2.4.3ELISA法检测大鼠血清IL-1、IL-6、IL-10的水平 根据ELISA试剂盒使用说明书中标准操作方法进行,每组选6只大鼠血清,ELISA法检测给药21 d后的大鼠血清IL-1、IL-6、IL-10水平,在酶标仪(λ=490 nm)测定吸光度(A)值。

2 结 果
2.1青藤碱对大鼠关节病理损伤的影响 正常对照组大鼠关节腔均未见病变(图1A)。模型组大鼠关节腔几乎完全消失,出现弥漫性滑膜细胞和纤维组织增生,血管翳形成,填满关节腔;多灶性区域出现炎性细胞聚集和新生毛细血管形成,并向软骨和骨组织浸润,软骨和骨破坏现象多见;灶性区域可见新生骨/软骨组织形成(图1B)。甲氨蝶呤组(图1C)、青藤碱低剂量组(图1D)和青藤碱中剂量组(图1E),虽然呈现明显的关节腔狭窄、腔内有炎性渗出物,以及关节囊测的滑膜组织明显增生和血管翳形成,但其程度低于模型组;灶性区域仍可见炎性细胞浸润和新生毛细血管形成,软骨和骨破坏现象也在部分切片中出现,但出现的频率和程度均远低于模型组,此3组的病理学积分与模型组比较显著降低。青藤碱高剂量组病理改变及病理学积分虽比模型组有所改善和降低(图1F),但差异无统计学意义(P>0.05)。各实验组大鼠关节组织病理学积分统计结果见图2。
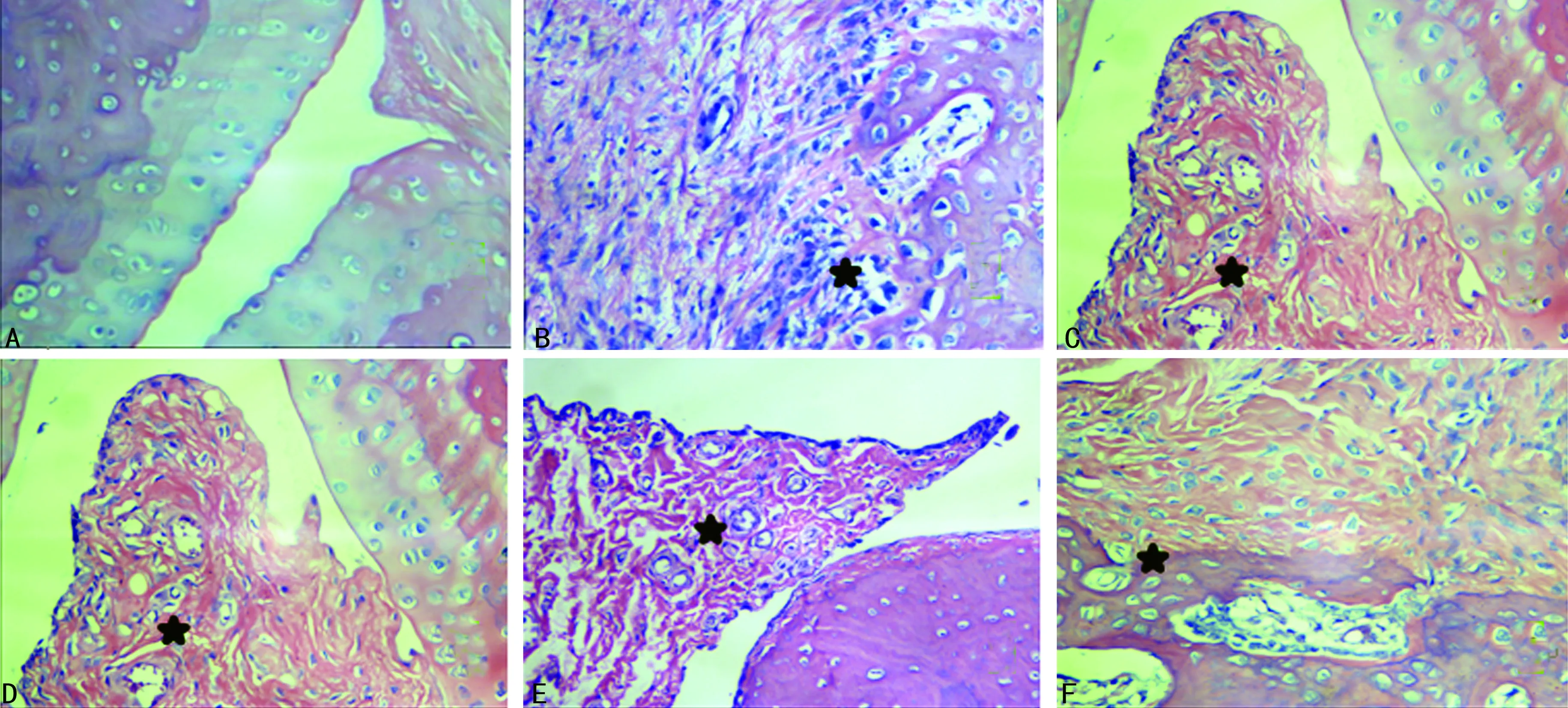
A:正常对照组;B:模型组;C:甲氨蝶呤组;D:青藤碱低剂量组;E:青藤碱中剂量组;F:青藤碱高剂量组
图1大鼠关节组织病理切片(HE,×400)
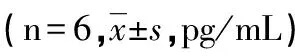
表1 青藤碱对各组大鼠IL-1、IL-6、IL-10的水平的影响
a:P<0.05,b:P<0.01,与模型组比较
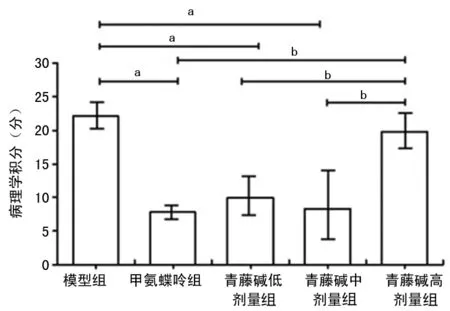
n=6;a:P<0.05,与模型组比较;b:P<0.05,与青藤碱高剂量组比较
图2各实验组大鼠关节组织病理学积分
2.2青藤碱对大鼠血清RF和CRP表达水平的影响 与正常对照组比较,模型组大鼠血清RF和CRP水平明显升高,差异有统计学意义(P<0.05)。与模型组比较,甲氨蝶呤组、青藤碱低、中、高剂量组RF水平降低,但差异无统计学意义(P>0.05),见图3;甲氨蝶呤组,青藤碱低、中、高剂量组,差异有统计学意义(P<0.01或P<0.05),见图4。
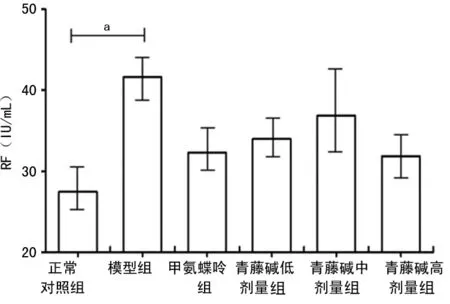
n=6;a:P<0.05,与模型组比较
图3各组大鼠血清RF水平比较
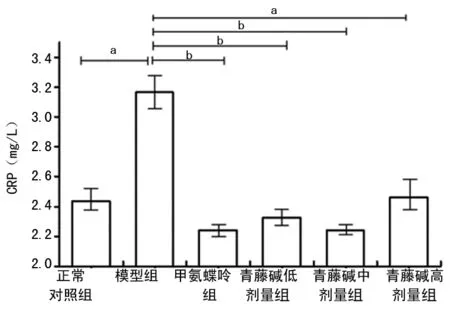
n=6;a:P<0.05,b:P<0.01,与模型组比较
图4各组大鼠血清CRP水平比较
2.3青藤碱对大鼠血清炎症相关细胞因子表达水平的影响 模型组大鼠与正常对照组相比,IL-1、IL-6水平明显上升,IL-10水平则明显下降,且差异均有统计学意义(P<0.01)。用药后,甲氨蝶呤组和青藤碱低、中剂量组与模型组相比,IL-1、IL-6水平下降,IL-10水平上升,差异有统计学意义(P<0.01或P<0.05)。青藤碱高剂量组与模型组相比,指标下降但差异无统计学意义(P<0.05)。见表1。
3 讨 论
根据RA的临床表现特征,其归属于中国传统医学的“历节”“痹病”范畴。如《金匮要略·中风历节病脉证并治》提出:“病历节不可屈伸疼痛”“诸肢节疼痛,身体魁赢,脚肿如脱”,其中对症状的描述,与RA有相似之处[5]。中医学理论认为,风寒湿邪为“痹病”发生的重要外在因素,痰淤互结是痹症产生的关键病机,其治疗常用清热解毒、祛风散寒,活血化瘀、补益肝肾等法。清风藤为防己科植物青藤、华防己或清风藤科植物清风藤等的藤茎,李时珍在《本草纲目》中称清风藤“主治风疾,治风湿流注、历节鹤膝”[6]。《本草汇言》记载:“清风藤,散风寒湿痹之药也,能舒筋活血,正骨利髓,故风病软弱无力,并劲强偏废之证,久服常服,大建奇功”[7]。青藤碱是清风藤的单体提取物,现代药理研究证实,青藤碱具有显著的镇痛、镇静、抗炎、免疫抑制等药理作用,临床用于治疗风湿病常有良效[3]。
现代医学研究证实,机体免疫功能紊乱,免疫细胞及细胞因子网络失衡是RA重要的发病机制和表现形式,尤其是细胞因子IL-1、IL-6和IL-10在其中发挥重要作用。IL-1是目前已知的RA中最重要的炎性细胞因子之一。血浆和滑膜中的IL-1水平,与关节炎性活动水平、关节破坏进展直接相关。RA的IL-1主要来源于活化的巨噬细胞,可由肿瘤坏死因子(TNF)-α或IL-1自身刺激产生,具有促进自我分泌的能力,能将炎症信号迅速放大。滑液中的IL-1会刺激前列腺素E2、一氧化氮(NO)和基质金属蛋白的表达,促进关节的破坏;并能抑制胶原的合成而抑制关节修复,刺激破骨细胞重吸收骨。此外IL-1作为内生致热源,能激活T淋巴细胞和B淋巴细胞,并使巨噬细胞活化释放各种蛋白水解酶和趋化因子[8-10]。IL-6也是RA中重要的促炎细胞因子。当滑膜成纤维细胞受到促炎细胞因子如IL-1、TNF-α、IL-17等刺激时,能大量产生IL-6,继而通过诱导新生血管形成、促进炎性细胞浸润和促进滑膜细胞增生,促进滑膜炎性进程。此外,IL-6还能诱导滑膜细胞和软骨细胞产生金属蛋白酶(metalloproteinases,MMPs),刺激破骨细胞形成,引起骨质吸收[11]。更重要的是IL-6还能通过破坏Th17和Treg之间的平衡参与自身免疫性疾病的发病[12]。由于其在发病中的核心地位,IL-6已成为一个独立的阻断靶点。同进针对IL-6的单抗已进入Ⅲ期临床试验,并被证实有效。而与IL-1和IL-6相反,IL-10是RA疾病过程中,比较重要的抑炎因子。作为Th2细胞的代表细胞因子,IL-10具有很强的免疫抑制及免疫调控作用,在RA的发病环节中能抑制IL-8,粒细胞集落刺激因子和粒细胞-巨噬细胞集落刺激因子等炎症因子的释放,拮抗相关TH1细胞因子,从而发挥对RA的抑制作用[13-14]。
如上所述,IL-1和IL-6是RA疾病进程中重要的促炎因子,与关节炎性反应和关节破坏程度呈正相关;IL-10则是重要的抑炎因子,与关节炎性反应呈负相关。同时血液中的IL-1、IL-6 和IL-10水平还能反映RA发生时机体的全身免疫状态。本实验选取上述3个因子作为RA发生时炎性细胞因子网络失衡的代表,以期探讨青藤碱能否通过调节机体免疫状态,恢复促炎因子与抑炎因子的失衡状态,进而发挥治疗作用。
RF和CRP 与RA的临床表现和关节损伤程度密切相关,在一定程度上反映 RA的疾病活动度[15]。本实验研究结果显示,造模处理后,模型组大鼠RF和CRP水平明显升高,同时血清IL-1和IL-6水平升高,IL-10水平降低,大鼠关节病理损伤程度半定量评分明显增加,提示佐剂诱导性AIA模型复制成功;经过灌胃给药治疗后,甲氨蝶呤组及青藤碱低、中、高剂量组大鼠血清CRP水平明显低于模型组,青藤碱低、中剂量组大鼠血清IL-1和IL-6水平降低,IL-10水平上升,大鼠关节病理损伤程度半定量评分也相应降低,提示青藤碱对佐剂诱导性AIA模型大鼠具有治疗作用。青藤碱高剂量组大鼠关节组织病理评分、血清IL-1、IL-6和IL-10水平变化与模型组比较均无显著差异,可能为高剂量青藤碱免疫抑制的药理作用减弱,反而对大鼠脏器产生不良反应,有待进一步研究证实。已有研究报道显示,大剂量青藤碱可导致大鼠肝脏损伤,且脏器损伤程度与药物在组织中浓度呈正相关[16]。青藤碱能明显减轻关节腔内的炎性反应,抑制滑膜组织增生及血管翳的形成,减轻软骨和骨组织浸润及关节腔的破坏,可能与青藤碱抑制模型动物的血清IL-1和IL-6的上升趋势,同时促进IL-10的分泌有关。这一现象既能够反映青藤碱对模型组的治疗作用,同时也揭示了部分可能的治疗作用机制,即青藤碱可能通过下调血清促炎细胞因子IL-1和IL-6的表达,上调抑炎因子IL-10的表达,对RA的细胞因子网络进行调节,阻断或干扰其后续炎性反应,减轻滑膜血管翳增生和软骨破坏。青藤碱对促炎因子与抑炎因子失衡状态的调节作用,与中医治疗疾病 “调节阴阳,以平为期”最终目的不谋而合。
尽管发现了青藤碱能对部分细胞因子起调控作用,从而发挥其抗炎效应。但针对点状模式的细胞因子网络,并不能全面解释其对RA炎性反应过程中,复杂的免疫调节过程。在实验后续机制探索部分,将应用基因芯片技术,全面检测全基因表达谱的改变,试图寻找位于网络结构中心的信号通路和基因,并分析之间相互联系。通过以上探索,可为后续发掘中药青藤碱对RA的治疗机制,拓展青藤碱在治疗自身免疫性疾病的应用打下基础。
[1]KLARESKOG L,CATRINA A I,PAGET S.Rheumatoid arthritis[J].Lancet,2009,373(2):659-672.
[2]CICCIA F,GUGGINO G,RIZZO A,et al.Potential involvement of IL-9 and Th9 cells in the pathogenesis of rheumatoid arthritis[J].Rheumatology(Oxford),2015,54(12):2264-2272.
[3]危红华,赵晓旭,程亮,等.青藤碱治疗类风湿性关节炎的研究进展及展望[J].中华中医药杂志,2013,8(10):3001-3003.
[4]吴晶金.类风湿关节炎动物模型研究进展[J].风湿病与关节炎,2016,5(12):70-73.
[5]李晶,张华东,王振兴,等.从《金匮要略·中风历节病脉证并治》论痹病发病机制[J].北京中医药,2013,32(6):448-449.
[6]熊力群,余舒鹏,李文龙,等.清风藤临床应用研究概况[J].亚太传统医药,2017,13(2):63-65.
[7]高晨鑫,张湛明,陈继红,等.青藤碱对类风湿关节炎细胞因子影响的研究进展[J].风湿病与关节炎,2017,6(2):72-75.
[8]KOSEK E,ALTAWIL R,KADETOFF D,et al.Evidence of different mediators of central inflammation in dysfunctional and inflammatory pain--interleukin-8 in fibromyalgia and interleukin-1 β in rheumatoid arthritis[J].J Neuroimmunol,2015,280(1):49-55.
[9]UMAR S,HEDAYA O,SINGH A K,et al.Thymoquinone inhibits TNF-α-induced inflammation and cell adhesion in rheumatoid arthritis synovial fibroblasts by ASK1 regulation[J].Toxicol Appl Pharmacol,2015,287(3):299-305.
[10]王志中,王勇,牟方祥,等.血小板、TNF-α及IL-1β与活动期类风湿关节炎的相关性研究[J].第三军医大学学报,2011,33(5):469-472.
[11]SAEKI Y,KUDO-TANAKA E,OHSHIMA S,et al.Baseline anti-citrullinated peptide antibody(ACPA)titers and serum interleukin-6(IL-6)levels possibly predict progression of bone destruction in early stages of rheumatoid arthritis(ERA)[J].Rheumatol Int,2013,33(2):451-456.
[12]YOSHIDA Y,TANAKA T.Interleukin 6 and rheumatoid arthritis[J].Biomed Res Int,2014:698313
[13]陈晓梅,李静,张晓盈,等.不同亚型的滤泡辅助性T淋巴细胞在类风湿关节炎中的临床意义[J].北京大学学报(医学版),2016,48(6):958-963.
[14]蔡辉,张群燕,郭郡浩,等.类风湿关节炎患者外周血血浆中TNF-α、IL-1β及IL-10的表达及临床意义[J].中华中医药学刊,2017,35(3):519-521.
[15]兰由玉,王友强,何成松.五项检测指标在类风湿关节炎早期诊断中的临床价值[J].中国卫生检验杂志,2013,23(9):2130-2135.
[16]叶木荣,刘良,曾元儿,等.青藤碱在大鼠体内分布与脏器毒理的关系研究[J].中国药理学通报,2001,17(1):65-69.
