富钾正长岩水热分解生成沸石反应热力学
2018-03-29刘昶江马鸿文张盼2中国地质大学北京材料科学与工程学院北京00083
刘昶江,马鸿文,*,张盼,2中国地质大学(北京)材料科学与工程学院,北京 00083
2昊青薪材(北京)技术有限公司,北京 100083
1 引言
中国水溶性钾盐资源短缺,且分布不均,钾肥生产长期依赖进口1。富钾正长岩是一类以钾长石(KAlSi3O8)为主要物相的非水溶性钾资源,我国此类资源储量丰富且分布广泛2。利用富钾正长岩制取钾盐对于解决我国钾盐短缺,保障农业可持续发展有重要意义。本团队经过20余年研究,开发出了一系列由富钾岩石制取钾盐的关键技术3,其中水热碱法具有能耗低、资源利用率高、生产过程清洁等特点4。
钾长石理论化学组成(质量分数)为:K2O 16.9%,Al2O318.4%,SiO264.7%,从钾长石中提钾的同时,应兼顾剩余硅铝组分的综合利用4。在以NaOH为介质的水热碱法条件下,富钾正长岩的分解反应体系与沸石分子筛的晶化环境相近5。沸石分子筛是具有催化、吸附、离子交换性能的一类功能材料。因此,以富钾正长岩为原料,在Na2O-K2O-Al2O3-SiO2-H2O体系合成沸石分子筛是实现剩余组分高效利用的有效途径。
传统沸石合成以非晶态铝硅凝胶为原料,其成分、结构、热力学性质并不确定,故无法对沸石晶化过程进行定量热力学研究。而富钾正长岩中的结晶态矿物,热力学性质明确,故可通过热力学方法研究其水热分解生成沸石的过程。
在自然界,长石矿物水岩作用过程涉及一些天然沸石的生成6,7,但其条件相对温和,溶液接近中性,反应历程缓慢。在水热碱法环境中,富钾正长岩的分解及沸石的晶化在中低温、高压、强电解质环境下进行,反应在数小时内即可完成。前期利用富钾正长岩合成沸石的研究重在探索工艺路线及反应条件8–10,采用热力学方法对该体系沸石晶化反应的研究尚未见报道。
本文旨在构建富钾正长岩水热分解生成沸石化合物的平衡热力学模型,计算反应 Gibbs自由能,模拟不同反应体系相平衡,并进行实验验证。

图1 富钾正长岩粉体(YK-13)的X射线粉晶衍射图谱

表1 富钾正长岩粉体的化学成分Table 1 Chemical composition of the potassic syenite powder.
2 实验部分
实验所用富钾正长岩粉体来自安徽某地(样品号:YK-13,粒径 < 74 μm)。X射线粉晶衍射结果表明其主要矿物组成为微斜长石、石英、钠长石(图1),化学成分见表1。矿物组成及含量为:微斜长石 72.6%,斜长石 18.7%,石英6.5%,黑云母 0.9%,磁铁矿0.4%,方解石0.2%,磷灰石0.1% (总和 99.4%)。将石英视为长石端员组分之一,以Si4O8表示11,各矿物端员组分摩尔分数为:K[AlSi3O8] 0.597,Ba[Al2Si2O8] 0.009, Na[AlSi3O8]0.286,Ca[Al2Si2O8] 0.017,[Si4O8] 0.074,KMg3[AlSi3O10](OH)20.004,KFe3[AlSi3O10](OH)20.002,Fe3O40.004, CaCO30.005,Ca5(PO4)3(OH)20.0005。
反应在容积为100 mL的聚PPL内衬不锈钢外套反应釜中进行。首先称取氢氧化钠试剂(A.R.NaOH > 96%,国药集团化学试剂有限公司),溶解于蒸馏水(实验室自制)中,加入一定量富钾正长岩粉体,搅拌均匀,密封后置于 JXF-6-200均相反应器(烟台松岭化工设备有限公司)中,设定反应温度及转速。反应结束后,用冷水迅速降温,开釜后过滤,用90 °C蒸馏水洗涤3次,滤饼于105 °C下干燥12 h。
3 热力学模型
3.1 模型构建
富钾正长岩-NaOH-H2O体系涉及原料矿物及产物的固液两相化学平衡问题。以原料中的微斜长石和目标产物方沸石为例,其溶解平衡关系见化学反式(1)和(2)。溶液中多种离子间同样存在平衡关系,如水以及多种形态硅酸根之间的电离平衡(反应式(3)、(4))。
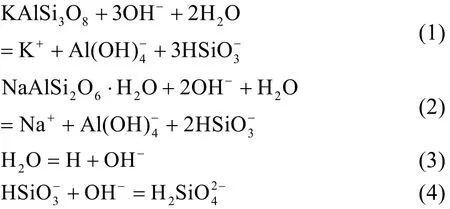
微斜长石分解反应(1)的平衡常数 Kɵ可由方程(5)来表示,其中α、m、γ分别表示各物种的活度(mol·kg−1)、质量摩尔浓度(mol·kg−1)、活度系数。平衡常数与反应的标准Gibbs自由能(Δ,单位:kJ·mol−1,下同)之间的关系见方程(6) (R,气体常数,8.314 J·mol−1·K−1;T,温度,单位 K)。同时,Δ可以通过反应物与产物的标准生成 Gibbs自由能(Δ)获得(式(7),vi、uj分别表示产物、反应物的化学计量系数),该关系是表征水热体系化学平衡问题的关键。任意状态下,对于富钾岩石中涉及的多矿物分解反应,总反应 Gibbs自由能(∑ΔGr)通过各矿物端员组分摩尔分数(ni)加权获得(式 8)。
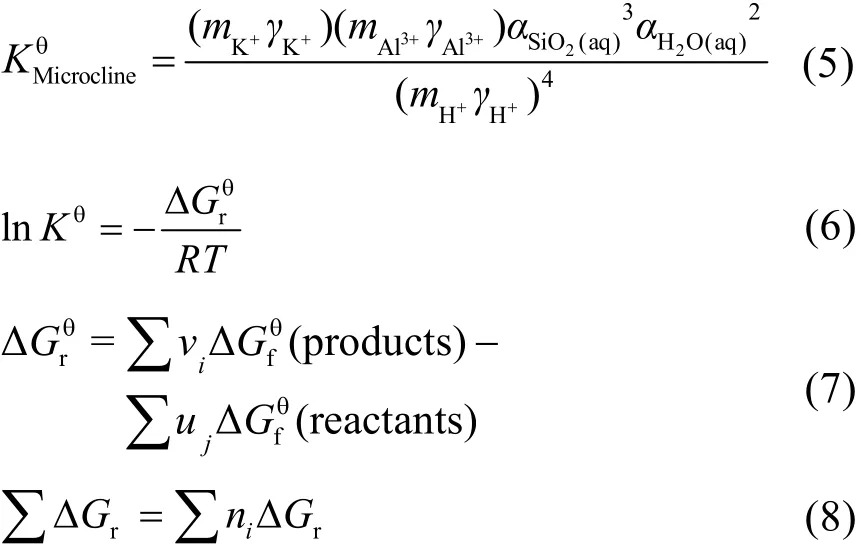
3.2 热力学参数
固相化合物在温度T和相应压力p时的生成Gibbs自由能可通过标准熵Sɵ、热容Cp及摩尔体积 V和温度、压力之间的关系求得(9),其中 Cp以(10)表示12。

3.2.1 矿物端员组分
矿物端员组分的基础热力学数据可查阅相关热力学手册13,14,富钾正长岩粉体中所涉及矿物端员组分的热力学数据见表2。
3.2.2 沸石化合物
沸石的生成焓、生成 Gibbs自由能、熵、热容均可通过“聚合多面体模型”计算15,16。
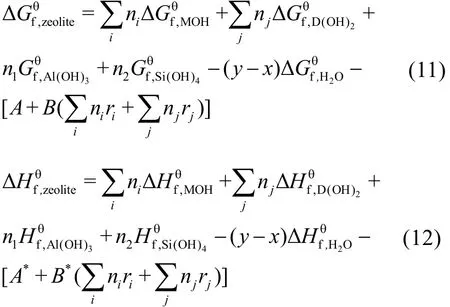

表2 矿物端员组分的热力学数据Table 2 Thermodynamic data of mineral end-members.
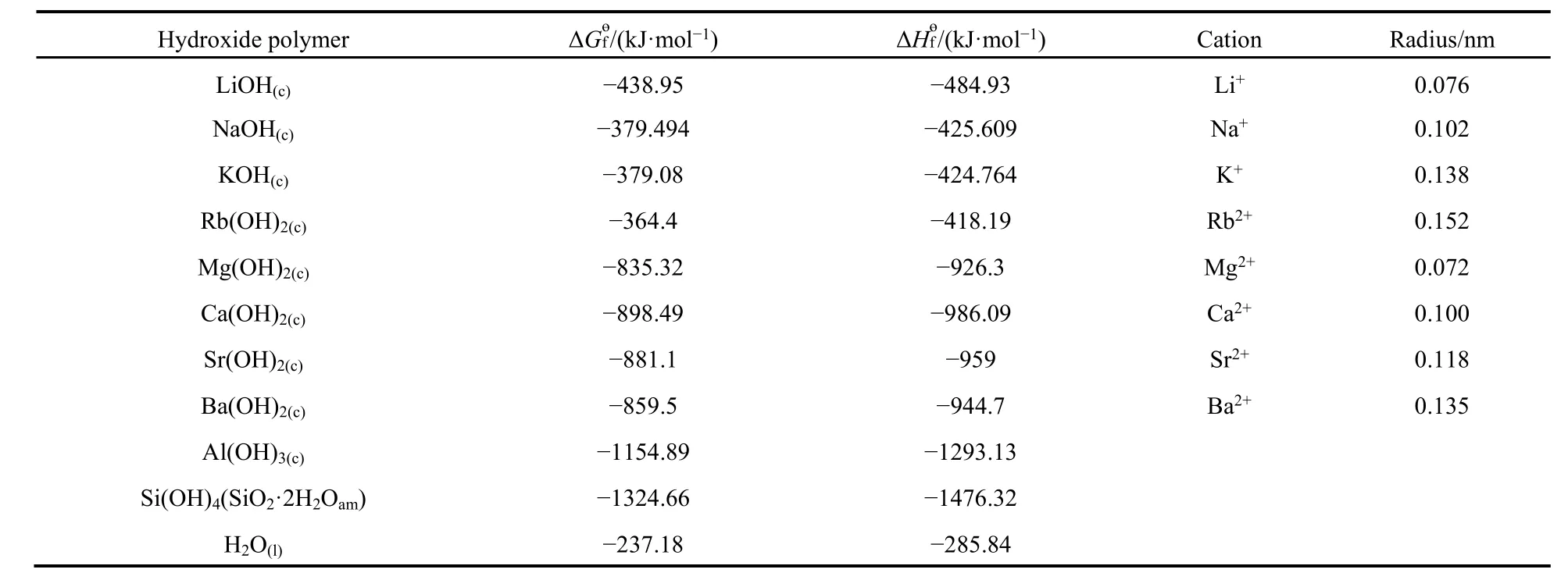
表3 氢氧化物多面体的标准生成Gibbs自由能、标准生成焓及阳离子半径Table 3 Standard Gibbs free energy of formation, standard enthalpy of formation of hydroxide polymers, and cation radius.

Oxide polymer Na2O K2O Al2O3 CaO MgO H2O SiO2 Sɵ/(J·K−1·mol−1) 149.55 163.45 11.05 43.40 51.99 52.00 45.60 V/(cm3·mol−1) 73.44 99.52 95.30 20.90 15.57 0.00 31.75

表5 氧化物多面体的Cp参数Table 5 Cp-related parameters of oxide polymers.
沸石化合物的标准熵按照式(13)计算。其中nT为沸石单元中[TO4](T = Si4+,Al3+,Fe3+)的数目,Vi为多面体组分的晶胞体积,A = 0.5132,B =9.559。对于沸石中的SiO2组分,其标准熵可由式(14)求得,FD表示单位晶胞体积(nm3)内的四面体数目(式(15))。各氧化物多面体的标准熵及摩尔体积见表4。
Cp同样采用氧化物组分加和法计算,将沸石中各聚合多面体组分的参数(表5)按照化学计量比关系相加和,即可获得a、b、c三个参数。
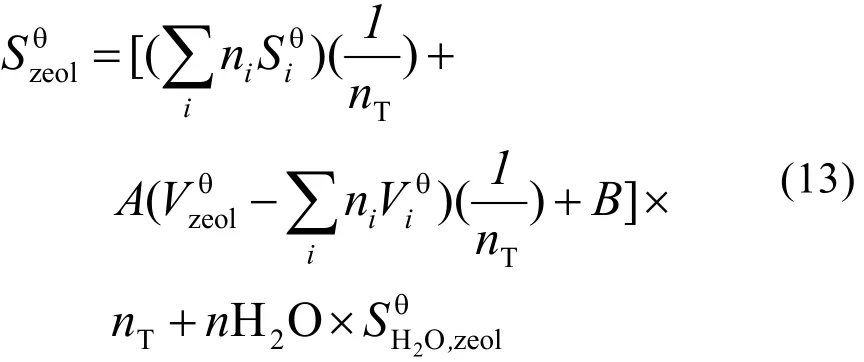

在富钾正长岩-NaOH-H2O体系中,原矿物分解溶出K+同时合成钠型沸石,是实现钾的溶出及硅铝组分高值利用的有效途径。富钾正长岩化学成分中Si/Al摩尔比约为3,沸石产物的Si/Al摩尔比应 ≤ 3,符合该条件的沸石种属包括A型、P型沸石、方沸石、羟钙霞石等。考虑沸石结构中的离子替代,原矿粉体中的Ca可能以Ca2+形式存在,忽略其他微量杂质离子。根据聚合多面体模型计算上述沸石的热力学参数(表6),并补充至热力学软件“OLI SYSTEM”中。
3.2.3 电解质溶液
表6 采用聚合多面体模型计算沸石的热力学参数Table 6 Thermodynamic data of zeolites predicted by polymer model.

表7 离子的热力学参数Table 7 Thermodynamic data of ionic species.
电解质溶液中,某物种的 Gibbs自由能可以用标准态(Gɵ)与过剩态(GE)两个状态来表示,前者与温度和压力相关,后者除温度、压力外,还与体系组成相关(式(16))11。水溶液中任一组分的热力学性质可以用HKF方程表示(式(17)),a1− a4、c1、c2、ω七个参数分别代表体积(a)和热容(c)的积分常数以及不同温度、压力条件下水的性质(ω),Θ = 298 K,Ψ = 2.6×108Pa17,18。富钾正长岩水热分解体系所涉及的离子组分相关热力学基础数据列于表7中。

过剩态GE采用“混合电解质模型”计算,该模型综合考虑了电解质溶液中离子长程(LR)、中程(MR)、短程(SR)相互作用(式(18))。对应地,离子的活度系数γ由式(19)表示,过剩态Gibbs自由能由式(20)求得,其中 m为离子的质量摩尔浓度(mol·kg−1)。以上三种作用模型见式(21–23)19,20,可通过电解质溶液模拟软件 OLI Analyzer 9.3计算,相关参数来自软件自带数据库。

4 结果讨论
4.1 反应Gibbs自由能
以1 mol富钾正长岩粉体(YK-13)计,按照矿:水质量比为1 : 3 (272 g矿:815 g水)配比,分别按照式(7–8)计算生成方沸石、羟钙霞石、A型沸石、P型沸石的Gibbs自由能。综合考虑富钾正长岩的水热碱法分解反应及工业上沸石分子筛的水热合成条件,选定反应温区为160–300 °C,反应Gibbs自由能计算结果见表8。由表8可知,在上述设定条件下,由富钾正长岩粉体(YK-13)水热分解生成羟钙霞石的∑ΔGr皆小于零,且数值随温度升高而减小,表明上述反应可以自发进行,且高温更有利于羟钙霞石生成;生成方沸石、P型沸石、A型沸石的∑ΔGr随着温度的升高而逐渐增大,表明高温不利于此类沸石的生成。当温度大于260 °C时,∑ΔGr(P型沸石)变为正值;当温度大于280 °C时,∑ΔGr(方沸石)变为正值。徐如人等21指出,A型、P型沸石一般在低温条件下生成,高温条件下所得沸石的孔径较小,200–300 °C条件下,主要生成方沸石、方钠石等小孔沸石。上述计算结果与该结论基本一致。
由此可见,利用铝硅酸盐矿物直接合成沸石分子筛在热力学上是可行的。与传统合成工艺相比,富钾正长岩一步水热合成沸石无须使用纯化学原料,即省去了化学试剂的制备工艺,同时不需要陈化、成核等复杂操作,在溶出K+的同时合成沸石,更具经济实用性和工程应用价值。
4.2 反应相平衡条件模拟
采用OLI Analyzer 9.3软件中的“混合电解质模型”对富钾正长岩-NaOH-H2O体系相平衡进行模拟,计算方式选择“Bubble Point”,以100 g正长岩为基准。
4.2.1 碱液浓度
模拟条件:水600 g (水/矿质量比6),反应温度 240 °C。
计算结果:在 NaOH溶液浓度为 1.5–5.0 mol·kg−1范围内,矿石中长石、石英发生分解,而微量黑云母、磁铁矿、方解石、磷灰石不发生分解。平衡压力3.17–2.90 MPa,平衡液相pH值10.9–11.8。NaOH溶液浓度对产物类型影响:浓度1.5–2.0 mol·kg−1,产物为方沸石;2.0–2.5 mol·kg−1,产物为方沸石+羟钙霞石;2.5–5.0 mol·kg−1,产物为羟钙霞石(图2)。
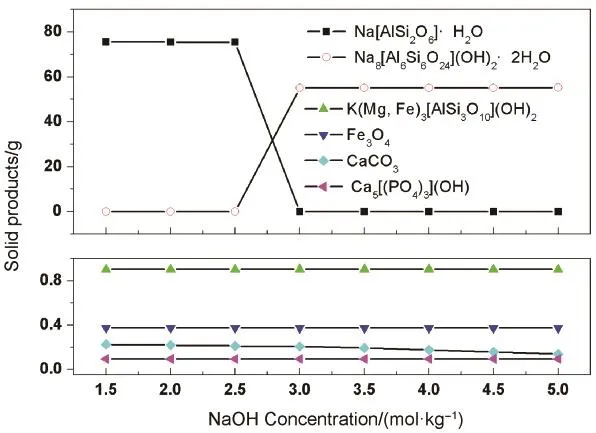
图2 不同浓度NaOH固相产物模拟结果

表8 富钾正长岩粉体生成钠型沸石的Gibbs自由能Table 8 Gibbs free energy of reaction from potassic powder to Na-zeolites.

表9 不同温度下平衡产物模拟结果Table 9 Simulated results at equilibrium at different temperatures.
4.2.2 反应温度
模拟条件:水600 g (水/矿质量比6),NaOH溶液浓度 2.0 mol·kg−1。

图3 不同NaOH浓度下产物的XRD图谱
计算结果:200–300 °C,长石、石英等主要物相发生分解,其他微量矿物不分解。平衡压力1.45–8.04 MPa,平衡液相 pH 值 10.2–11.0。温度几乎不影响产物类型,新生产物为方沸石,高温下(280–300 °C)二聚硅酸钾溶解度较低,故沉淀出来,降温、洗涤过程可重新溶解(表9)。
4.3 分解反应实验
称取富钾正长岩粉体10 g,蒸馏水60 g,反应温度240 °C,时间24 h,NaOH溶液浓度为1.5–5.0 mol·kg−1。固相产物采用 D8 Advance 型 X 射线衍射仪测定物相,采用JSM-IT300型扫描电镜观察其微观形貌。
产物的X射线粉晶衍射结果表明,NaOH溶液浓度为 1.5–2.3 mol·kg−1时,新生成产物为方沸石,同时存在未分解的微斜长石;浓度为 2.5 mol·kg−1时,产物为方沸石和羟钙霞石的混合相;浓度为 3.0–5.0 mol·kg−1时,产物为羟钙霞石(图3)。实验结果与模拟计算基本一致。富钾正长岩在碱性水热条件下通过“溶解-结晶”过程形成方沸石、羟钙霞石等沸石族化合物8,其平衡稳定性受体系中Na+、、OH−等离子的共同影响,高碱低硅为羟钙霞石,反之为方沸石22。故当NaOH 溶液浓度较高时(2.5–5.0 mol·kg−1),平衡体系存在大量Na+、OH−,生成羟钙霞石;低NaOH溶液浓度时,平衡体系相对较高,方沸石生成。

图4 羟钙霞石(a, b)及方沸石(c, d)的SEM照片
羟钙霞石为六方晶系柱状晶体,呈短柱状或细纤维状(图 4a),长约 20 μm,截面尺寸约 500 nm–1 μm,因其表面能较高,常聚集成团簇状(图4b)。方沸石属等轴晶系,晶体呈规则的四角三八面体晶形(图4c),晶体尺寸约50 μm,粒径分布较均匀(图 4d)。
两种水热分解产物的化学成分见表10,两样品中K2O含量均为0.4%左右,原正长岩中约97%的K2O进入液相。

表10 富钾正长岩水热分解产物的XRF分析结果(wB, %)及相应条件下K2O溶出率(%)Table 10 XRF analyses of the hydrothermal products from the potassic syenite powder, and the leaching ratio of K2O.
5 结论
(1) 采用“聚合多面体模型”计算了几种沸石化合物的热力学参数,并补充至热力学计算软件“OLI SYSTEM”中。结合“混合电解质模型”,建立了富钾正长岩水热分解-生成沸石的平衡热力学关系。
(2) 热力学计算表明,富钾正长岩水热分解生成沸石化合物的反应可自发进行;相平衡模拟结果表明,产物类型主要受NaOH溶液浓度影响,NaOH溶液浓度较低时产物为方沸石,较高时为羟钙霞石。
(3) 富钾正长岩水热分解实验结果与相平衡模拟结果基本一致,通过控制反应条件,合成了羟钙霞石、方沸石两种沸石产物,羟钙霞石呈短柱状或细纤维状,方沸石呈四角三八面体晶形。K2O溶出率约达97%。
(1) Ma, H. W.; Su, S. Q.; Liu, H.; Yang, X.; Peng, H.; Yu, Z. Earth Sci.Front. 2010, 17 (1), 294. [马鸿文, 苏双青, 刘浩, 杨雪, 彭辉, 俞子俭. 地学前缘, 2010, 17 (1), 294.]
(2) Ma, H. W. Potassic Cocks in China: Resource and Clean Utilization Techniques; Chemical Industry Press: Beijing, 2010; pp. 1–25. [马鸿文. 中国富钾岩石: 资源与清洁利用技术. 北京: 化学工业出版社, 2010: 1–25.]
(3) Su, S. Q.; Yang, J.; Ma, H. W.; Zhang, P. Ind. Miner. Process. 2014,(2), 46. [苏双青, 杨静, 马鸿文, 张盼. 化工矿物与加工, 2014,(2), 46.]
(4) Ma, H. W.;Yang, J.;Su, S. Q.; Liu, M. T.; Zheng, H.; Wang, Y. B.;Qi, H. B.; Zhang, P. Acta Geol. Sin.- Engl. 2015, 89 (6), 2058.
(5) Lovat, V. C. R.; Sathy, C. Zeolites 1993, 13, 524.doi: 10.1016/0144-2449(93)90229-V
(6) Liou, J. G.; Christian, C.; Martin, F. New Zeal. J. Geol. Geop. 1991,34 (3), 293. doi: 10.1080/00288306.1991.9514467
(7) Alekseyev, V. A.; Medvedeva, L. S.; Prisyagina, N. I.; Meshalkin, S.S.; Balabin, A. I. Geochim. Cosmochim. Acta1997, 61 (6), 1125.doi: 10.1016/S0016-7037(96)00405-X
(8) Ma, X.; Yang, J.; Ma, H. W.; Liu, C. J.; Zhang, P. Micropor.Mesopor. Mater. 2015, 201, 134.doi: 10.1016/j.micromeso.2014.09.019
(9) Yang, J.; Ma, H. W.; Zeng, C.; Liu, C. J.; Ma, X.; Luo, Z.; Wang, S.J. Acta Minera. Sin. 2016, 36 (1), 38. [杨静, 马鸿文, 曾诚, 刘昶江, 马玺, 罗征, 王时健. 矿物学报, 2016, 36 (1), 38.]doi: 10.16461/j.cnki.1000-4734.2016.01.007
(10) Yuan, J. Y.; Yang, J.; Ma, H. W. Liu, C. J. Zhao, C. L. RSC Adv. 2016, 6 (59), 54503. doi: 10.1039/c6ra08080d
(11) Ma, H. W. Introduction to Thermodynamics in Crystalline Petrology, 2nd ed.; Higher Education Press: Beijing, 2001,pp. 1–22. [马鸿文. 结晶岩热力学概论(第2版). 北京: 高等教育出版社, 2001, 1–22.]
(12) OLI Systems Inc. A Guide to Using OLI Analyzer (Version 9.2), 2015.
(13) Holland, T. J. B. J. Metamorphic Geol. 1990, 8 (1), 89.doi: 10.1111/j.1525-1314.1990.tb00458.x
(14) Holland, T. J. B.; Powell, R. J. Metamorphic Geol. 2011, 29(3), 333.doi: 10.1111/j.1525-1314.2010.00923.x
(15) Veeillard, P. Eur. J. Mineral. 2010, 22 (6), 823.doi: 10.1127/0935-1221/2010/0022-2026
(16) Arthur, R.; Sasamoto, H.; Walker, C.; Yui, M. Clay Clay Minerals 2011, 59 (6), 626.doi: 10.1346/CCMN.2011.0590608
(17) Shock, E. L.; Helgeson, H. C. Geochim. Cosmochim. Acta 1988, 52 (8), 2009.
(18) Sverjensky, D. A.; Shock, E. L.; Helgeson, H. C. Geochim.Cosmochim. Acta 1997, 61 (7), 1359.doi:10.1016/S0016-7037(97)00009-4
(19) Wang, P.; Anderko, A.; Young, R. D. Fluid Phase Equilibr.2002, 203 (1), 141. doi: 10.1016/S0378-3812(02)00178-4
(20) Wang, P.; Springer, R. D.; Anderko, A.; Young, R. D. Fluid Phase Equilibr. 2004, 222–223, 11.doi: 10.1111/j.1525-1314.2010.00923.x
(21) Xu, R. R.; Pang, W. Q.; Huo, Q. S. Molecular Sieve and Porous Materials Chemistry, 2nd.; Science Press: Beijing,2014; pp. 117–131. [徐如人, 庞文琴, 霍启升. 分子筛与多孔材料化学(第二版). 北京: 科学出版社, 2014: 117–131.]
(22) Wajima, T. Micropor. Mesopor. Mater. 2016, 232, 77.doi:10.1016/j.micromeso.2016.01.020
