微压氧对大强度训练大鼠氧化应激的影响
2018-03-29张冉,赵鹏
张 冉,赵 鹏
随着世界竞技水平的提高,运动员训练强度也在不断地增大,运动员训练后或比赛期间的恢复越来越受到关注。不充分的恢复不仅会导致疲劳、运动表现下降,甚至还会增加运动损伤的可能性[1]。因此,实现运动训练、比赛应激以及恢复之间的适当平衡对于提高运动员的运动表现是非常重要的。
微压氧疗法 (Mild-pressure Hyperbaric Therapy,mHBT)是指吸入压力在1~2绝对大气压(Absolute Atmosphere,ATA)之间、氧浓度大于 35%的环境气体的过程[2]。近年来微压氧在优秀运动员中使用变得越来越流行,最近在普通大众中已成为改善疲劳、增强整体健康、恢复运动相关损伤以及抗衰老的方式。但是对于微压氧的治疗效果以及机制的研究甚少。Kim等研究了微压氧对氧化应激及疲劳的影响[2]。所有参与者在微压氧前后进行指标测评。结果活性氧代谢物(Reactive Oxygen Metabolites,ROMs)和疲劳类推视觉量表在微压氧前后有显著性差异,而生物抗氧化能力(Biological Antioxidant Potential,BAP)没有显著性差异。结果揭示微压氧可以有效地减少氧化应激,而主观指标的变化可能与微压氧的安慰剂效果有关。因此,微压氧是否能促进运动后机体的恢复还有待于进一步研究。
氧化应激是指自由基的产生和清除之间不平衡,自由基的产生大于自由基的清除。为了保持体内自由基产生和清除之间的平衡,身体的抗氧化系统被激活以保护细胞。但是当抗氧化防御系统不够强壮和有效消除加速产生的活性氧(Reactive Oxygen Species,ROS)和 活 性 氮 (Reactive Nitrogen Species,RON)时,氧化应激就会发生,而氧化应激的发生会干扰细胞信号通路。长久的氧化还原平衡的改变也会对细胞结构带来损害,如核酸、脂质、蛋白质甚至是通过凋亡引起细胞死亡[3]。机体可以通过自身的抗氧化防御系统来抵抗自由基造成的细胞损伤,主要包括酶促系统和非酶促系统。酶促系统主要包括,超氧化物歧化酶(Super Oxide Dismutase,SOD),过 氧 化 氢 酶 (Catalase,CAT),谷胱甘肽过氧化物酶 (GlutathionPeroxidase,GSH-PX)等。
1 材料和方法
1.1 实验对象
8周龄SPF级健康雄性SD大鼠40只,由北京维通利华实验动物技术有限公司提供,许可证号为SCXK(京)2012-0001。 体重(230±7)g。 于 SPF 级实验室内进行实验。大鼠常规分笼饲养,每笼5只,自由饮水饮食,专人定期更换饲料和垫料,室温23~25℃,相对湿度45%~55%,每天光照时间12 h。饲养室、用具等定期消毒灭菌。
1.2 实验动物分组和运动干预
大鼠购入后进行适应性喂养3 d,使大鼠适应动物房环境。3 d后所有的大鼠进行7 d的适应性跑台训练,训练方案为每天训练15 min,跑台速度为15 m/min,跑台坡度为0°。适应性训练后,选取适应跑台训练的大鼠30只,随机分为3组:对照组 (Control,C)、大强度训练后自然恢复组(Quiet Rest after High Intensity Training,HQ)、大强度训练后微压氧恢复组 (Mild-pressure Hyperbaric Therapy after High Intensity Traininng,HM),每组 10只。 大强度训练后HQ在大强度运动后自然恢复,大强度训练后HM组在大强度训练后放入微压氧仓恢复1 h。
采用Bedford训练方案,对HQ组和HM组大鼠进行大强度跑台训练[4]。每天上午的8:00~12:00之间进行训练,训练周期为8周,每周训练5 d,每天60 min,运动强度为 26.8 m/min,坡度为 10°(最大摄氧量约为81.00%±3.5)。在训练的开始先以15 m/min速度跑5 min,随后在5 min内逐渐增至26.8 m/min,维持直至训练结束。最后一次跑至力竭,记录力竭时间。HM组每次训练结束后立即放入微压氧仓 (型号:OBI-IF),购自氧沐国际高新技术(北京)股份有限公司,恢复1 h。微压氧仓氧浓度为26%左右,压强为3.6 PSI。力竭标准:(1)动物跟不上预定的跑速,先后滞跑道后1/3处达6次以上,声、光、电刺激驱赶均无效;(2)停止跑台运动后俯卧位,呼吸深急、幅度大,神情倦怠、腹卧位跑、垂头等,对刺激反应迟钝,翻正反射消失。
1.3 取材
各运动实验组大鼠均在运动实验后恢复24 h取材。大鼠腹腔注射10%水合氯醛,按40mg/100g体重剂量注射麻醉。麻醉好后迅速剥离右侧腓肠肌,用生理盐水清洗、滤纸吸干后分为两部分,其中一部分放在冻存管中保存于-80℃冰箱中,用于骨骼肌氧化应激指标的检测,一部分放置于盛有4%多聚甲醛的广口瓶中常温保存,用于石蜡切片病理学检查。
1.4 测试指标及方法
1.4.1 氧化应激指标检测
MDA含量采用TBA法测定,SOD活性采用WST-1法,CAT的测定采用可见光法,GSH-PX的测定采用比色法。SOD活性使用酶标仪 (赛默飞,Wellscan)检测,其余使用分光光度计(Unico,7200)检测。试剂盒均购自南京建成生物工程研究所。
1.4.2 骨骼肌组织学制备
将固定好的大鼠腓肠肌依次经脱水、组织透明、浸蜡、包埋、切片、脱蜡、水化、苏木素染色、分化、伊红染色、脱水、透明、封片,制成HE染色切片,光学显微镜下观察、摄取图像。
1.5 统计学分析
所有数据应用SPSS19.0统计软件处理,每组数据用均数±标准差(X±SD)表示,力竭时间的比较采用独立样本t检验,其他指标采用单因素方差分析法比较组间差异,以P<0.05认为具有显著性差异。
2 实验结果
2.1 大鼠的一般状况
经过8周的实验,对照组大鼠神态安静,状态良好,饮食饮水正常,皮毛光亮整洁,反应敏捷,眼睛有神;HQ组和HM组大鼠出现懒动倦怠,饮食饮水减少,毛发无光泽,双眼暗淡无光,个别大鼠出现便溏,自主活动减少,反应能力降低,这些表现以HQ组大鼠尤为明显。
2.2 微压氧对大鼠力竭时间的影响
运动耐力是评估抗疲劳效果的重要参数,运动至力竭时间的长短可以作为评估运动耐力和疲劳的指标。由表1可见,HM组大鼠与HQ组大鼠比较,大鼠在跑台上跑至力竭的时间有明显延长,差异有统计学意义(P<0.05)。结果表明微压氧可以增强大鼠运动耐力和抗疲劳的效果。

表1 不同恢复方式大鼠力竭时间的比较(X±SD)Table I Comparison between the Time to Exhaustion of Rats Using Different Recovery Methods(X±SD)
2.3 微压氧对大鼠腓肠肌中MDA含量及抗氧化酶活性的影响
2.3.1 微压氧对丙二醛(MDA)含量的影响
MDA是细胞脂质过氧化的一个重要产物,是衡量体内自由基代谢和机体受损程度的一个重要指标。由表2可知,HQ组大鼠MDA含量显著高于C(P<0.05),HM组MDA含量低于HQ组,具有显著性差异 (P<0.05),而大强度训练后 HM 组大鼠MDA含量与C相比没有显著性差异,表明大强度训练可以引起MDA含量升高,而微压氧可以减少MDA含量,减少脂质过氧化反应。
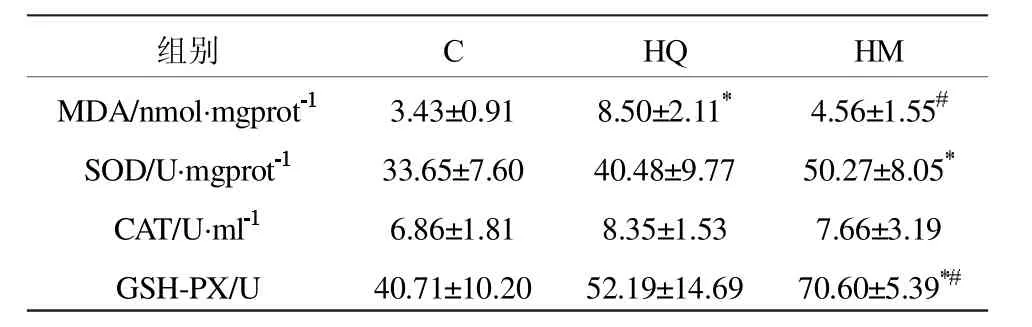
表2 各组大鼠腓肠肌中MDA含量及抗氧化酶活性测试结果(X±SD)Table II MDA Content in the Gastrocnemius of the Different Group Rats and the Test Result of the Activity of Antioxidant Enzyme(X±SD)
2.3.2 微压氧对抗氧化酶活性的影响
机体抵抗自由基造成的细胞损伤主要靠自身的抗氧化防御系统,包括酶促系统和非酶促系统。酶促系统主要包括:超氧化物歧化酶(SOD),过氧化氢酶(CAT),谷胱甘肽过氧化物酶(GSH-PX)等。
由表2可知,HM组与G组相比SOD活性显著性增高(P<0.05),而HQ组与对照组相比没有显著性差异。结果表明微压氧可促进SOD活性增加。
由表2可知,C组、大强度训练后HQ组和HM组大鼠CAT活性没有显著性差别。
由表2可知,大强度训练后HM组GSH-PX活性高于C组,差异有统计学意义(P<0.05);而HQ组虽有升高,但与C组相比不具有统计学意义。HM组与HQ组相比,GSH-PX活性显著性升高 (P<0.05)。结果表明,微压氧可显著提高GSH-PX的活性。
2.4 腓肠肌组织形态学改变
根据图1我们可以看到对照组大鼠骨骼肌结构正常,在纵切片上可见排列紧密、规律的纵向肌纤维,肌纤维粗细均匀,肌间隙大小基本一致。明暗相间的肌横纹清晰、整齐。大强度训练后HQ组骨骼肌肌间隙变大,横纹消失,肌核分布不均,细胞核聚集;大强度训练后HM组与安静恢复相比,症状得到改善,间质水肿轻,肌核分布较均匀,损伤明显低于HQ组。
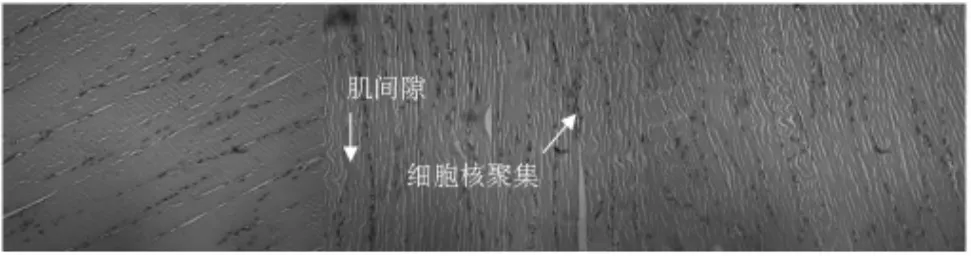
图1 腓肠肌纤维HE染色结果(×200)Figure 1 HE Staining Result of Gastrocnemius Fibre(×200)
3 分析讨论
3.1 力竭时间的比较
运动至力竭的时间是机体运动能力的综合表现,其不仅反映机体抗疲劳的能力,也反应机体的抗应激能力及对不良环境的适应能力。本实验研究发现:HM组与HQ组比较,大鼠跑至力竭时间明显延长,具有显著性差异(P<0.05)。说明大强度训练后微压氧恢复能够显著提高大鼠力竭运动时间,增强大鼠的运动能力。我们的研究结果与彭兆云等[5]的研究结果一致,他们发现高压氧预处理可以延长小鼠的游泳力竭时间,郭洋琴[6]、滕进忠等[7]的研究结果也证实高压氧可以延长大鼠游泳至力竭时间,提高大鼠运动耐力。我们推测可能是与通过加强机体清除自由基的能力,促进毛细血管增生、从而改善骨骼肌缺血缺氧有关。
3.2 微压氧对大鼠腓肠肌中MDA含量及抗氧化酶活性的影响
长时间、力竭运动会造成机体抗氧化能力下降,自由基生成与清除失去平衡,致使机体自由基产生过多,在体内堆积。过多的自由基会加剧细胞的脂质过氧化反应,导致细胞的结构和功能受到损害,引起生物膜的功能障碍,使细胞内外离子转运发生紊乱,导致运动性疲劳。大多数研究中以代谢过程中的脂质过氧化产物为测定物和体内的酶类抗氧化物质等来评价体内的抗氧化状态。
许多研究显示,高强度运动和力竭运动都会导致体内氧化应激反应,造成体内自由基生成增多。Patlar等的研究中,健康男性采用Bruce方案进行每周一次的力竭运动,运动前和后采集血样,发现与静止状态相比,力竭运动导致MDA上升,并具有显著性差异[8]。赵越越的研究中,大强度游泳运动会造成运动员体内自由基增多,抗氧化能力下降,出现脂质、蛋白质和DNA氧化损伤[9]。Jówko等的研究中,运动员进行重复的冲刺跑测试(4×15 s,间歇1 min),发现在冲刺跑后5 min以及24 h后,血清中MAD显著性升高[10]。本研究与上述研究结果一致,大强度力竭运动导致骨骼肌MDA含量显著上升,而HM组MDA含量与C组没有显著性差异。HM组SOD活性显著性高于C组,GSH-PX活性显著高于C组和HQ组。研究结果表明微压氧可以调节肌肉抗氧化酶的活性,减少氧化应激反应,从而起到减少骨骼肌损伤,提高运动能力的作用。Gregorevic等研究了高压氧对于抗氧化酶活性的影响[11]。他们发现重复性吸入高压氧可以上调趾长伸肌肌肉和比目鱼肌抗氧化酶的活性。Kim等研究了微压氧对氧化应激及疲劳的影响[2]。所有参与者在微压氧前后进行指标测评。结果活性氧代谢物(ROM)在微压氧前后有显著性差异。结果揭示微压氧可以有效的减少氧化应激。然而,在本研究中,HM组CAT活性与C组和HQ组没有显著性差别,可能是CAT发挥作用具有一定的阶段性和条件性。综上所述,大强度运动造成骨骼肌氧化应激反应,而微压氧可上调抗氧化酶活性,从而维持自由基生成与清除之间的平衡。其机制可能是微压氧可减少酸性代谢产物的堆积;提高组织血氧含量,促进线粒体氧化功能;提高机体的抗氧化系统,加强清除自由基的能力。
3.3 微压氧对大鼠骨骼肌组织形态学的影响
苏木精-伊红染色简称HE染色,是生物学和医学的细胞与组织学最广泛应用的染色方法。染色结果为细胞核呈蓝色,细胞浆、肌肉、结缔组织等呈不同程度的红色。通过HE染色可以观察骨骼肌组织的结构,如肌外膜、肌核、肌纤维的形态及间质小管、炎症细胞等。本研究中,C组大鼠骨骼肌结构正常,肌纤维排列紧密、规则、粗细均匀,肌间隙大小基本一致。肌核呈扁椭圆形,均匀分布在纤维周围的肌膜下。大强度训练后HQ组肌纤维肿胀,肌核分布不均,出现核聚集,肌间质水肿、炎症细胞浸润、小血管扩张。大强度训练后HM组与HQ组相比,症状得到改善,损伤明显低于HQ组。郭洋琴等的研究中,观察了高压氧对于游泳力竭大鼠肝脏、骨骼肌和肾脏组织形态结构,发现高压氧恢复组肝脏、骨骼肌和肾脏损伤程度均轻于疲劳组[6]。滕进忠等的研究也发现高压氧对于疲劳大鼠肾脏具有保护作用,明显改善肾脏组织的病理变化,起到保护疲劳大鼠肾脏组织的作用[7]。微压氧对骨骼肌组织的保护作用可能是通过提高机体抗氧化酶活性,加强机体清除自由基的能力,减轻自由基对于细胞膜的损害,从而保持细胞的完整结构,维持身体的机能。
4 结论
4.1 大强度训练可造成骨骼肌氧化应激损伤,造成运动能力下降。
4.2 微压氧可提高骨骼肌抗氧化酶活性,减少骨骼肌脂质过氧化反应,提高运动能力。
[1]Reilly T.,Ekblom B.The use of recovery methods postexercise[J].J.Sport Sci.,2005,23(6):619-27.
[2]Kim S.,Yukishita T.,Lee K.,et al.The Effect of Mild-Pressure Hyperbaric Therapy(Oasis O2)on Fatigue and Oxidative Stress[J].Health,2011,3(7):432-436.
[3]Sun Y.,Cui D.,Zhang Z.,et al.Attenuated Oxidative Stress following Acute Exhaustive Swimming Exercise Was Accompanied with Modified Gene Expression Profiles of Apoptosis in the Skeletal Muscle of Mice[J].Oxid Med Cell Longev,2016,(1):1-8.
[4]Bedford T.G.,Tipton C.M.,Wilson N.C.,et al.Maximum oxygen consumption of rats and its changes with various experimental procedures[J].J.Appl.Physiol.,1979,47(6):1278-1283.
[5]彭兆云,杜晶,孙学军,等.高压氧预处理对小鼠运动耐力的影响[J].第二军医大学学报,2006,(01):62-64.
[6]郭洋琴.高压氧抗大鼠运动性疲劳的效应及机制研究[D].江西科技师范大学,2012.
[7]滕进忠,袁春华,郭洋琴,等.高压氧对疲劳大鼠肾损伤的保护作用研究[J].中国运动医学杂志,2013,(06):525-528.
[8]Patlar S.,Baltaci A.K.,Mogulkoc R.Effect of vitamin A administration on free radicals and lactate levels in individuals exercised to exhaustion[J].Pak.J.Pharm.Sci.,2016,29(5):1531-1534.
[9]赵越越.不同时相补充氢水对游泳运动员大强度运动后自由基代谢的影响[D].苏州大学,2014.
[10]Jowko E.,Dlugolecka B.,Makaruk B.,et al.The effect of green tea extract supplementation on exercise-induced oxidative stress parameters in male sprinters[J].Eur.J.Nutr.,2015,54(5):783-791.
[11]Gregorevic P.,Lynch G.S.,Williams D.A.Hyperbaric oxygen modulates antioxidant enzyme activity in rat skeletal muscles[J].Eur.J.Appl.Physiol,2001,86(1):24-27.
