沉淀池排泥水中二氯乙酰胺前体物研究
2018-03-28刘海燕张绪婷李士其侯兵伟
刘海燕,鲍 娟,张绪婷,李士其,侯兵伟,林 涛
(1. 南京水务集团有限公司,江苏 南京 210002;2. 中设设计集团股份有限公司,江苏 南京 210014;3. 河海大学环境学院,江苏 南京 210098)
生活饮用水卫生标准的提高和节水型社会的建设使饮用水安全保障和水厂生产废水的资源化利用技术不断受到关注[1-2]。在饮用水处理和排泥水资源化利用中新型含氮消毒副产物(N-DBPs)不断被检出[3-5],由于其毒性远高于常规的含碳消毒副产物,而成为行业研究的新热点。卤代乙酰胺是饮用水中已发现的主要含氮类消毒副产物,其前体物的水质特性和去除已为业内广泛关注,其中二氯乙酰胺(dichloro-acetamide, DCAcAm)因其在卤代乙酰胺类物质中检出频率高、毒性大而成为研究的焦点,但目前针对DCAcAm前体物的研究尚不全面[6]。Chu等[7-8]对原水中不同溶解性有机组分生成卤代乙酰胺的贡献率进行研究,结果表明,在相同氯化条件下亲水性有机酸类的卤代乙酰胺生成势最大;亲水性有机物中大部分属于蛋白芳香类有机物和溶解性微生物代谢物,此类有机组分在消毒时形成的含氮副产物浓度最高,通过对主要前体物的控制,可实现DCAcAm生成势(DCAcAmFP)的降低。ZHAO等[9]研究结果表明,分子量小于1 kDa的有机物组分占比最大,分子量小于1 kDa和大于10 kDa组分的DCAcAmFP较高,即该组分是DCAcAm的主要前体物质。
综上可见,含氮有机物是DCAcAm的主要前体物来源,但水质差异会导致DCAcAm前体物特性有所不同。针对不同的水处理对象,了解其水中DCAcAm主要前体物的水质特性,对指导水处理工艺的净化过程具有重要意义。目前对含氮消毒副产物前体物的研究多集中在地表水源的水处理技术,而针对给水厂生产废水(如沉淀池排泥水)中含氮消毒副产物及其主要前体物的研究鲜有报道。笔者研究排泥水中含氮消毒副产物前体物的水质特性,以期为保障排泥水的安全回用提供借鉴。
1 实验材料与方法
1.1 水样的收集与处理
试验水样均取自南方S饮用水处理厂。水样在2 h之内运送至实验室进行水质检测。预处理用真空抽滤机使水样通过0.45 μm微孔滤膜,去除颗粒物杂质。
1.2 分子荧光光谱测定
在室温(25℃)下通过带有氙气光源的三维分子荧光吸收光谱仪(日立F-7000)测定分子荧光吸收强度。三维荧光光谱中的实验参数设定:发射波长Em和激发波长Ex的范围均在200~600 nm,并且步长设定为5 nm,扫面速度为1 200 nm/min。
1.3 有机物分子量分布测定
在有机物分子量分布测定实验中,经0.45 μm滤膜过滤后的水样中的有机物被截留分子量分别为10、5、3和1 kDa 的超滤膜切割分组。切割后的有机物组分的分子量分别为大于10、5~10、3~5、1~3和小于1 kDa。
1.4 有机物亲疏水性测定
采用固相萃取法对有机物进行亲疏水性、酸碱性分级,经0.45 μm滤膜截留后的水样通过3种具有不同吸收特性的树脂顺序萃取吸附。3种树脂吸附柱分别为[10]:非离子型树脂 DAX-8 (SUPELCO),阳离子交换树脂AG-MP-50 (Bio-Rad),弱阴离子交换树脂 WA-10 (SUPELCO)。
1.5 DCAcAm生成势及检测
用纯水将5% NaOCl溶液进行稀释。将预处理后的水样倒入容积为2 000 mL的磨口琥珀瓶中,加入稀释后的NaOCl溶液,用NaHCO3缓冲液将pH值调节成7.5左右,室温、黑暗条件下反应24 h。加氯量根据式(1)计算,具体的操作步骤见文献[11]。
ρ(Cl2)=3ρ(DOC)+7.6ρ(NH3-N)+10
(1)
式中:ρ(Cl2)、ρ(DOC)、ρ(NH3-N)分别为溶解性有机碳及Cl2、DOC和NH3-N的质量浓度。
DCAcAm采用安捷伦7890B型气相色谱与微型电子捕获检测器结合进行检测。采用微型取样器抽取2 mL样品进样,样品中的DCAcAm由HP-5(30 m×0.25 mm×0.1 μm)的毛细管柱分离。气相色谱进样口温度设置为235℃,微型电子捕获检测器温度设置在250℃,进样采用无分流进样。
2 结果与讨论
2.1 沉淀池排泥水中含氮有机物的水质特性
表1为原水及沉淀池排泥水含氮污染物水质特性。由表1可见,沉淀池排泥水中的DON质量浓度和DCAcAmFP都要高于相应原水。
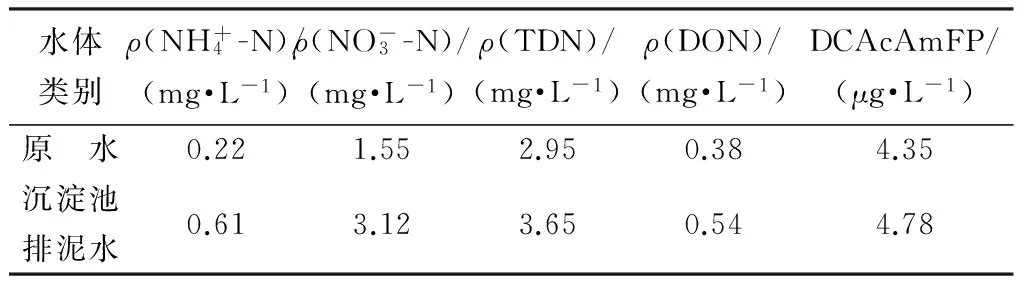
表1 原水及沉淀池排泥水含氮污染物水质特性
沉淀池排泥水中DON的分子量分布结果表2所示,沉淀池排泥水和原水中DON分子量分布结果相似,即分子量小于3 kDa的都占DON的大部分(占比分别为66.66%和51.06%),排泥水中小分子量DON比例高于原水。原水进入混凝前采用高锰酸盐预处理,氧化后大分子有机物变成小分子,部分小分子有机物在混凝沉淀中与大颗粒物质一起被去除,成为排泥水中主要的有机物组成。

表2 原水及沉淀池排泥水中DON分子量分布特性
如表3所示,沉淀池排泥水中亲水性DON占总有机物的比例最高,达到64.58%。这与原水中相应组分的特性相似,但亲水性有机物占比更高。亲水性DON主要是蛋白质或氨基酸类和微生物代谢产物。亲水性DON大量存在会导致随后的氯消毒过程中形成较多的DCAcAm等含氮消毒副产物。这类污染物又是常规混凝沉淀过滤工艺难以有效去除的。因此,在考虑沉淀池排泥水回用时必须通过降低亲水性DON的含量来降低DcAcAmFP。
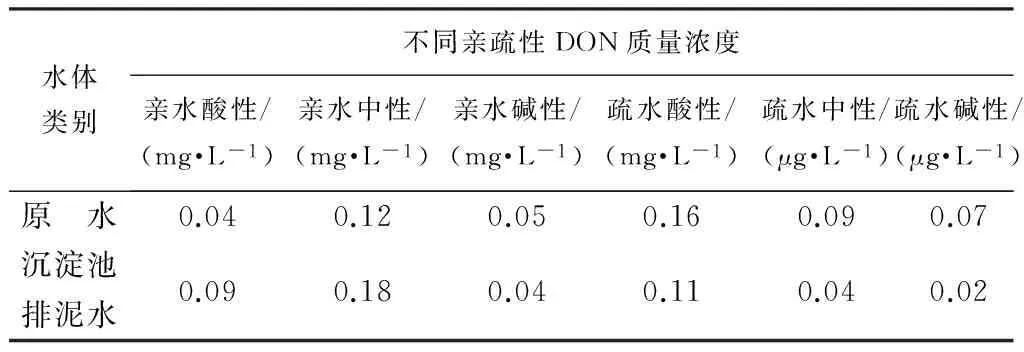
表3 原水及沉淀池排泥水中亲疏水性DON分布特性
图1为沉淀池各时段排泥水的三维荧光吸收光谱图,表4为各时段排泥水的三维荧光光谱中各个区域的荧光积分结果变化情况。从图1可以看出,沉淀池排泥水的三维荧光光谱图中有两个强荧光吸收强度的特征吸收峰(Ex/Em=225 nm/305 nm,Ex/Em=275 nm/305 nm),一个荧光吸收较弱吸收峰(Ex/Em=235 nm/415 nm)。根据chen等[12]的划分结果可知,两个强荧光吸收强度的特征吸收峰为氨基酸类有机物;另一个弱吸收峰为富里酸类有机物。表4的荧光区域积分结果很直观地显示各组分所占比例,氨基酸类含氮有机物占比超过48%,而该类污染物是常规处理工艺难以有效去除的,因此,沉淀池排泥水不能直接回用。

图1 沉淀池排泥水三维荧光光谱图
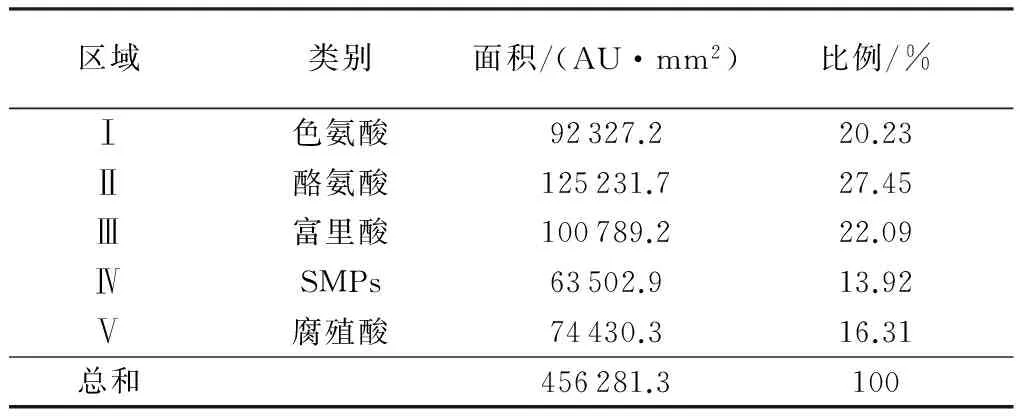
区域类别面积/(AU·mm2)比例/%Ⅰ色氨酸92327.220.23Ⅱ酪氨酸125231.727.45Ⅲ富里酸100789.222.09ⅣSMPs63502.913.92Ⅴ腐殖酸74430.316.31总和456281.3100
2.2 沉淀池排泥水消毒副产物生成势
如图2所示,沉淀池排泥水中典型的消毒副产物总三卤甲烷的生成势(THMFP)和DCAcAmFP均随着排泥过程的进行呈现不断降低趋势。但DCAcAmFP的变化幅度明显小于相应的THMFPs,这与排泥水中存在的特征有机物种类相关。研究表明,三卤甲烷的前体物为能被混凝沉淀处理工艺有效去除的强疏水性天然有机物NOM中的腐殖酸和富里酸类,这些碳碳不饱和双键含量较高的有机物更容易与氯发生反应生成三卤甲烷,是生成三卤甲烷的主要前体物质[13]。而DCAcAm的主要前体物为常规处理工艺难以有效去除的亲水性小分子量的含氮有机物。
2.3 排泥水中消毒副产物前体物特性
已有的研究表明控制DCAcAm主要前体物成为降低DCAcAmFP的最有效途径。因此需要对沉淀池排泥水中DCAcAm前体物进行研究,以期得出主要前体物的组分特性,为DCAcAmFP的减量控制提供科学依据。

图3 沉淀池排泥水中DCAcAmFP与水中w(DON)/w(DOC)值之间的相关性
如图3 所示,沉淀池排泥水中DCAcAmFP随着w(DON)/w(DOC)值的增加而增大,说明DCAcAmFP与w(DON)/w(DOC)值之间的关系存在很强的线性关系(R2=0.868)。研究结果表明DCAcAm的主要前体物为蛋白质、氨基酸、微生物代谢产物类陆源有机物。Chu等[16]研究发现夏季和初秋季节天然水体中氨基酸和蛋白质类有机物存在量很高,可能是由于温度较高有利于水体中微生物代谢活动的进行。
依据亲疏水性和酸碱性将沉淀池排泥水有机物分为疏水酸性(HPOA)、疏水碱性(HPOB)、疏水中性(HPON)、亲水酸性(HPIA)、亲水碱性(HPIB)、亲水中性(HPIN)组分后进行生成势试验,各组分与消毒副产物生成势之间的结果见表5和表6。
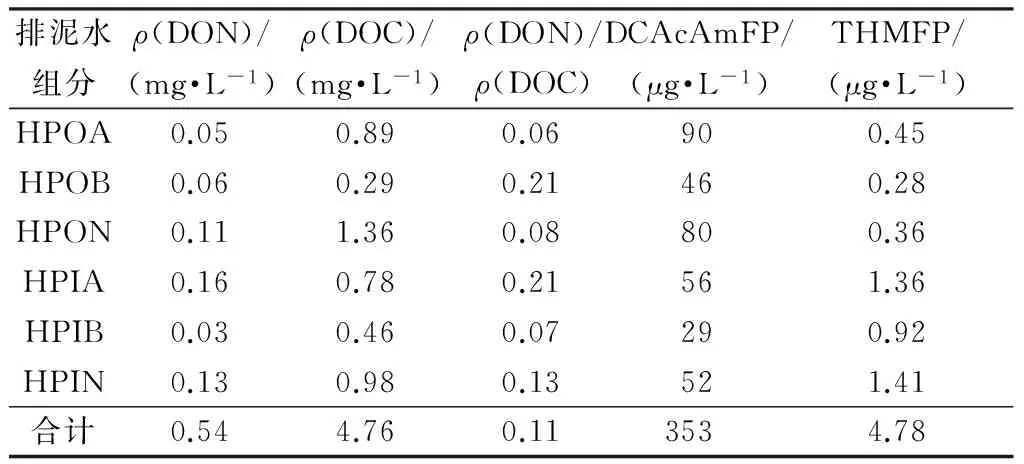
表5 沉淀池排泥水的有机物特征及氯消毒副产物
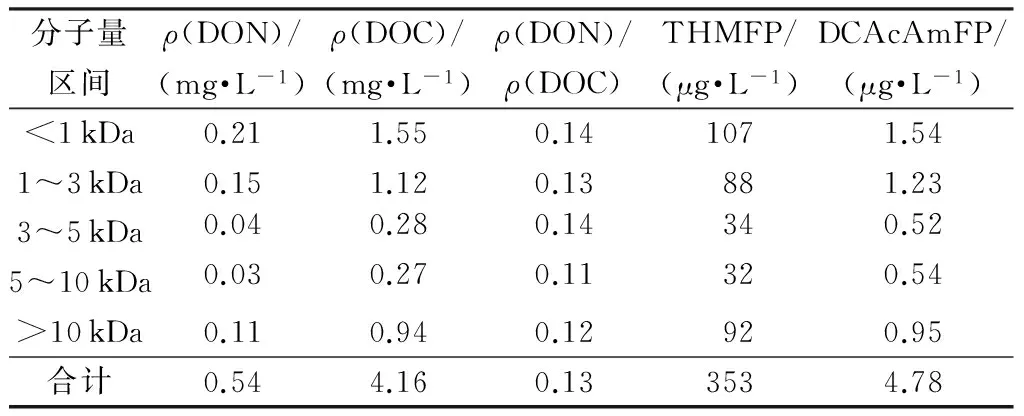
表6 沉淀池排泥水的有机物特征及氯消毒副产物
表5和表6中数据显示,三卤甲烷的主要前体物为疏水酸性和疏水中性及分子量小于3 kDa和大于10kDa,这类物质主要是天然腐殖酸;与前人的研究结果一致[17]。研究认为,不同有机成分与氯作用生成的三卤甲烷的含量不同,富里酸的三卤甲烷生成量最大,而腐殖酸、亲水酸和其他亲水物质的三卤甲烷生成量较小[13]。可见, 富里酸是原水中加氯消毒时产生三卤甲烷的主要前体物质。排泥水中DCAcAm的主要前体物质为亲水中性、亲水酸性类,分子量小于3 kDa和大于10 kDa,主要为蛋白质、氨基酸和有机胺类含氮有机物[16]。因此,在考虑回用安全性时,应重点控制此类物质以期降低消毒副产物生成潜能。
3 结 论
沉淀池排泥水中的DON高于相应原水中的含量。沉淀池排泥水和原水中DON分子量分布结果相似,即分子量小于3 kDa的都占DON的大部分(分别为66.66% 和51.06 %)。沉淀池排泥水中亲水性DON占总有机物的比例最高,达到约64.58%。在亲水性DON中亲水中性又占有绝大部分,达到64.58%,该类物质主要是蛋白质或氨基酸类和微生物代谢产物。因此,沉淀池排泥水中DCAcAm的主要前体物为亲水性、小分子量类含氮有机物。
[1]LEE W,WESTERHOFF P,CROUÉ J P.Dissolved organic nitrogen as a precursor for Chloroform,Dichloroacetonitrile,N-Nitrosodimethylamine,and Trichloronitromet-hane[J].Environment Science Technology,2007,41 (5):5485-5490.
[2]LEE W,KANG S,SHIN H.Sludge characteristics and their contribution to microfiltration in submerged membrane bioreactors[J].Journal of Membrance Science,2003;216(1):217-227.
[3]CHOI J,VALENTINE R L.Formation of N-nitrosodimethylamine (NDMA) from reaction of monochloramine:a new disinfection by-product[J].Water Research,2002,36(4):817-824.
[4]PLEWA M J,WAGNER E D,JAZWIERSKA P,et al.Halonitromethane drinking water disinfection by-products:chemical characterization and mammalian cell cytotoxicity and genotoxicity[J].Environmental Science and Technology,2004,38(1):62-68.
[5]PLEWA M J,MUELLNER M G,RICHARDSON S D,et al.Occurrence,synthesis,and mammalian cell cytotoxicity and genotoxicity of haloacetamides:an emerging class of nitrogenous drinking water disinfection by-products[J].Environmental Science and Technology,2008,42(3):955-961.
[6]ZHANG H,QU J H,LIU H J,et al.Characterization of isolated fractions of dissolved organic matter from sewage treatment plant and the related disinfection by-products formation potential[J].Journal of Hazardous Materials,2009,164(2/3):1433-1438.
[7]CHU W H,GAO N Y,YANG D,et al.Precursors of dichloroacetamide,an emerging nitrogenous DBP formed during chlorination or chloramination[J].Environmental Science and Technology,2010,44(10):3908-3912.
[8]CHU W H,GAO N Y,DENG Y.Formation of haloacetamides during chlorination of dissolved organic nitrogen aspartic acid[J].Journal of Hazardous Materials,2010b,173(1):82-86.
[9]ZHAO Z Y,GU J D,FAN X J,et al.Molecular size distribution of dissolved organic matter in water of the Pearl River and trihalomethane formation characteristics with chlorine and chlorine dioxide treatments[J].Journal of Hazardous Materials,2006,134(1):60-66.
[10]HUR J,WILLIAMS M A,SCHLAUTMAN M A.Evaluating spectroscopic and chromatographic techniques to resolve dissolved organic matter via end member mixing analysis[J].Chemosphere,2006,63 (3):387-402.
[11]CHU W H,GAO N,YIN D,et al.Formation and speciation of nine haloacetamides,an emerging class of nitrogenous DBPs,during chlorination or chloramination[J].Journal of Hazardous Materials,2013,260(6):806-812.
[12]CHEN W,WESTERHOFF P,LEENHEER J A,et al.Fluorescence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter[J].Environmental Science and Technology,2003,37:5701-5710.
[13]张永吉,武道吉,周玲玲,等.腐殖酸特性及其对三卤甲烷形成的影响[J].中国给水排水,2005,21(1):14-17.(ZHANG Yongji,WU Daoji,ZHOU Lingling, et al.Characteristics of humic dcid and its influence on trihalomethane formation[J].China Water & Wastewater,2005,21(1).14-17.(in Chinese))
[14]CHU W H,LI D M,GAO N Y,et al.The control of emerging haloacetamide DBP precursors with UV/persulfate treatment[J].Water Research,2015,72:340-348.
[15]YU S L,LIN T,CHEN W,et al.The toxicity of a new disinfection by-product,2,2-d ichloroacetamide (DCAcAm),on adult zebrafish (Danio rerio) and its occurrence in the chlorinated drinking water [J].Chemosphere,2015,139:40-46.
[16]CHU W H,GAO N Y,DENG Y,et al.Formation of nitrogenous disinfection by-products from pre-chloramination[J].Chemosphere,2011,85(7):1187-1191.
[17]CHU W H,GAO N,YIN D,et al.Ozone-biological activated carbon integrated treatment for removal of precursors of halogenated nitrogenous disinfection by-products[J].Chemosphere,2012,86(11):1087-1091.
