激动性CD40抗体通过调节Th1/Th2平衡增强抗肿瘤作用的机制研究
2018-03-28
最新研究显示,全球每年新发现约1 400万例肿瘤患者,我国肿瘤的发生率和死亡率也呈逐年升高趋势[1]。由于恶性肿瘤进展快、易复发的特点,使得传统的治疗手段如手术、放疗、化疗等具有一定的局限性,因此通过诱导机体的正向免疫促进对肿瘤细胞的免疫清除作用,已成为近年来肿瘤免疫治疗研究的热点。激动性CD40单链抗体(CD40ScFv)保留单克隆抗体具有活性的ScFv片段,去除全抗体的Fc片段,与激动性CD40单克隆抗体(CD40mAb)相比,其分子量小,易于到达病变部位,在机体代谢中也比较快,不良反应较小。本研究旨在观察激动性CD40单链抗体(CD40scFv)抑制小鼠肿瘤生长情况及对肿瘤组织中Th1和Th2平衡的改变,探讨其通过调节Th1/Th2平衡达到增强抗肿瘤作用的机制,为激动性CD40抗体进一步在临床应用上提供实验基础和理论支持。
1 材料和方法
1.1 材料
1.1.1 实验对象 Balb/C小鼠购自北京维通利华实验动物技术公司,小鼠乳腺癌4T1细胞由天津医科大学第二医院分子影像实验室惠赠,带有CD40scFv基因片段的重组质粒由天津医科大学总医院普通外科研究所惠赠。实验获医院动物保护和应用委员会批准。
1.1.2 主要试剂及仪器 SDS-PAGE凝胶试剂盒(北京Solarbio公司),Ⅳ型胶原酶、Ⅰ型DNA酶(北京So⁃larbio公司),小鼠CD40单克隆抗体(美国R&D Sys⁃tems公司),台式离心机(美国Thermo Electron Corpo⁃ration公司),蛋白电泳仪(美国BIO-RAD公司)。
1.2 方法
1.2.1 CD40ScFv诱导表达与SDS-PAGE检测 将重组质粒pET28a-CD40ScFv转化至大肠杆菌中,带有重组质粒的菌体在IPTG诱导前和诱导后分别离心收集菌体,使用超声波裂解后将上清和沉淀进行SDSPAGE检测。
1.2.2 CD40ScFv的Western blot与BCA蛋白定量检测 行SDS-PAGE电泳后取下凝胶,将PVDF膜、滤纸与凝胶于电转仪器上进行转膜。TBST洗脱PVDF膜,加入抗小鼠单克隆抗体过夜。取出洗脱后加入HRP标记抗小鼠IgG,按照ECL方法进行显色曝光。将纯化后的CD40ScFv蛋白通过BCA蛋白定量试剂盒进行定量检测,通过对比样品的吸光度值与标准曲线,估算样品中CD40ScFv蛋白的浓度。
1.2.3 小鼠乳腺癌4T1细胞复苏、培养与单细胞悬液的制备 取出小鼠乳腺癌4T1细胞冻存管,迅速转移到37℃恒温水浴箱中,待其完全融化后离心,向离心管中滴加3 mL完全培养基,置于恒温培养箱。取出小鼠乳腺癌4T1细胞,置于显微镜下观察细胞生长状态,加入1 mL胰酶-EDTA进行消化,将细胞吹打混匀,制成单细胞悬液。调整细胞浓度至2×108/mL。
1.2.4 Balb/C小鼠皮下成瘤与激动性CD40抗体治疗对Balb/C小鼠右腋下皮肤进行消毒,于消毒部位刺破皮肤并水平进针1 cm,注射单细胞悬液约200 μL。将单细胞悬液接种于15只正常小鼠右腋下,每隔3日观察并记录肿瘤大小的变化。于接种后第9天开始给予干预并分为以下3组:1)CD40ScFv组:给予上述从体外制备的CD40ScFv,治疗剂量为2 μg/g,治疗方式为瘤体注射;2)CD40mAb组:4 μg/g,瘤体注射;3)NS组:给予同体积的生理盐水。
1.2.5 ELISA法检测肿瘤组织IL-12的浓度 剥取皮下肿瘤,剪成1 mm3大小的组织块,秤取400 mg组织块放入组织匀浆器,加入PBS溶液3 mL,研磨制成单细胞悬液,离心并留取上清。将肿瘤组织上清充分混匀,与配置好的标准品加入到酶标孔板中。使用多功能酶标仪测定各孔450 nm处OD值,通过标准曲线及样品的吸光度值计算出肿瘤组织中的IL-12浓度。
1.2.6 肿瘤组织浸润淋巴细胞的分离 将剪碎的肿瘤组织块放入离心管中,加入RPMI 1640培养基、Ⅳ型胶原酶、Ⅰ型DNA酶,吹打混匀。将离心管中的悬液过滤并离心,吸取中间云雾层细胞,该细胞层即为淋巴细胞层。
1.2.7 流式细胞术检测肿瘤组织Th1和Th2 将淋巴细胞层离心后弃去上清,加入500 μL完全培养基,使细胞充分混匀。将细胞悬液加入到流式管中,各管分别加入FITC标记CD4流式抗体。各管离心并弃去上清,使用Fix and Perm重悬细胞并充分混匀,分别加入APC标记的IL-4流式抗体与PE标记的IFN-γ流式抗体,上机。
1.3 统计学方法
运用SPSS19.0软件进行统计学分析。计量资料以表示,组间比较采用单因素方差分析法。以P<0.05为差异具有统计学意义。
2 结果
2.1 CD40ScFv的诱导表达
在25~35 kD诱导前、后的沉淀中有一个明显的条带,符合预计的CD40ScFv蛋白的大小(图1)。
2.2 Western blot检测CD40ScFv蛋白
进一步确定纯化后所得的产物为CD40ScFv目的蛋白,条带大小约为27 kD,与预计的蛋白大小一致(图2)。
2.3 BCA检测CD40ScFv蛋白
CD40ScFv蛋白浓度在562 nm处的吸光度值为0.5083,根据标准曲线计算出的蛋白样品浓度为1.122 mg/mL。
2.4 小鼠乳腺癌4T1细胞培养
小鼠乳腺癌4T1细胞在显微镜下观察生长状态良好,胎盘蓝染色细胞活力在95%以上(图3)。
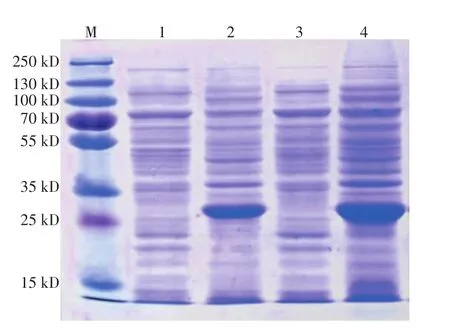
图1 SDS-PAGE检测蛋白表达电泳图
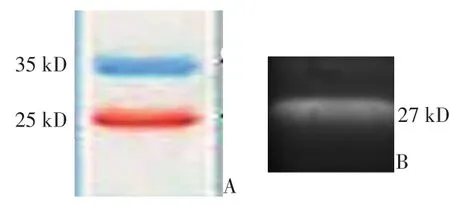
图2 Western blot检测CD40ScFv蛋白表达

图3 显微镜下小鼠乳腺癌4T1细胞(台盼蓝染色×200)
2.5 激动性CD40抗体瘤体注射对肿瘤生长的影响
记录3组的肿瘤体积变化,绘制出小鼠肿瘤生长曲线(图4)。CD40ScFv组与CD40mAb组肿瘤大小均显著小于NS组,差异具有统计学意义(P<0.05),表明激动性CD40抗体可以显著抑制肿瘤的生长。
2.6 ELISA法检测肿瘤组织中IL-12浓度
CD40ScFv组肿瘤组织中的IL-12浓度为(396.27±48.13)pg/mL,CD40mAb组为(457.63±58.37)pg/mL,均显著高于NS组(79.51±14.97)pg/mL,差异具有统计学意义(P<0.05),表明激动性CD40抗体可以显著诱导肿瘤组织中的IL-12表达(表1)。

图4 小鼠肿瘤生长曲线
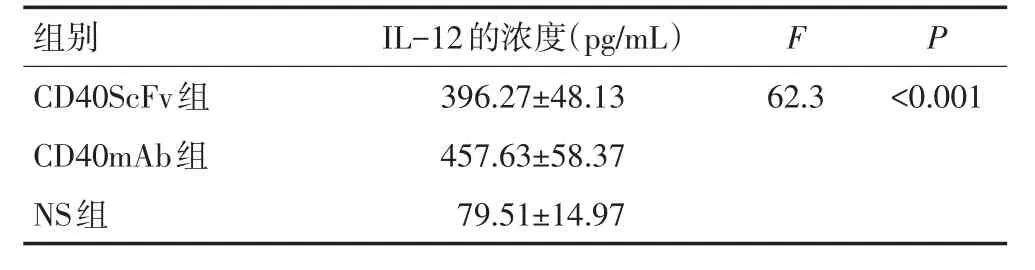
表1 CD40ScFv、CD40mAb与生理盐水对肿瘤组织中IL-12浓度的影响
2.7 流式细胞术检测小鼠肿瘤组织Th1和Th2比值
CD40ScFv组中的Th1/Th2细胞比值为6.32±0.87,CD40mAb组为5.54±0.71,均显著高于NS组1.79±0.38,差异具有统计学意义(P<0.05,表2)。表明激动性CD40抗体可以改变肿瘤微环境中Th1/Th2细胞的失衡,发挥抗肿瘤的作用(图5)。
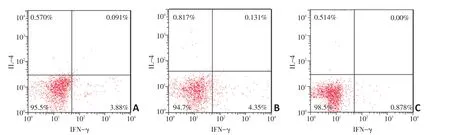
图5 CD40ScFv、CD40mAb与NS组肿瘤组织中Th1/Th2流式细胞图

表2 流式细胞术检测CD40ScFv、CD40mAb与生理盐水对肿瘤组织中的Th1/Th2比值影响
3 讨论
目前,用于免疫治疗的药物主要是单克隆抗体,其能够特异性结合免疫细胞表面抗原,激活机体内的免疫效应细胞,增强对肿瘤细胞的免疫杀伤作用[2],具有特异性强、均一性好等优点。Hodi等[3]报道,细胞毒性T细胞相关抗原4的特异性单克隆抗体ipilimumab已在晚期黑色素瘤Ⅲ期临床试验中进行,接受治疗者与未接受治疗者比较具有总体生存优势。一些CD40单克隆抗体虽然已进入临床试验,并且取得了良好的效果,但因单克隆抗体的分子量大,不能很好透过血管间隙到达肿瘤组织,而且易引起不良反应,表现出一定的局限性[4]。CD40单链抗体(CD40ScFv)保留了单克隆抗体具有活性的功能区域,同时与单克隆抗体相比,其分子量小,易于到达病变部位,在机体代谢中也比较快,不良反应较小。本研究将构建好的原核表达载体转化到大肠杆菌中后进行诱导表达,获得需要的CD40ScFv蛋白。IPTG是一种稳定的蛋白表达诱导剂,从而使CD40ScFv大量表达。
树状突细胞(dentritic cell,DC)是目前已知功能最强的抗原提呈细胞,在诱导CD4+T淋巴细胞活化过程中起着重要的作用。根据所分泌的细胞因子的不同,CD4+T淋巴细胞可分为Th1型和Th2型,Th1细胞分泌IL-2、IFN-γ等细胞因子,主要调节细胞免疫反应,所分泌的细胞因子具有良好的抗肿瘤作用[5]。Th2细胞分泌IL-4、IL-10等细胞因子,所分泌的细胞因子具有抑制肿瘤免疫反应的作用。机体中的Th1与Th2细胞处于动态平衡,其平衡的改变与许多疾病有关,如肿瘤、自身免疫性疾病、移植排斥反应等,这种平衡的改变称为Th1/Th2漂移[6]。Th1/Th2平衡转向以Th2细胞占优势状态,导致Th1/Th2细胞比值下降,这种改变发生于大多数临床肿瘤患者,包括肺癌、淋巴瘤、乳腺癌、膀胱癌、基底细胞癌等[7]。Tosol⁃ini等[8]报道结肠癌患者癌组织中的Th2细胞分泌的细胞因子显著升高,Murakami等[9]报道黑色素瘤患者Th2细胞占优势状态。本研究发现激动性CD40抗体能改变肿瘤组织中Th1/Th2细胞比值,其具体的机制尚不清楚。有研究报道,IL-12是影响Th细胞分化的重要细胞因子,肿瘤微环境中DC等抗原提呈细胞分泌的IL-12下降可能是影响Th细胞分化失衡的重要原因[10]。Shao等[11]报道,TIMP3可以在体外抑制DC活化与成熟,使其下调分泌IL-12等,进而使Th1/Th2比值下降。激动性CD40抗体能够代替CD40配体与DC表面的CD40结合,进而促进DC的活化与成熟,上调IL-12的分泌[12]。
综上所述,激动性CD40抗体通过促进DC活化成熟后分泌IL-12,可能是影响肿瘤微环境中Th1/Th2平衡的重要机制之一。
[1]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115‐132.
[2]Hussein M,Berenson JR,Niesvizky R,et al.A phase I multidose study of dacetuzumab(SGN‐40;humanized anti‐CD40 monoclonal antibody)in patients with multiple myeloma[J].Haematologica,2010,95(5):845‐848.
[3]Hodi FS,O'Day SJ,McDermott DF,et al.Improved survival with ipili‐mumab in patients with metastatic melanoma[J].N Engl J Med,2010,363(8):711‐723.
[4]Zhao Y,Wu T,Shao S,et al.Phenotype,development,and biological function of myeloid‐derived suppressor cells[J].Oncoimmunology,2016,5(2):e1004983.
[5]Fujimura T,Kambayashi Y,Aiba S.Crosstalk between regulatory T cells(Tregs)and myeloid derived suppressor cells(MDSCs)during mela‐noma growth[J].Oncoimmunology,2012,1(8):1433‐1434.
[6]Kovaleva OV,Samoilova DV,Shitova MS,et al.Tumor associated macrophages in kidney cancer[J].Anal Cell Pathol(Amst),2016,2016(2):9307549.
[7]LievenseLA,Bezemer K,Aerts JG,et al.Tumor‐associatedmacrophages in thoracic malignancies[J].Lung Cancer,2013,80(3):256‐262.
[8]Tosolini M,Kirilovsky A,Mlecnik B,et al.Clinical impact of different classes of infiltrating T cytotoxic and helper cells(Th1,th2,treg,th17)in patients with colorectal cancer[J].Cancer Res,2011,71(4):1263‐1271.
[9]Murakami H,Ogawara H,Hiroshi H.Th1/Th2 cells in patients with multiple myeloma[J].Hematology,2004,9(1):41‐45.
[10]Paul WE,Grossman Z.Pathogen‐sensing and regulatory T cells:inte‐grated regulators of immune responses[J].Cancer Immunol Res,2014,2(6):503‐509.
[11]Shao Q,Ning H,Lv J,et al.Regulation of Th1/Th2 polarization by tissue inhibitor of metalloproteinase‐3 via modulating dendritic cells[J].Blood,2012,119(20):4636‐4644.
[12]Matz M,Lehnert M,Lorkowski C,et al.Combined standard and novel immunosuppressive substances affect B‐lymphocyte function[J].Int Immunopharmacol,2013,15(4):718‐725.
