不同种植模式对铅污染土壤微生物数量及酶活性的影响
2018-03-27朱红霞张建强张家洋
朱红霞 张建强 张家洋
(新乡学院生命科学技术学院,河南 新乡 453003)
土壤酶是农业生态系统的重要组分,在土壤养分物质循环和能量流动中起着重要作用。它与土壤微生物共同推动土壤代谢过程,其活性的高低可作为土壤质量的活性指标和土壤肥力的评价指标[1]。土壤受到重金属污染后,土壤脲酶、蔗糖酶、过氧化氢酶反应比较敏感,能反映重金属对土壤微生物活性的毒性效应[2]。土壤微生物作为土壤酶的一个重要来源,可以产生胞外酶,在调节土壤生态系统、维持物质循环稳定、净化土壤污染等多方面扮演着重要角色。而且其对重金属污染的敏感性较强,能反映土壤质量状况,是评价土壤质量的重要生物学指标[3]。针对重金属污染下土壤微生物和酶活性国内外学者进行了大量研究。李伟等[4]研究了锌污染下吊兰生长对土壤微生物数量酶活性的影响,发现种植吊兰的实验组土壤细菌、真菌、放线菌数量及土壤过氧化氢酶、蔗糖酶、脲酶、磷酸酶活性均显著高于未种植的对照组,说明吊兰对土壤重金属锌污染有明显的修复效果。高扬等[5]研究了Cd,Pb单一及复合污染下玉米生长对微生物群落结构及酶活性的影响,表明种植玉米有利于提高重金属污染下的土壤呼吸强度,可减轻 Cd,Pb 对磷酸酶和脲酶的影响。
目前,已有较多关于栽培植物修复土壤重金属污染的研究,但大多数仅研究某一植物单独种植的修复效果,多种植物不同种植模式对重金属污染土壤的修复研究尚不多见。因此,本研究选取对重金属铅有一定耐性的4种本地草本观赏植物白三叶 (Trifoliumrepens)、一串红 (Salviasplendens)、翠菊 (Callistephuschinensis)、鸢尾 (Iristectorum),在土壤铅污染下进行单种和两两混合种植,研究不同模式下根际与非根际土壤微生物数量、酶活性、土壤呼吸作用强度、有效态重金属含量及其他土壤理化性质,以期筛选出修复铅污染土壤的最优种植模式。
1 材料与方法
1.1 试验地概况
供试土壤样地位于新乡市红旗区小店镇北张兴庄村 (北纬35°30′,东经113°87′),该地区属于大陆性季风气候,气温,降水,风等随季节变换显著,四季分明。冬长且冷,雨稀少;夏季炎热,降雨频繁;春天干旱风沙多;秋天凉爽日照长。年平均气温14 ℃,年均降水达606.7 mm。试验地是1个废弃多年的农用蔬菜大棚,周边交通及生活垃圾的堆放对土壤造成了一定的污染。供试土壤基本理化性质为:有机质2.157 g/kg,全氮含量0.98 g/kg,碱解氮含量50 mg/kg,全磷含量0.65 g/kg,速效磷含量10 mg/kg ,全钾含量15.1 g/kg,速效钾含量70 mg/kg,全Pb含量612 mg/kg,有效态铅含量69.216 mg/kg, pH 6.14。以GB 15618—1995[6]作为参照,全Pb含量超出了三级标准 (500 mg/kg)。
1.2 试验材料
白三叶 (Trifoliumrepens)、一串红 (Salviasplendens)、翠菊 (Callistephuschinensis)、鸢尾 (Iristectorum) 4种植物种子均购自新乡市花卉市场。2016年3月中旬将种子播种于育苗盘中,在新乡学院花卉繁育基地的温室内进行催芽育苗。选取白三叶、一串红、翠菊4片真叶展开,苗高5 cm左右,鸢尾苗高5 cm左右的生长健壮,高度基本一致的幼苗进行试验。
1.3 试验设计
2016年4月上旬从试验样地取土,土壤剔除杂物后自然风干,磨碎,过4 mm尼龙筛混匀,装至40 cm × 40 cm × 21 cm的方形种植箱内,每箱装土5 kg。采用根袋 (由400目尼龙网布做成) 区分根际非根际土壤,其中根际土2 kg ,非根际土3 kg。选取符合试验标准的幼苗移栽至种植箱,开始试验。试验设置11个处理,分别为:未种植 (CK)、白三叶单种 (AA)、一串红单种 (BB)、翠菊单种 (CC)、鸢尾单种 (DD)、白三叶与一串红混种 (AB)、白三叶与翠菊混种 (AC)、白三叶与鸢尾混种 (AD)、一串红与翠菊混种 (BC)、一串红与鸢尾混种 (BD)、翠菊与鸢尾混种 (CD)。植物单种时每箱12株,2种植物混种时每种植物各6株。每个处理重复3次。常规养护,根据实际情况不定期浇水,确保田间持水量维持在60%左右,为防止重金属铅淋失,浇水后将渗漏到箱托上的水或土重新倒入种植箱内,以维持重金属铅浓度不变。移植80 d后小心的将植株连根取出,收集根际非根际土壤,风干后磨细,过100目筛,待测。
1.4 指标测定
采用稀释平板计数法[7]对土壤微生物数量进行测定,牛肉膏蛋白胨培养基培养细菌,马丁氏培养基培养真菌、改良的高氏一号培养基培养放线菌。
按照周礼恺[8]《土壤酶学》中的方法测定土壤各种酶活性。土壤脲酶活性以1 g土在37 ℃下培养24 h后释放的NH3+-N的毫克数来表示,过氧化氢酶活性以1 g土样在培养时间2 h内所消耗的0.1 mol/L KMnO4溶液的毫升数表示,土壤蔗糖酶活性以1 g土在37 ℃培养24 h释放葡萄糖的毫克数表示。土壤各项理化性质及重金属含量测定参照 《土壤农化常规分析法》[9]。
1.5 数据处理
利用Excel进行数据统计处理,SPSS 22.0进行多重比较及相关性分析。
2 结果与分析
2.1 不同种植模式对土壤微生物数量分布的影响
不同种植模式对土壤细菌、真菌和放线菌数量的分布产生了显著影响 (表1)。根际细菌数量的变幅为6.460 × 105~8.521 × 105CFU/g,其中一串红单种模式下根际细菌数量最少,白三叶与鸢尾混种最多,白三叶与鸢尾混种模式比对照和一串红单种模式细菌数量分别增加了526.1%和31.9%;且单种和混种模式间差异显著 (P< 0.05);各处理根际细菌数量大小顺序为AD > AB > AC > BC > BD > CD > AA > CC > DD > BB。非根际细菌的数量变幅为4.748 × 105~6.614 ×105CFU/g,鸢尾单种模式下数量最小,白三叶与鸢尾混种模式下数量最大,白三叶与鸢尾混种模式比对照和鸢尾单种模式下细菌数量分别增加了386.0%和39.3%;且各单种模式之间几乎无显著差异,而混种模式下白三叶与鸢尾混种与其他混种模式相比差异显著 (P< 0.05);各处理非根际细菌数量大小顺序为AD > AB > AC > BD > BC > CD > AA > CC > BB > DD。
根际与非根际土壤真菌数量均以白三叶与鸢尾混种模式最多,一串红单种模式最少,且单种和混种模式间存在显著差异 (P< 0.05)。根际真菌数量变幅为1.150 × 103~3.462 × 103CFU/g,白三叶与鸢尾混种模式下真菌数量比对照和一串红单种模式下分别增加507.1%和201.0%;各处理根际真菌数量大小顺序为AD > AC > BD > AB > BC > CD > AA > DD > CC > BB。非根际真菌数量变幅为0.946 × 103~2.608 × 103CFU/g,白三叶与鸢尾混种模式下真菌数量比对照和一串红单种模式下分别增加357.5%和175.7%;各处理非根际真菌数量大小顺序为AD > AC > AB > BD > BC > CD > AA > DD > CC > BB。
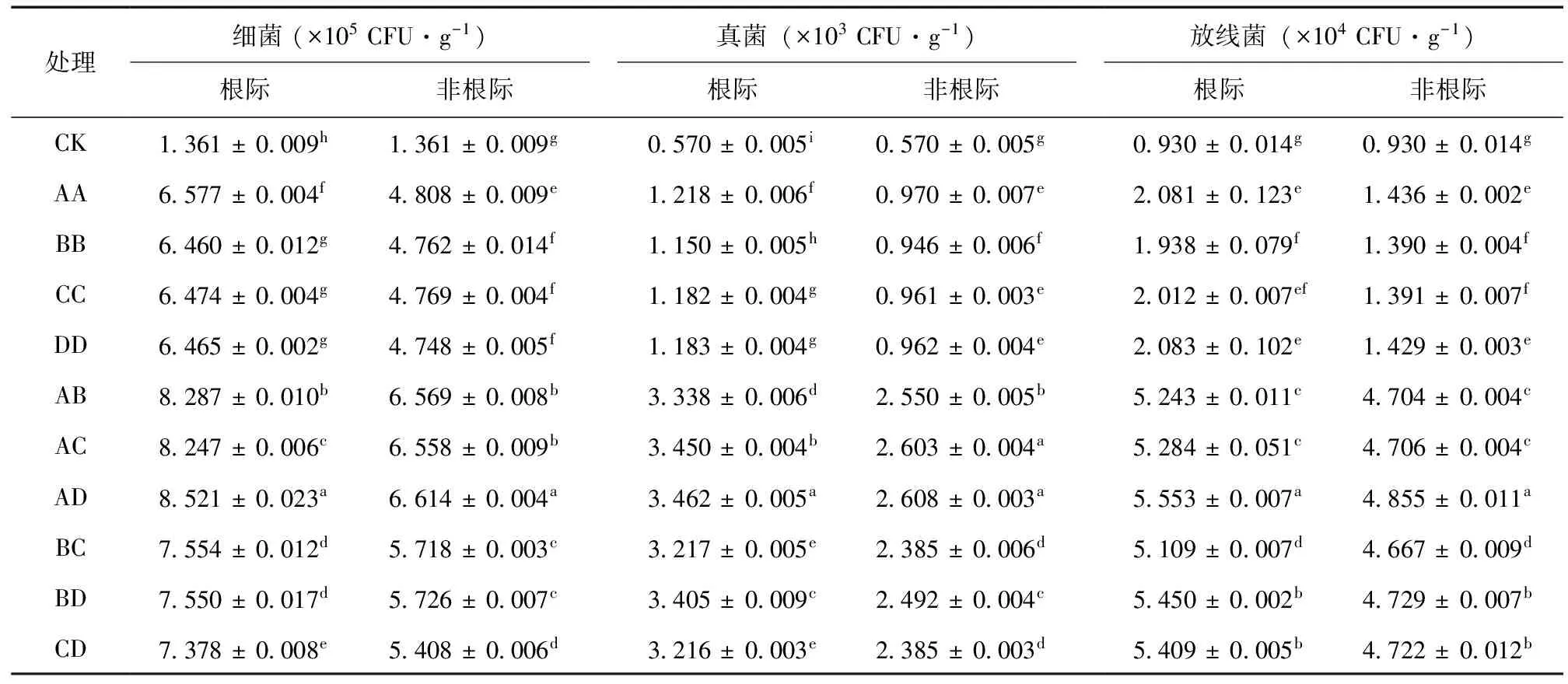
表1 不同种植模式对土壤微生物数量的影响Table 1 Effects of different cropping patterns on soil microbial quantity
注:不同小写字母表示显著差异。
不同种植模式下根际放线菌的数量最多的为白三叶与鸢尾混种模式,数量达5.553 × 104CFU/g,最小的为一串红单种模式,数量达1.938 × 104CFU/g,白三叶单种模式与鸢尾混种模式放线菌数量比对照和一串红单种模式分别增多497.1%和186.5%;且单种和混种模式之间差异显著 (P< 0.05),而混种模式下白三叶与鸢尾混种与其他混种模式相比差异显著 (P< 0.05);各处理根际放线菌数量大小顺序为AD > BD > CD > AC > AB > BC > DD > AA > CC > BB。非根际放线菌的数量最大的仍为白三叶与鸢尾混种模式,数量达4.855 × 104CFU/g,最小的为一串红单种模式,数量达1.390 ×104CFU/g,白三叶与鸢尾混种比对照和一串红单种分别提高422.0%、249.3%;各处理非根际放线菌数量大小顺序为AD > BD > CD > AC > AB > BC > AA > DD > CC > BB。
由此表明,在铅污染下种植植物能有效增加土壤微生物数量,其中以白三叶与鸢尾混种模式效果最好,其次是白三叶与翠菊混种和一串红与鸢尾混种,一串红单种模式效果最差;对照组因受到铅污染影响而没有植物修复,微生物生长遭到抑制,其数量较少。
2.2 不同种植模式对土壤酶活性状况的影响
脲酶主要分解有机态氮转化为铵态氮,其活性可以用来衡量土壤氮素供应水平[10]。不同种植模式根际和非根际脲酶活性均表现为白三叶与鸢尾混种模式下活性最高,其次是白三叶与一串红混种模式。根际脲酶活性变幅为2.166~2.523 mg/(g·d),白三叶与鸢尾混种模式比对照和一串红单种模式下分别增加225.5%和16.5%;单种和混种模式差异显著 (P< 0.05);根际脲酶活性高低顺序为AD > AB > BC > AC > CD > BD > AA > CC > BB > DD。非根际脲酶活性变幅为1.374~1.912 mg/(g·d),白三叶与鸢尾混种比对照和鸢尾单种模式下分别提高146.7%和39.2%;各处理脲酶活性的高低顺序与根际脲酶活性表现相同。可见,不同种植模式均能提高土壤酶活性,改善土壤氮素供应水平,其中混种较单种效果好,并以白三叶与鸢尾混种模式转化有效氮素的能力最好,白三叶与一串红混种模式次之。
根际和非根际蔗糖酶活性表现相似,白三叶与鸢尾混种模式下蔗糖酶活性最高,一串红单种模式下蔗糖酶活性最低。根际和非根际蔗糖酶活性变幅分别为15.315~23.146 mg/(g·d)和11.642~19.764 mg/(g·d);白三叶与鸢尾混种模式下蔗糖酶活性比对照分别提高394.8%和322.5%,比一串红单种模式分别提高51.1%和69.8%,单种和混种模式之间均存在明显的差异 (P< 0.05)。根际蔗糖酶活性高低顺序分别为AD > CD > BC > BD > AC > AB > CC > DD > AA > BB;非根际蔗糖酶活性高低顺序分别为AD > AC > BD > CD > BC > CC > AB > AA > DD > BB。说明白三叶与鸢尾混种模式最有利于土壤蔗糖酶发挥其碳循环功能,一串红单种模式效果最差。
由表2可知,不同种植模式根际和非根际过氧化氢酶活性均表现为白三叶与鸢尾混种模式下活性最高,一串红单种模式下活性最低。根际和非根际过氧化氢酶活性变幅分别为2.209~2.665 mL/(g·h)和1.867~2.433 mL/(g·h),白三叶与鸢尾混种模式下活性比对照分别提高198.4%和178.4%,比一串红单种分别提高20.6%和30.3%;单种和混种模式之间差异显著 (P< 0.05)。
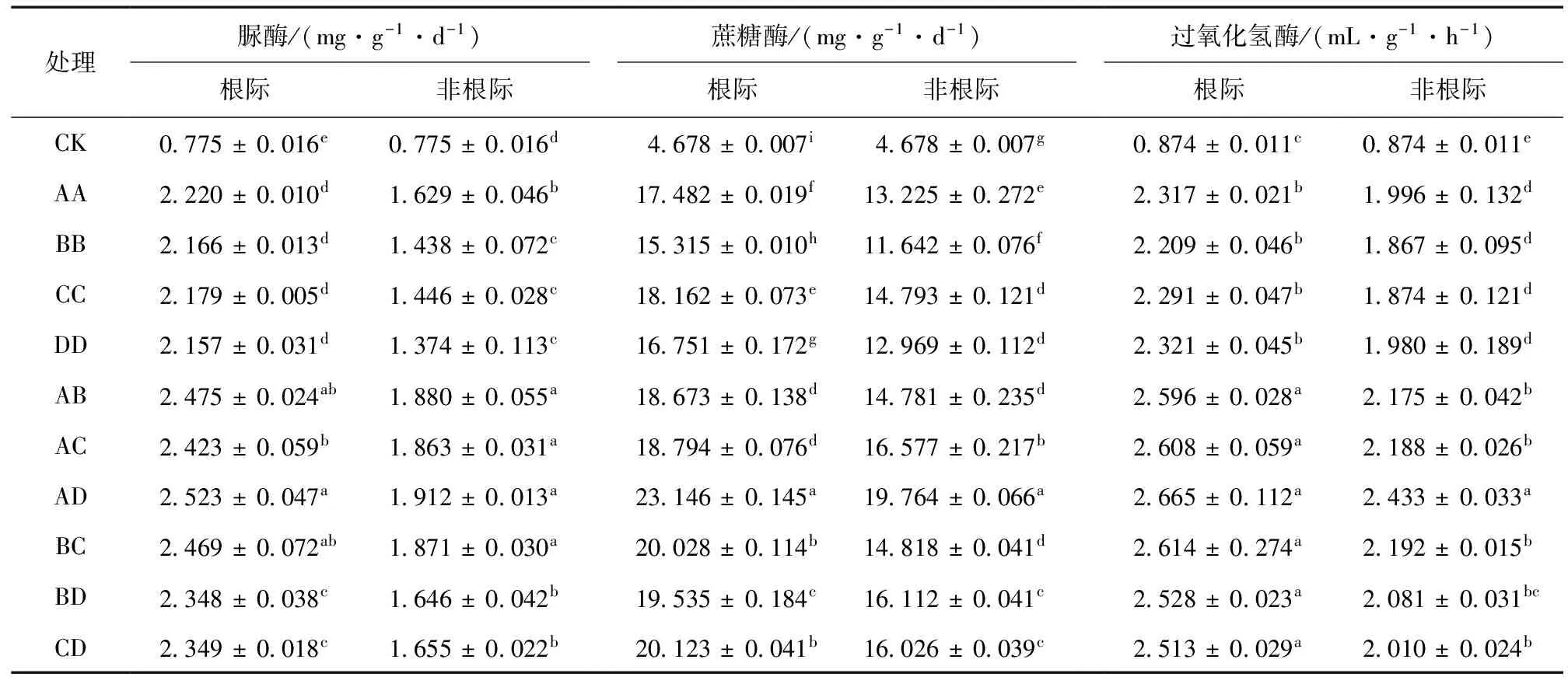
表2 不同种植模式对土壤酶活性的影响Table 2 Effects of different cropping patterns on soil enzymes activities
注:不同小写字母表示显著差异。
由此表明,与对照相比,在土壤铅污染下种植植物可以有效提高土壤脲酶、蔗糖酶、过氧化氢酶的活性,且混种模式较单种模式效果好,其中以白三叶与鸢尾混种模式表现最好,一串红单种模式最差。
2.3 不同种植模式对根际土壤微生物数量与土壤酶活性之间的相关性
由土壤微生物数量与酶活性的双变量相关性分析 (表3) 可以看出,根际与非根际土壤细菌、真菌、放线数量与三种土壤酶活性呈显著正相关关系 (P< 0.05),且与脲酶活性、过氧化氢酶活呈极显著正相关关系 (P< 0.01)。
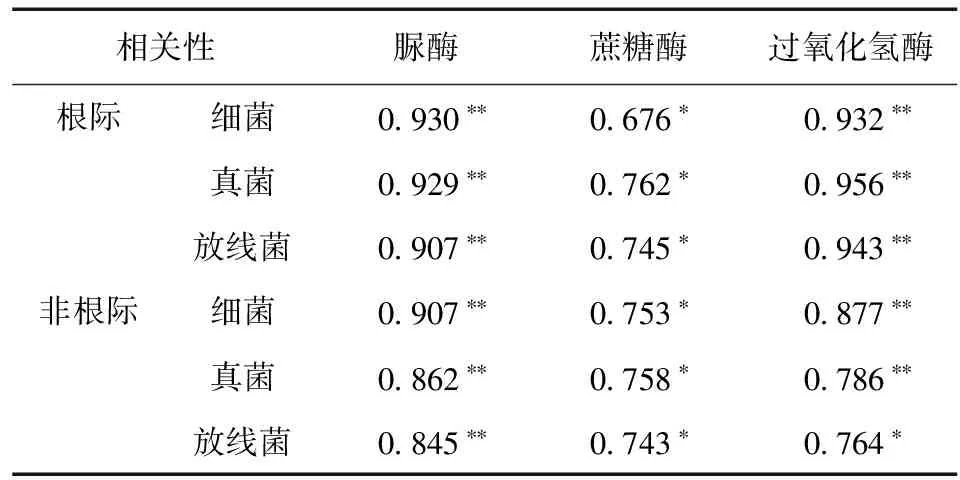
表3 不同种植模式土壤微生物数量与土壤酶活性的相关性分析Table 3 Correlation coeffieients between soil microbial quantityand enzyme activities under different cropping patterns
注:*表示差异显著,**表示差异极显著。
2.4 不同种植模式对铅污染下土壤理化性质的影响
不同种植模式土壤呼吸强度表现出一定的差异 (表4),根际呼吸作用强度 > 非根际呼吸作用强度 > 对照。方差分析结果显示,混种模式、单种模式与对照组之间的差异均达到显著水平 (P< 0.05)。其中AD模式的根际和非根际土壤呼吸作用强度最大,分别是10.784 mgCO2/(kg·h) 和7.274 mgCO2/(kg·h),比对照增加了304.2%和172.6%。不同种植模式根际土壤呼吸作用强度的大小顺序为AD > AB > AC > BC > BD > CD > AA > CC > DD > BB。非根际土壤呼吸作用强度大小顺序,混种模式的与根际土壤表现一致,而单种模式则为AA > BB > DD > CC。表明植物在铅污染的土壤上生长可以改善土壤微生物环境,特别是混种模式能更好提高微生物活性,其中以AD模式最好。
不同种植模式土壤有机质含量表现为根际 > 非根际 > 对照。方差分析结果表明,根际和非根际土壤有机质含量除了DD模式外,各混种模式与其他单种模式均达到了显著水平 (P< 0.05)。根际和非根际有机质含量变幅分别为2.964~3.610 g/kg和2.185~2.747 g/kg,均以AD含量最高,比对照提高67.4%和27.4%。根际土壤有机质含量的大小顺序为AD > DD > AC > BC > BD > CD > AB > CC > AA > BB,混种模式AD最好,单种模式DD次之。非根际土壤有机质含量的大小顺序表现则为AD > AB > DD > AC > BC > BD > CC > CD > BB > AA。表明在铅污染条件下不同种植模式也可不同程度的改善土壤基质状况。
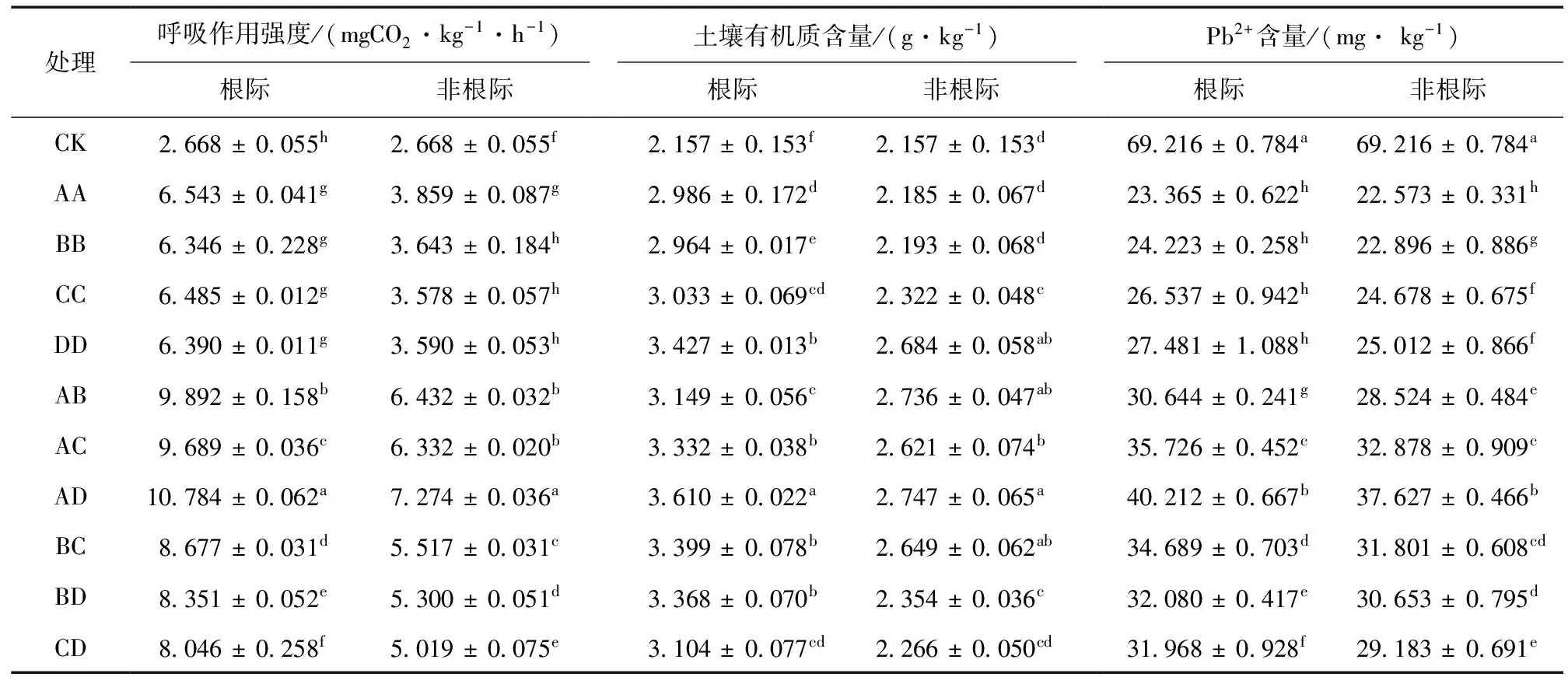
表4 不同种植模式对土壤呼吸作用强度、有机质及有效态铅含量的影响Table 4 Effects of different cropping patterns on soil respiration strength, organic content and bioavailable Pb content
注:不同小写字母表示显著差异。
与对照相比,不同种植模式均降低了根际和非根际土壤Pb2+含量,并且根际土壤中的Pb2+含量整体上大于非根际土壤。其中混种模式较单种模式土壤 Pb2+含量高,不同种植方式下根际土和非根际土Pb2+含量分别为23.365~40.212 mg/kg和22.573~37.627 mg/kg,均以AD含量最高;单种模式与混种模式间差异显著 (P< 0.05)。根际土和非根际土Pb2+含量高低顺序均为AD > AC > BC > BD > CD > AB > DD > BB > CC > AA,非根际土Pb2+含量显著性差异与根际土表现一致。说明植物根系在一定程度上活化和改变了土壤铅的存在形态,更易于被植物吸收,且混种方式下效果更为明显。
种植模式不同,植物种类不同,土壤的理化性质就会有一定的差异 (表5)。不同种植模式根际土壤pH大小表现为对照 > 非根际 > 根际,混种模式低于单种模式,其中AC模式最低,比对照降低0.135个单位,AD次之。不同种植模式根际电导率低于非根际电导率,且低于对照对照;而非根际电导率单种模式高于对照,混种模式低于对照;根际和非根际电导率均以AC模式最低,AD次之,各种植处理之间有一定差异。不同种植模式氧化还原电位除CC模式最高外,表现为对照 >非根际 > 根际;根际和非根际氧化还原电位单种模式之间和混种模式之间差异显著 (P< 0.05)。表明植物根系活动能降低土壤 pH使氧化还原电位及电导率发生变化。
2.5 不同种植模式土壤微生物数量与土壤基本理化性质的相关性
土壤微生物数量与土壤基本化学性质的相关性分析见表6。
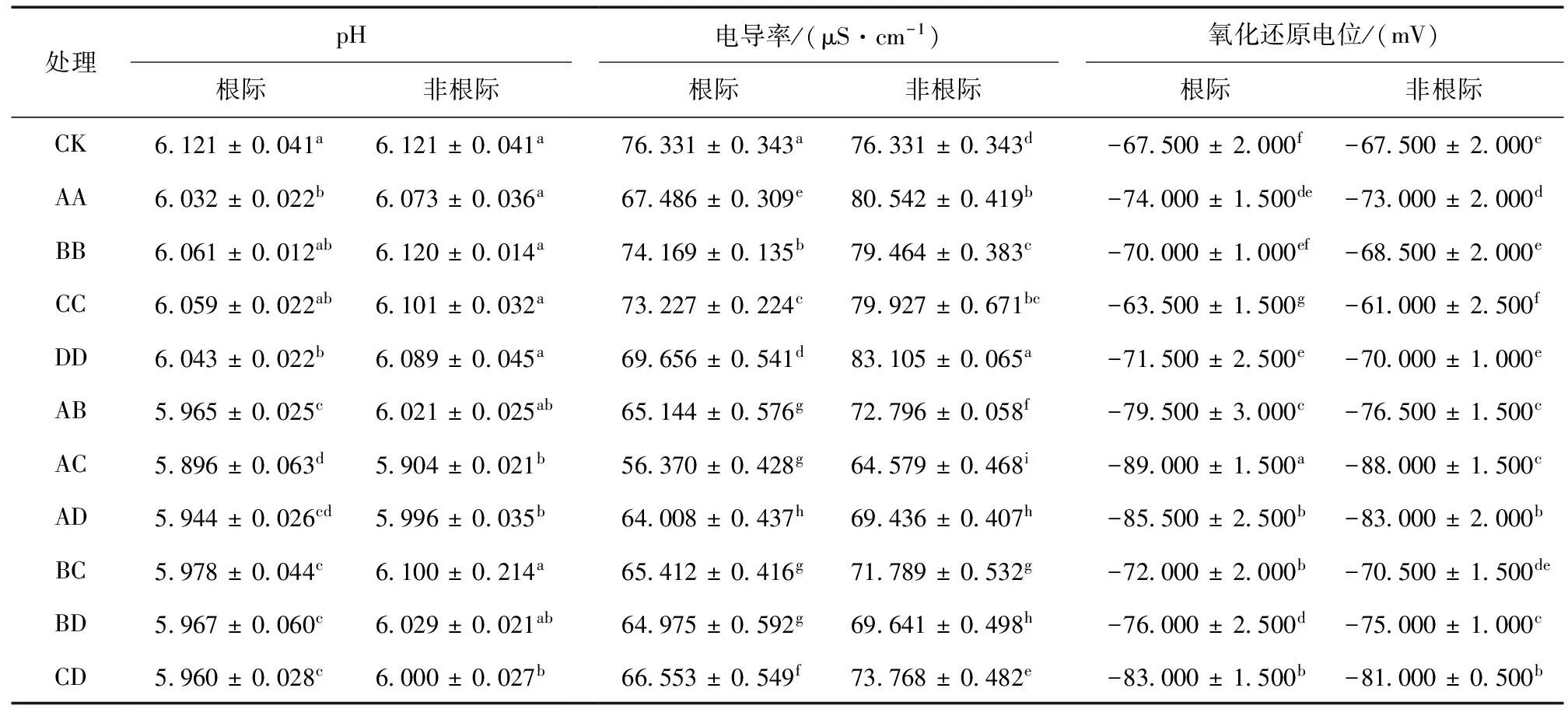
表5 不同种植模式对土壤 pH、电导率及氧化还原电位的影响Table 5 Effects of different cropping patterns on pH, soil conductivity and soil Eh
注:不同小写字母表示显著差异。
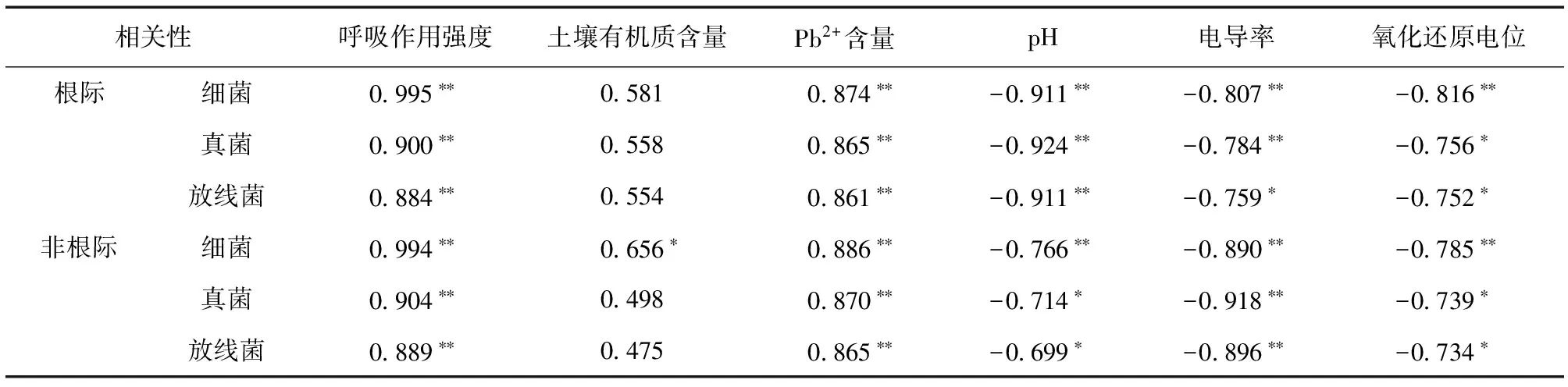
表6 土壤微生物数量与土壤基本化学性质的相关性分析Table 6 Correlation coeffieients between soil microbial quantity and soil physical and chemical properties of different cropping patterns
注:*表示差异显著,**表示差异极显著。
由表6可以看出,根际与非根际土壤中微生物数量与呼吸作用强度和Pb2+含量呈正相关,且细菌、真菌、放线菌数量与呼吸作用强度和有效态铅含量的相关性达到了极显著水平 (P< 0.01)。根际土壤有机质含量与微生物数量虽然呈正相关关系,但相关性不显著,土壤有机质含量与非根际细菌数量显著相关 (P< 0.05)。土壤的pH、电导率、氧化还原电位均与微生物数量呈负相关,且与细菌的相关性均达到了极显著水平 (P< 0.01)。说明尽管土壤有机质含量是衡量土壤肥力的一个重要指标,但它对土壤微生态环境的影响较小; pH、电导率、氧化还原电位对微生物数量的影响较大;土壤中Pb2+含量与微生物数量关系密切;微生物数量越多,代谢越旺盛,土壤呼吸作用强度越大。
3 结论与讨论
本研究结果表明,土壤重金属铅污染下,4种植物不同种植模式均能显著增加土壤细菌、真菌、放线菌数量,提高土壤脲酶、蔗糖酶、过氧化氢酶活性,且根际大于非根际。这与郭华等[11]对毛竹根际与非根际土壤重金属、理化性质及酶活性特征研究的结果一致。由于根系分泌物的作用,根际内微生物数量比根际外要高,当微生物受到环境刺激时,不断向周围介质分泌酶,致使根际内外酶活性存在较大差异。本研究还发现,混种模式要优于于单种模式,这与毛亮等[12]对不同栽培模式下Cd、Pb复合污染对土壤微生物及其酶活性的影响研究结果一致。混种下植物根系分泌物更加复杂多样,为根系一系列复杂的生化反应提供了良好的基础,进而更好的激发了土壤微生物的活性,从而表现出对重金属的抗性[13-14]。另外混种下植物多样性会影响根区微生物群落多样性[15],加上根系分泌物的选择性,单种微生物群落多样性不如混种丰富,微生物又是土壤酶的重要来源,因而混种下土壤酶活性高于单种。
[1] 冯金玲, 郑新娟, 杨志坚, 等. 5种栽培模式对油茶土壤微生物及酶活性的影响[J]. 西南林业大学学报, 2016, 36(2): 10-16.
[2] 郭星亮, 谷洁, 陈智学, 等. 铜川煤矿区重金属污染对土壤微生物群落代谢和酶活性的影响[J]. 应用生态学报, 2012, 23(3): 798-806.
[3] 侯颖, 周会萍, 张超. 城市化对土壤微生物群落结构的影响[J]. 生态环境学报, 2014, 23(7): 1108-1112.
[4] 李伟, 韦晶晶, 刘爱民, 等. 吊兰生长对锌污染土壤微生物数量及土壤酶活性的影响[J]. 水土保持学报, 2013, 27(2): 276-281.
[5] 高扬, 毛亮, 周培, 等. Cd, Pb污染下植物生长对土壤酶活性及微生物群落结构的影响[J]. 北京大学学报 (自然科学版), 2010, 46(3): 339-345.
[6] 国家环境保护局科技标准司. 土壤环境质量标准: GB 15618—1995[S]. 北京: 中国标准出版社, 1995.
[7] 赵庆芳, 张逸醒, 李海燕, 等. 当归种植地土壤微生物数量及土壤酶活性的动态变化研究[J]. 西北师范大学学报 (自然科学版), 2016, 52(3): 90-95.
[8] 周礼恺. 土壤酶学[M]. 北京: 科学出版社, 1987.
[9] 李酋开. 土壤农化常规分析法[M]. 北京: 中国科学出版社, 1984.
[10] 关松荫, 张德生, 张志明. 土壤酶及其研究法[M]. 北京: 中国农业出版社, 1986.
[11] 郭华, 陈俊任, 钟斌, 等. 毛竹根际与非根际土壤重金属、理化性质及酶活性特征[J]. 生态学报, 2017, 37(18): 1-7.
[12] 毛亮, 张春华, 高扬, 等. 不同栽培模式下Cd、Pb复合污染对土壤微生物及其酶活性的影响[J]. 土壤通报, 2010, 41(5): 1191-1196.
[13] 桂富荣, 于亮, 李云国, 等. 混种牧草对紫茎泽兰根际土壤微生物的影响[J]. 中国植保导刊, 2010, 30(4): 10-14.
[14] 赵化银. 不同植物混种对矿山铅锌污染土修复的研究[D]. 成都: 四川农业大学, 2012.
[15] 杨智仙, 汤利, 郑毅, 等. 不同品种小麦与蚕豆间作对蚕豆枯萎病发生、根系分泌物和根际微生物群落功能多样性的影响[J]. 植物营养与肥料学报, 2014, 20(3): 570-579.
