光质对芹菜叶片光合色素和光合荧光特性的影响
2018-03-27尹娟
尹 娟
(信阳农林学院,河南信阳 464000)
光质是植物生长发育的重要环境因子。光合作用有效的可见光光谱在380~760 nm范围内,这一区间的波长对植物的形态建成、次生代谢、生理代谢、光周期及营养品质具有调节作用[1]。高等植物的光系统及光信号转导系统,能够对光质、光照度、照射角度和时间、光质作出适应性反应[2]。光质影响种子萌发,其中红光与远红光的比例对种子能否充分萌发起决定作用[3]。叶片的形成与光合器官发育受光质调控,莴苣在红蓝绿组合光下叶面积最大[4],人参叶片在蓝膜下基粒排列松散,红膜下排列整齐[5]。红光降低茎的生长速率,而远红光能解除这一效应[6]。蓝光促进侧根生长,红光促进组培苗分化生长。蓝光下植物蛋白质含量高,而红光下碳水化合物含量高[7]。另外,光照度和光质对叶绿素蛋白质复合物的形成及光系统Ⅱ(PSⅡ)和光系统Ⅰ(PSⅠ)之间的电子传递也具有调节作用[8]。
发光二极管(LED)作为第4代新型照明光源,可发射植物生长所需的单色光,与传统人工光源相比,具有体积小、质量轻、寿命长、冷光源、光质单一、光谱性能好、光能转化率高、环保等众多优点[9],随着其向高亮度、低成本方向的快速发展,被越来越多的学者用于科学研究,也越来越多地被用于蔬菜工厂化育苗和蔬菜立体栽培。
本试验通过LED光源设置不同光质处理,探究其对芹菜光合特性、光合参数、营养品质的影响,以期通过光质环境调控使芹菜优质高产,并为其他叶菜类蔬菜的光质调控研究提供理论和数据参考。
1 材料与方法
1.1 材料与试验设计
试验于2016年3月11日进行。以荷兰西芹为试材,试验设5个LED光源处理,分别为红光(655.7 nm,R)、蓝光(456.2 nm,B)、红蓝组合光(2 ∶1,R2B1)、红蓝组合光(6 ∶1,R6B1)和白光(对照,W)。LED光源为顶部照明,高度可调,试验期间使LED光源与荷兰西芹之间始终保持约 50 cm 的距离,光照度为280 μmol/(m2·s)。
将浸种催芽后的荷兰西芹种子均匀撒播于装有基质的50孔穴盘中,播种后在种子上撒1层0.3 cm厚的基质,播20盘。4月10日,在西芹3片真叶时,选取长势一致的荷兰西芹15盘,每3盘1个处理。白天温度控制在18~20 ℃,夜间13~15 ℃,每天光照10 h,空气湿度为60%~70%。根据穴盘基质干湿度浇灌Hoagland’s营养液[10],每次300 mL。光照处理40 d后,进行光合色素、光合特性及叶绿素荧光参数测定。
1.2 测定项目与方法
5月20日09:40—10:20,用TPS-2便携式光合仪测定芹菜倒3叶的光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间CO2浓度(Ci),测定时光照度为280 μmol/(m2·s),气温为18~19 ℃,叶温为19~20 ℃,CO2浓度为 400 μmol/mol。每盆选取3株有代表性的植株进行测定,取平均值。
参照Lichtenthaler等对Arnon修正的方法[11-12]测定叶绿素含量;使用英国汉莎科学仪器公司生产的FMS-2型调制式叶绿素荧光仪测定荷兰西芹倒3叶的叶绿素荧光动力学参数:初始荧光(Fo)、可变荧光(Fv)、暗适应下PSⅡ最大荧光产量(Fm)、PSⅡ实际光化学效率(ΦPSⅡ)、光化学淬灭系数qP,每处理测定3张叶片。
采用Excel 2007软件处理数据并绘图,采用SAS软件进行数据统计分析。
2 结果与分析
2.1 不同光质对芹菜叶绿素荧光参数的影响
由表1可知,Fv/Fm和Fv/Fo趋势一致,表现为红蓝光(6 ∶1)>红蓝光(2 ∶1)>红光>白光>蓝光;ΦPSⅡ在不同光质处理下的大小依次为红蓝光(6 ∶1)>红光>红蓝光(2 ∶1)>白光>蓝光;qP大小依次为红蓝光(6 ∶1)>红蓝光(2 ∶1)>白光>红光>蓝光;红蓝光(6 ∶1)处理下芹菜的Fv/Fm、Fv/Fo、ΦPSⅡ和qP均高于其他处理,表明该处理的芹菜在暗适应下PSⅡ实际光化学效率和光合活性较高,PSⅡ潜在活性和电子传递活性较大,光合电子传递速率较快,PSⅡ反应中心较为开放。
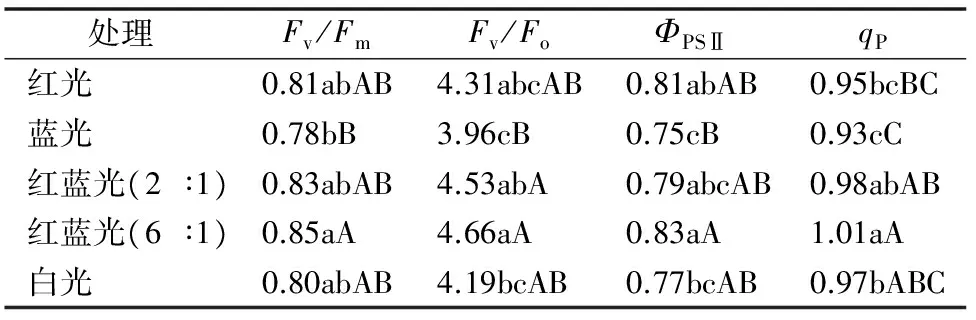
表1 不同光质对芹菜荧光参数的影响
注:同列数据后不同大写、小写字母分别表示在0.01、0.05水平上差异显著。
2.2 不同光质对芹菜光合色素含量的影响
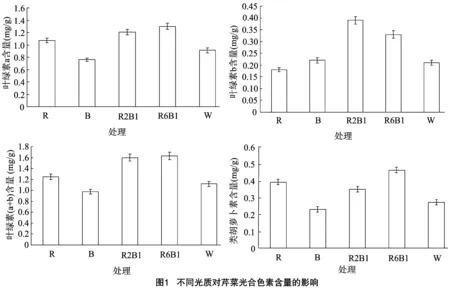
图1表明,光质对叶绿素a和叶绿素(a+b)影响趋势一致,大小依次为红蓝光(6 ∶1)>红蓝光(2 ∶1)>红光>白光>蓝光,其中红蓝光(6 ∶1)的叶绿素a、叶绿素(a+b)含量分别为1.30、1.63 mg/g,较白光(0.91、1.12 mg/g)下分别提高42.86%、45.54%。而叶绿素b含量在红蓝光(2 ∶1)下最高,较白光提高85.71%;红光下最低,较白光下降低14.29%,这可能与叶绿素b偏向吸收短波的蓝紫光有关。类胡萝卜素在红蓝光(6 ∶1)下最高,其次是红光下,蓝光下最低,说明光质对类胡萝卜素含量的影响不只是简单的光质叠加效应,还应存在其他方式的互作效应,同时也表明红蓝光(6 ∶1)处理保护叶绿素免受破坏的能力较其他处理强。
2.3 不同光质对芹菜光合特性的影响
由图2可知,芹菜叶片光合速率在红蓝光(6 ∶1)下最高,其次是红蓝光(2 ∶1),再次是红光和白光,而蓝光下最低, 说明2种波长的光照射较单光照射更有利于光合速率的提高,试验结果符合爱默生效应,这可能是因为光合作用与2个光化学反应接力进行有关。红蓝光(6 ∶1)处理下的芹菜蒸腾速率和气孔导度最大,蓝光处理最小。蓝光处理下胞间CO2浓度高于白光下,而红光、红蓝(2 ∶1)和红蓝(6 ∶1)处理下的胞间CO2浓度均低于白光下,这可能与芹菜的绿色细胞光呼吸有关。从图2还可以看出,不同光质处理下,芹菜光合速率与蒸腾速率、气孔导度整体上呈正相关关系,与胞间CO2浓度呈负相关关系。
3 讨论
叶绿素荧光动力学技术可快速、无损伤研究植物的光合特性,是间接研究植物光合性能的探针。Fv/Fm表示最大 PSⅡ 光能转换效率,反映PSⅡ反应中心原初光能转换效率;Fv/Fo表示PSⅡ的潜在活性;ΦPSⅡ是PSⅡ反应中心非环式光合电子传递效率;qP为光化学淬灭系数。储钟稀等研究认为,红光照射能提高黄瓜叶片PSⅡ活性和PSⅡ原初光能转化效率,而蓝光降低PSⅡ活性[13]。本试验结果表明,芹菜的Fv/Fm和Fv/Fo的变化趋势一致,在红蓝光(6 ∶1)处理下最高,表明暗适应下芹菜叶片PSⅡ光化学效率及潜在活性较高,与陈娴等在韭菜上的研究结论[14]类似。ΦPSⅡ在不同光质处理下表现为红蓝光(6 ∶1)最大,表明在该处理下芹菜叶片光合电子传递速率相对较快,反映该处理下的实际光化学效率最高,与该处理下的光合速率最高一致。红蓝光(6 ∶1)处理的芹菜叶片qP最高,反映该处理下芹菜叶片吸收的光能用于光化学电子传递的份额及ΦPSⅡ的电子传递活性较大,PSⅡ反应中心相对开放。
植物叶绿体中的色素主要有3类,即叶绿素、类胡萝卜素和藻胆素, 而高等植物叶绿体中含有前2类。光是叶绿体发育和叶绿素合成的重要条件,从原叶绿酸酯转变为叶绿酸酯需要光的还原过程,而光质对植物叶绿素含量的影响也存在显著差异。徐凯等通过试验得出,红光和蓝光对叶绿素合成影响差异显著,红光有利于叶绿素合成,而蓝光的作用与之相反[15]。余让才等研究认为,蓝光使叶绿素含量降低,而红光使叶绿素含量升高[16]。Bach等研究发现,红光降低风信子叶绿素含量,蓝光促进愈伤组织叶绿素的形成[17]。本试验结果表明,红蓝光(6 ∶1)、红蓝光(2 ∶1)和红光处理下的芹菜叶绿素a和叶绿素(a+b)含量均高于白光下,蓝光下低于白光下,与刘丹等在黄瓜幼苗上的研究结果[18]一致,说明不同植物对光质的响应机制存在差异;而叶绿素b含量在红蓝光(2 ∶1)处理下最高,红光下最低,与光质对叶绿素a和叶绿素(a+b)的影响大致相反,这可能与叶绿素b偏向吸收短波的蓝紫光、叶绿素a偏向吸收波长较长的红光有关;类胡萝卜素含量在红蓝光(6 ∶1)下高于红光处理,而红光处理高于红蓝光(2 ∶1),说明同样的组合光但不同比例对类胡萝卜素含量的影响不同,只有一定比例的组合光才能促进芹菜叶片类胡萝卜素的合成。另外,红蓝组合光和红光处理下类胡萝卜素含量均高于白光下,且类胡萝卜素能帮助叶绿素接收光能,通过叶黄素循环,以非辐射方式耗散过剩能量来保护叶绿素免受破坏[19]。
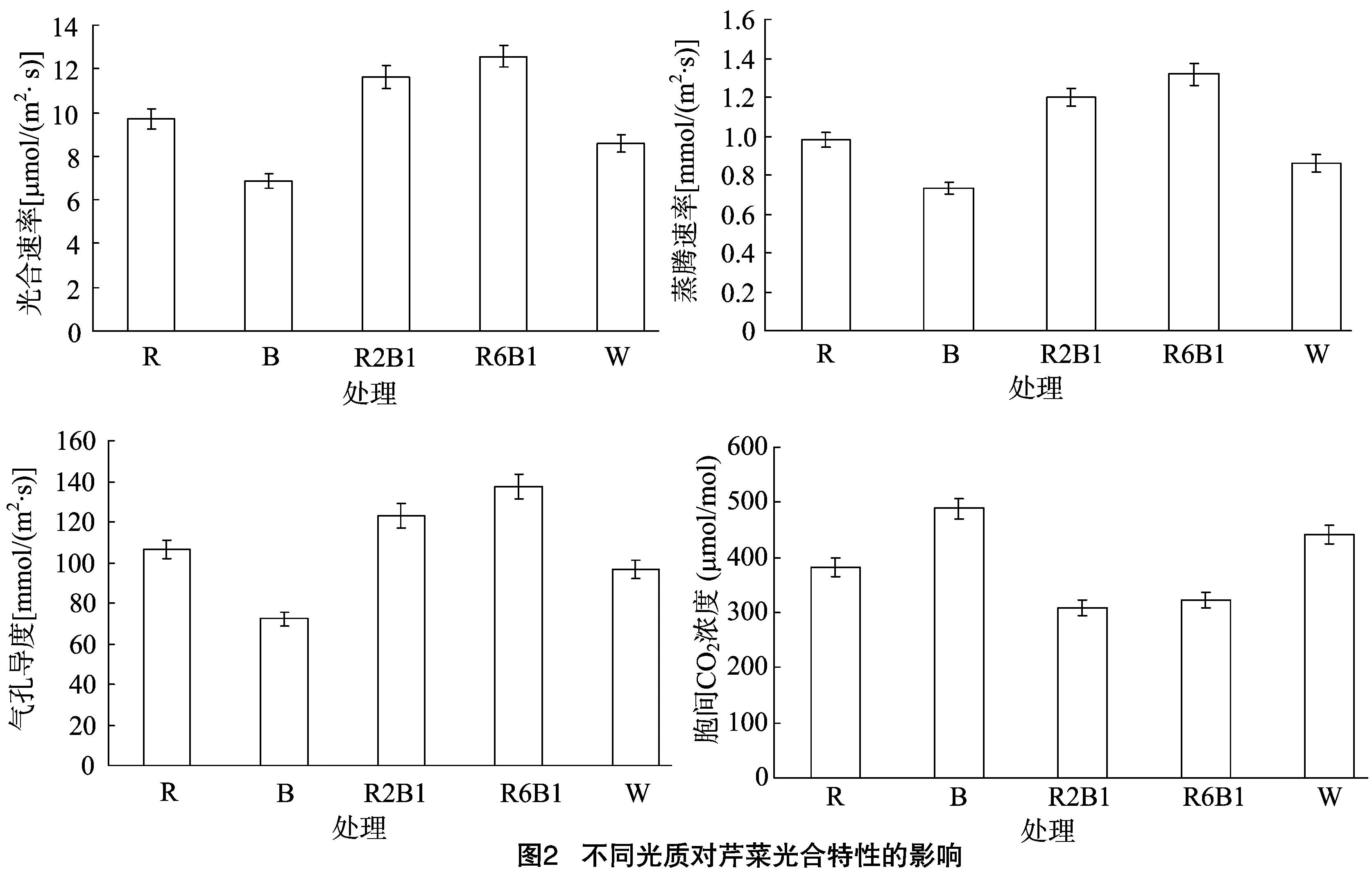
植物的生长代谢离不开光,光能够以光质和光照度2种方式来调节植物叶片的光合速率、蒸腾速率、次生代谢和基因表达等。本试验结果表明,红蓝光(6 ∶1)下芹菜叶片光合速率最高,且红蓝组合光均高于单质蓝光和红光处理,说明2种波长的光照射较单光照射更有利于光合速率的提高,试验结果符合爱默生效应,这可能是因为光合作用与2个光化学反应接力进行有关。这与陈娴等在韭菜上的研究结果[14]类似,而与杨晓建等分别在青蒜苗、黄瓜及生姜上的研究结果[20-22]不一致,说明不同植物对光质的响应机制不同,进而表现出光合特性上的差异,这可能是由光质可以影响绿色细胞的结构所致[23]。红蓝光(6 ∶1)处理下芹菜的蒸腾速率和气孔导度高于白光,而蓝光处理低于白光,与光质对芹菜叶片光合速率的影响趋势一致,这可能是因为植物的光合作用离不开叶片蒸腾及与外界的其他交换,而气孔导度对作物的光呼吸有直接影响。蓝光处理下芹菜的胞间CO2浓度高于白光下,其他处理均低于白光,与光合速率大致呈负相关关系,这可能与叶片高羧化活性有关。
[1]Chory J,Wu D Y. Weaving the complex web of signal transduction[J]. Plant Physiology,2001,125(1):77-80.
[2]Nakano Y,Asada K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J]. Plant and Cell Physiology,1981,22(5):867-880.
[3]洪 宇,童 哲. 光敏色素在植物个体发育中的作用[J]. 植物生理学通讯,1998,34(6):417-422.
[4]Kim H H,Goins G D,Wheeler R M,et al. Green-light supplementation for enhanced lettuce growth under red- and blue-light-emitting diodes[J]. HortScience,2004,39(7):1617-1622.
[5]焦雨歆,赵 琦,王雪英,等. 环境因子对植物叶绿体结构的影响[J]. 生物技术通报,2008(2):5-10.
[6]Leyser O,Day S. 植物发育的机制[M]. 瞿礼嘉,邓光旺,译. 北京:高教出版社,2006:143-153.
[7]Kowallik W. Blue light effects on respiration[J]. Annual Review of Plant Physiology,1982,33:51-72.
[8]Patil G G,Oi R,Gissinger A,et al. Plant morphology is affected by light quality selective plastic films and alternating day and night temperature[J]. Gartenbauwissenschaft,2001,66(2):53-60.
[9]王声学,吴广宁,蒋 伟,等. LED原理及其照明应用[J]. 灯与照明,2006,30(4):32-35.
[10]Hoagland D R,Arnon D I. The water culture method for growing plants without soil[J]. California Agricultural Experiment Station Circular,1950,347(5406):357-359.
[11]Lichtenthaler H K. Applications of chlorophyll fluorescence:in photosynthesis research,stress physiology,hydrobiology and remote sensing[M]. Boston:Kluwer Academic Publishers,1988:129-142.
[12]Arnon D I. Copper enzymes in isolated chloroplasts. Polyphenoloxidase inBetavulgaris[J]. Plant Physiology,1949,24(1):1-15.
[13]储钟稀,童 哲,冯丽洁,等. 不同光质对黄瓜叶片光合特性的影响[J]. 植物学报,1999,41(8):867.
[14]陈 娴,刘世琦,孟凡鲁,等. 不同光质对韭菜生长及光合特性的影响[J]. 中国蔬菜,2012(8):45-50.
[15]徐 凯,郭延平,张上隆. 不同光质对草莓叶片光合作用和叶绿素荧光的影响[J]. 中国农业科学,2005,38(2):369-375.
[16]余让才,潘瑞炽. 蓝光对水稻幼苗光合作用的影响[J]. 华南农业大学学报,1996,17(2):88-92.
[17]Bach A,Krol A. Effect of light quality on somatic embryogenesis inHyacinthusorientalisDelft’s blue[J]. Biological Bulletin of Poznań,2001,38(1):103-107.
[18]刘 丹. LED光源对花生以及黄瓜幼苗生长的影响[D]. 南京:南京农业大学,2013.
[19]郑 洁,胡美君,郭延平. 光质对植物光合作用的调控及其机理[J]. 应用生态学报,2008,19(7):1619-1624.
[20]杨晓建,刘世琦,张自坤,等. 不同LED光源对青蒜苗生长及叶绿素荧光特性的影响[J]. 中国蔬菜,2011(6):62-67.
[21]谢 景,刘厚诚,宋世威,等. 不同光质LED灯对黄瓜幼苗生长的影响[J]. 长江蔬菜(学术版),2012(6):23-25.
[22]张瑞华,徐 坤,董灿兴. 光质对生姜叶片光合特性的影响[J]. 中国农业科学,2008,41(11):3722-3727.
[23]Eskins K,Duysen M,Dybas L,et al. Light quality effects on corn chloroplast development[J]. Plant Physiology,1985,77(1):29-34.
