云南独蒜兰×陈氏独蒜兰种子萌发与幼苗生长研究
2018-03-27江鸣涛张艺祎李云霞黄继芬吴沙沙
江鸣涛, 张艺祎, 李云霞, 黄继芬, 吴沙沙
(1.福建农林大学园林学院,福建福州 350002; 2.福建农林大学海峡兰花保育中心,福建福州 350002)
独蒜兰属(Pleione)是兰科植物中具有较高观赏价值的一个属[1],该属植物花色鲜艳、花型奇特,深受欧美和日本人士的喜爱,具有极高的园艺价值。在欧洲、美国、日本等地已广泛栽培应用,在英国已规模化生产[2],并已培育出约2 000个品种[3]。我国台湾省每年外销到日本的台湾独蒜兰种球即可达20万球[4]。独蒜兰属约26种,我国有23种,其中12种为我国特有,是独蒜兰属植物的分布中心,资源众多[1]。但由于其栽培环境条件要求较高,开发利用滞后,我国目前仅中国科学院昆明植物研究所培育出2个新品种[5],台湾大学培育出少量几个品种[6]。因此加快我国独蒜兰属植物种质资源的保护和育种开发具有重要意义。
独蒜兰属植物因其分球和顶球繁殖率低,无菌播种和假鳞茎作为外植体器官发生成苗速度快,但养成开花球时间长、成本高而严重制约其规模化生产[6],种子无菌播种繁殖在新品种培育过程中具有重要意义。同时,与兰科其他种一样,独蒜兰属植物的种子由于自身不透水、不透气等原因,自然状态下萌发率极低[7-8],利用无菌播种组织培养技术能够快速、大量繁殖。
云南独蒜兰(P.yunnanensis)具有重要的药用价值[9],且其花淡紫、粉红或近白色,唇瓣具紫或深红色斑[10];陈氏独蒜兰(P.chunii)原产于中国云南西部和广东北部,花大,淡粉红色至玫瑰紫色,色泽通常向基部变浅,唇瓣中央具1条黄色或橘黄色条纹和多数同样色泽的流苏状毛[1],深受人们的喜爱,具有较高园艺观赏价值。二者进行杂交,可能培育出花色丰富、唇瓣色彩和结构多变的新品种,因此有必要对其杂交种进行无菌播种研究。
本研究以云南独蒜兰为母本、陈氏独蒜兰为父本杂交的成熟未开裂蒴果为试验材料,以花宝2号作为基本培养基探讨不同浓度细胞分裂素6-苄基腺嘌呤(6-benzyladenine,6-BA)和生长素α-萘乙酸(α-naphthalene acetic acid,NAA)对该杂交种无菌萌发和幼苗生长的影响,以期得到适宜的无菌萌发和幼苗生长培养基配方,从而为今后独蒜兰杂交种快速繁殖和新品种培育提供一定的参考依据。
1 材料与方法
1.1 试验材料
以人工授粉120 d的云南独蒜兰×陈氏独蒜兰杂交种的成熟未开裂蒴果作为种子萌发试验材料。以经过90 d无菌培养得到的云南独蒜兰×陈氏独蒜兰杂交小苗作为继代培养材料。
1.2 试验方法
1.2.1 灭菌及无菌播种 将采收的杂交果实放在自来水下冲洗30 min后转入超净工作台,用75%乙醇表面消毒30 s,然后用0.15% HgCl2溶液浸泡30 min,最后用无菌水漂洗3次。将消毒后的果实平放在经灭菌的滤纸上,吸干水分后,用解剖刀将荚果纵向切开,将种子均匀播种到培养基表面,轻轻摇晃培养瓶使种子均匀分散。
1.2.2 原球茎诱导 杂交种萌发基础培养基为3 g/L花宝2号+20 g/L蔗糖+2 g/L蛋白胨+50 g/L香蕉+50 g/L马铃薯+2 g/L活性炭+7 g/L琼脂(pH值5.6),探讨6-BA和NAA这2个因素不同浓度配比对种子萌发的影响,按表1进行9组处理,每组接种10瓶,3次重复。于2015年12月27日配制培养基并接种,黑暗培养,至种子明显膨大后转至光照度为1 500 lx的日光灯下进行培养,培养温度为(25±2) ℃,平均光照时间为12 h/d。培养90 d后统计原球茎分化率和植株平均高度。
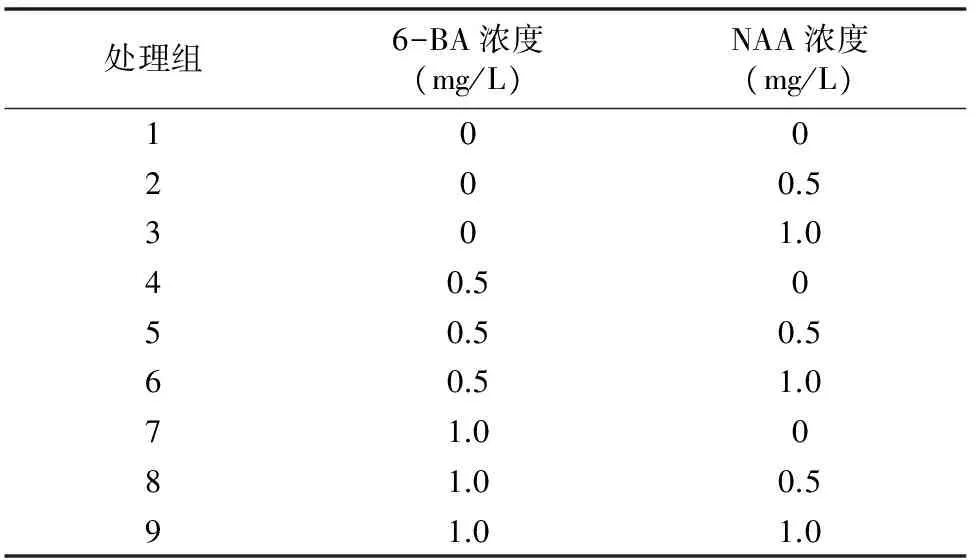
表1 种子萌发培养基配方设计
1.2.3 幼苗培养 幼苗培养的基础培养基配方为1 g/L蛋白胨+25 g/L蔗糖+1 g/L活性炭+7 g/L琼脂(pH值5.6),以6-BA、NAA和花宝2号3个不同浓度(表2)进行3因素3水平正交试验设计,共9组。每组接种5瓶,每瓶转接3丛大小接近的无菌萌发培养90 d的小苗,3次重复。于2016年3月28日配制幼苗培养基并转接。培养60 d后统计原球茎平均直径和植株平均高度。培养条件与无菌播种萌发后光照培养条件相同。

表2 幼苗培养基配方正交试验设计
1.3 测定指标及数据分析
无菌播种培养90 d后,从每组处理中随机挑选出3瓶,分别用镊子夹出原球茎放在培养皿中,在体视显微镜(Nikon,SMZ18,日本)下观察9个不同视野,以叶片突破原球茎的植株视为分化成功,以叶片突破原球茎的植株数/视野中原球茎总数×100%作为原球茎分化率。在体视显微镜下拍照,于AutoCAD 2007中测量植株高度。
植株在幼苗培养培养基中培养60 d后,每组处理随机选取3瓶,随机选出10株植株,置于坐标纸上拍照(图1),于CAD软件中测量植株高度和原球茎直径。
用Excel 2007进行数据整理,采用SPSS 19.0软件(IBM,美国)的Duncan’s方差分析法进行数据的显著性分析。
2 结果与分析
2.1 无菌萌发形成原球茎
2.1.1 种子无菌萌发过程 种子无菌播种在黑暗条件下培养20 d时开始膨大,后转至光照条件下继续培养,种子开始形成一些淡黄色小突起,即为原球茎开始形成。随着时间的推移,颜色开始由淡黄色变成浅绿色,原球茎分化逐渐形成。培养90 d后,可观察到萌发的种子已经形成极小的原球茎,部分原球茎长出幼嫩叶片(图1),且根部有白色绒毛。
2.1.2 原球茎分化及株高的差异 9组处理原球茎分化率分为3个水平,处理6和处理9的原球茎分化率水平显著高于其他组,其中处理6原球茎分化率高达94.45%,处理9分化率为87.19%;处理1、处理2、处理3、处理5和处理8分化率水平居中,在53.92%~63.38%之间;处理4和处理7原球茎分化率显著低于其他组合(图1-D、图1-G),分化率分别为37.58%和29.75%(表3)。

另外,植株平均高度差异分为6个水平,处理6植株平均高度显著高于其他组,达到1.56 cm(图1-F);处理3(图1-C)和处理9(图1-I)次之,植株平均高度分别为1.15 cm和1.21 cm;植株平均高度最低的为第7组,仅为0.22 cm(表3)。
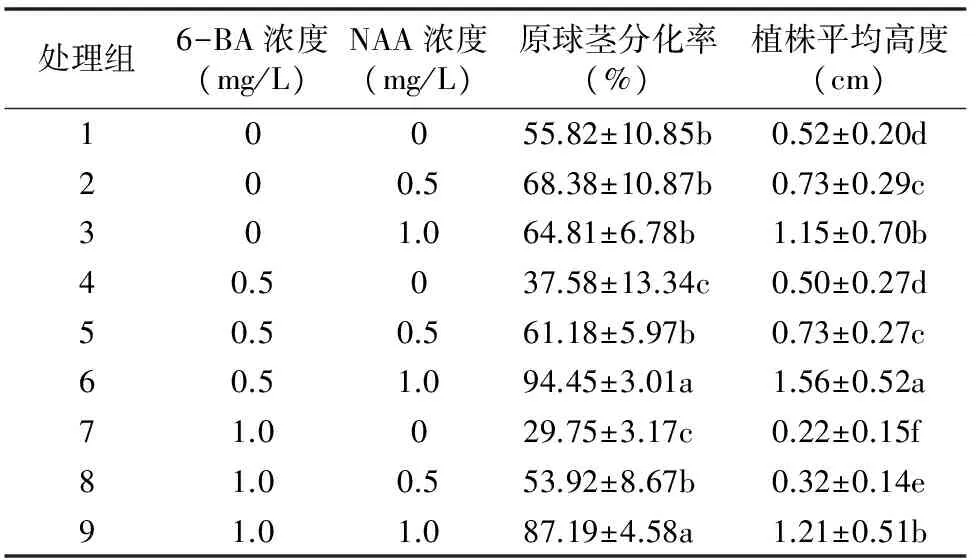
表3 种子无菌萌发情况统计
注:同列数据后不同小写字母表示处理间差异显著(P<0.05)。表4同。
2.2 幼苗生长
2.2.1 原球茎直径的差异 杂交子代原球茎在不同浓度花宝2号添加6-BA和NAA不同配比的培养基中培养60 d后,植株发育成具1~2张叶片的小苗,植株高度和原球茎直径均有不同程度的增加。处理1假鳞茎膨大显著大于其他处理,且植株生长健壮。处理6、处理8和处理9次之,假鳞茎膨大后直径均约0.3 cm;处理5中原球茎直径最小,仅为0.14 cm(表4),且出现部分植株褐化后停止生长的现象。3个研究因素对于假鳞茎膨大的R值排序为花宝2号(0.153)>NAA(0.092)>6-BA(0.043),表明花宝2号对该独蒜兰杂交种假鳞茎膨大促进作用最强,NAA次之,6-BA作用最弱。
2.2.2 平均株高的差异 处理8植株平均高度显著高于其他组,达到4.38 cm(表4), 这与原球茎诱导培养基中植株高度最高的处理6中的激素含量相同,说明1.0 mg/L NAA+0.5 mg/L 6-BA有利于叶片生长。处理1、处理2、处理6和处理9次之,植株平均高度均小于3 cm;处理4中植株平均高度值最低,仅为1.35 cm(表4),但该处理中植株高度整齐一致,有利于后期统一出瓶和管理。对于幼苗平均株高而言,3个因素的R值排序为NAA(1.70)>花宝2号(1.51)>6-BA(0.43),表明NAA对于植株的促进作用最强,花宝2号次之,6-BA最弱。

表4 不同添加物处理对杂交种幼苗生长的影响
3 讨论与结论
3.1 激素对原球茎分化率及株高的影响
在没有外源添加6-BA和NAA的培养基中,原球茎分化率即可达到50%以上,在此基础上添加6-BA(0.5 mg/L或 1.0 mg/L),原球茎诱导率降低,说明单独添加6-BA具有抑制原球茎分化的作用。当培养基中仅添加NAA(0.5 mg/L 或 1.0 mg/L)时,对原球茎分化促进作用不明显,与不添加NAA对原球茎分化率没有差异。当NAA浓度达到1.0 mg/L时,添加低浓度6-BA(0.5 mg/L或1.0 mg/L)对原球茎诱导具有明显的促进作用。表明细胞分裂素6-BA和生长素NAA共同作用对该杂交种种子萌发形成原球茎具有明显促进作用。
黄家林等研究云南独蒜兰(P.yunnanensis)种子无菌萌发发现,仅添加细胞分裂素6-BA或KT对其萌发具有抑制作用[11],本研究结果与之相同。同样,对云南独蒜兰无菌萌发研究发现,单独添加6-BA具有抑制作用,单独添加NAA对种子萌发具有一定的促进作用[12],本研究结果与之相同;而B5培养基+0.25 mg/L 6-BA+0.5 mg/L NAA同样具有抑制种子萌发的作用[13],本研究结果与之不同,但本研究陈氏独蒜兰种子萌发结果与之一致,说明激素对于不同种质种子萌发的作用存在差异。
当6-BA浓度为0 mg/L时,NAA对种子萌发后植株高度具有促进作用,随着NAA浓度的增加,植株高度明显增高。当不添加NAA时,随着6-BA浓度的增加,植株高度呈现降低的趋势,说明6-BA对于植株高度具有抑制作用。虽然在此阶段植物叶片的生长对于后期假鳞茎的形成具有重要作用,但是由于该培养阶段重点关注的是原球茎的分化,所以现有的研究报道对平均株高指标关注不多。
综合种子萌发过程中原球茎分化率和植株高度2个指标,处理6为所有处理中最佳,即3 g/L花宝2号+0.5 mg/L 6-BA+1 mg/L NAA+20 g/L蔗糖+50 g/L 马铃薯+50 g/L香蕉+2 g/L蛋白胨+2 g/L活性炭+7 g/L琼脂为种子无菌萌发最佳培养基。
3.2 花宝2号和激素对幼苗生长的影响
已有的研究报道,多是在原球茎诱导后进行增殖培养方面,缺少专门针对假鳞茎膨大培养健壮植株的过程[12-14],陈之林等研究白花独蒜兰(P.albiflora)原球茎诱导出来后接种到2 g/L花宝2号+0.5 mg/L NAA+100 ml/L香蕉匀浆+2 g/L 活性炭培养基上培养60 d假鳞茎直径可达5 mm[15]。疣鞘独蒜兰(P.praecox)和岩生独蒜兰(P.saxicola)原球茎在1/2 MS+0.5 mg/L NAA+1.0 mg/L 6-BA培养60 d后可长为高2~5 cm、假鳞茎直径5 mm的植株[16]。对台湾独蒜兰无菌播种假鳞茎膨大研究表明,MS+0.2 mg/L 6-BA+1.0 mg/L NAA+100 g/L马铃薯有利于假鳞茎膨大,培养 90 d 后假鳞茎直径可达0.33 cm[17],略小于本研究培养60 d所得到的0.36 cm的结果。
从研究的结果可知,花宝2号对该杂交种原球茎膨大有着明显的促进作用,NAA对幼苗叶片生长具有明显的促进作用,综合植株膨大和植株平均高度2个指标,适合该杂交种幼苗生长的培养基为1 g/L花宝2号+0.5 mg/L 6-BA+1.0 mg/L NAA+1 g/L蛋白胨+25 g/L糖+1 g/L活性炭+7 g/L 琼脂。
已有的研究报道表明,独蒜兰属植物组培生根相对容易。此外,在前期的研究中发现,组培苗生根与否对于炼苗移栽的影响不大,假鳞茎的大小对于移栽成活和后期植株生长的作用更重要(未发表),故本研究没有专门针对生根进行研究。由于组培苗移栽后真正生长成为新植株的为假鳞茎基部的芽,而芽的生长初期营养主要来自已有的假鳞茎,所以组培苗培养中假鳞茎膨大是重点要解决的问题,尤其是针对缩短膨大时间和提高膨大效率方面值得进一步深入研究。
[1]中国科学院中国植物志编辑委员会. 中国植物志:第18卷[M]. 北京:科学出版社,1999:377-378.
[2]陈宇勒. 独蒜兰及其栽培[J]. 花卉,2003(2):29.
[3]沈崇灵. 法理学[M]. 北京:北京大学出版社,1994:51-52.
[4]华 健. 台湾一叶兰生产技术[J]. 台湾农业探索,2004(2):37-38.
[5]中国科学院. 云南野生兰花新品种研发成果喜人[Z]. (2004-09-21)[2016-08-26]. http://www.cas.cn/xw/zyxw/tpxw/200409/t20040921_1011941.shtml.
[6]杨 飏. 台湾一叶兰‘梅雪’与‘枫星’之微体繁殖[D]. 台北:台湾大學,2013.
[7]蓝家望,桂 阳,张丽娜,等. 独蒜兰种子自然萌发特性分析[J]. 湖北农业科学,2013,52(9):2077-2082.
[8]蓝家望,桂 阳,张丽娜,等. 独蒜兰种子的自然萌发特性(Ⅱ)[J]. 贵州农业科学,2013,41(6):59-62.
[9]董海玲,郭顺星,王春兰,等. 山慈菇的化学成分和药理作用研究进展[J]. 中草药,2007,38(11):1734-1738.
[10]Cribb P,Butterfield I,Tang C Z. The genusPleione[M]. Timber Press,1988:91-95.
[11]黄家林,胡 虹,李树云.云南独蒜兰的种子无菌萌发研究[J]. 园艺学报,2005,32(2):313-313.
[12]于晓娟,纳海燕,胡晓丽,等. 毛唇独蒜兰的离体快速繁殖研究[J]. 四川大学学报(自然科学版),2007,44(4):891-894.
[13]于晓娟. 独蒜兰组织培养及其生物多样性的ISSR分析[D]. 成都:四川大学,2007.
[14]涂艺声,刘如龙,黄文敏. 井冈山独蒜兰再生体系构建研究[J]. 安徽农业科学,2009,37(9):3931-3932.
[15]陈之林,叶秀麟,粱承邺,等. 白花独蒜兰的组织培养和快速繁殖[J]. 植物生理学报,2004,40(4):455-455.
[16]易 瑾,龙春林,程治英. 疣鞘独蒜兰和岩生独蒜兰的组织培养与快速繁殖[J]. 植物生理学报,2008,44(3):533-534.
[17]卓孝康,兰思仁,彭东辉,等. 台湾独蒜兰无菌萌发与植株再生研究[C]//中国观赏园艺研究进展. 2015.
