外源化感物质香豆酸对豌豆种子萌发、幼苗根际土壤酶活性及土壤微生物的影响
2018-03-27李春龙
李春龙
(成都农业科技职业学院现代农业分院,成都温江 611130)
香豆酸、香豆素、羟基肉桂酸、阿魏酸等均属于酚酸类物质,现已被公认为化感物质[1]。化感物质是植物化感作用的媒介,主要通过挥发或雨雾、植物表面淋溶、植物根系分泌、植物残体或凋落物分解等4种途径释放并进入环境,被受体植物吸收而起作用[2-3]。当化感物质通过植株残体分解以及根系分泌等途径进入土壤,使得土壤养分、酶活性以及根际微生物等受到影响,进而会影响作物的正常生长[4-5]。
豌豆(PisumsativumL.)为豆科豌豆属栽培种,一年生或越年生,是一种很好的速生作物,适应范围极广,从高寒山区到炎热坝区都能生长,出苗后40 d以上便可采食嫩尖。豌豆是世界性食用豆类作物,主要作蔬菜和粮食使用,也可作绿肥和饲料,是集粮、菜、肥、饲于一体的多用途作物[6]。豌豆被认为是最不耐连作的豆科作物之一[7]。目前,国内外对豌豆化感作用的研究主要集中在豌豆自毒作用上[8-9],有关外源纯化感物质对豌豆化感作用的研究鲜见报道。本试验研究不同浓度的外源化感物质香豆酸对豌豆种子萌发、幼苗根际土壤酶活性、土壤酸碱度、土壤微生物数量的影响,旨在揭示豌豆根际微生物区系和土壤酶活性的变化规律。
1 材料与方法
1.1 材料
化感物质香豆酸购于Sigma公司,豌豆种子购于四川省农业科学院。
1.2 香豆酸处理液的配制
参照宋亮等人的方法[10],将香豆酸用蒸馏水溶于容量瓶中配成10-2mol/L的母液,然后将母液分别稀释成10-3、10-4、10-5、10-6、10-7mol/L。试验时现用现配制,用蒸馏水作为对照。
1.3 试验设计
1.3.1 种子萌发试验 参照李春龙的方法[11],挑选粒大、饱满、大小一致的豌豆种子用蒸馏水清洗,晾干后备用。先用5.25 g/L的NaClO溶液对受试的豌豆种子进行消毒,时间为15 min,然后用蒸馏水清洗4次,每次清洗1 min;将豌豆种子放置在直径为9 cm的皮氏培养皿中,内垫2层滤纸,每个培养皿内放豌豆种子30粒,分别将10-7、10-6、10-5、10-4、10-3、10-2mol/L的香豆酸处理液15 mL注入培养皿中,对照为蒸馏水,每个处理重复3次。然后将培养皿放置在恒温恒湿培养箱(25±1)℃,黑暗中进行种子萌发试验。待豌豆种子萌芽4 d后记录其萌发的种子数,计算豌豆种子的发芽率,记录完测定所有萌发幼苗的根长和苗长,并数出每个萌发幼苗的根数,求其平均值。
1.3.2 幼苗盆栽试验 2014年5月上旬取盆栽土(土壤取自成都农业科技职业学院校外实训基地内),取回后先过2遍2 cm筛,筛去较大的石块及粗枝等,再过细筛,用45%敌磺钠350 g进行土壤消毒处理,然后将土混匀,随机装盆。每盆土均装至花盆的三分之二处,每盆装土10 kg,盆上口径 28 cm、深25 cm,播豌豆种子10粒。
待豌豆幼苗生长约1个月后,挑选长势一致的豌豆壮苗进行处理。采用不同浓度的香豆酸(10-7、10-6、10-5、10-4、10-3、10-2mol/L)溶液40 mL浇灌豌豆幼苗,每个处理重复4次,用等量的蒸馏水处理作为对照(即0 mol/L)。此后每隔10 d浇40 mL香豆酸处理豌豆幼苗,30 d后即2014年6月25日取豌豆幼苗根际土,用土钻钻取深度20 cm、大约300 g豌豆幼苗根际土,轻轻抖动后仍然粘贴在豌豆幼苗根系上的土壤用于根际微生物数量的测定,装袋、封口并做好标签,立即带回实验室进行分析处理,参照韩春梅等的方法[12]实施。
1.4 测定方法
1.4.1 豌豆种子萌发指标测定 豌豆幼苗根长、苗长用直尺测量。
1.4.2 土壤酶及土壤酸碱度测定 土壤酶活性测定均参照关松荫的方法[13]。土壤反硝化酶活性采用硝态氮剩余量法测定;纤维素酶活性采用硝基水杨酸比色法测定;脲酶、蛋白酶、酸性磷酸酶以及蔗糖酶活性均采用比色法测定;土壤酸碱度使用酸度计测定。
1.4.3 土壤微生物分析 土壤微生物采用平板涂抹法[14]测定,细菌采用牛肉膏蛋白胨培养基,真菌采用马丁氏培养基,放线菌采用改良的高氏一号培养基。
1.5 数据处理
采用SPSS 13.0统计软件进行单因素方差、LSD和相关性分析。
2 结果与分析
2.1 外源化感物质香豆酸对豌豆种子萌发的影响
从表1可以看出,与对照比较,低浓度的香豆酸 10-7mol/L 促进了豌豆幼苗的4个形态指标,10-6mol/L的香豆酸也促进了豌豆种子的萌发。随着香豆酸浓度的增加,豌豆幼苗的4个形态指标均不同程度受到抑制。10-5mol/L香豆酸处理下的豌豆种子发芽率较对照显著下降,比对照降低10.98%;豌豆幼苗的根长、苗长均在香豆酸浓度达到 10-4mol/L 时较对照显著受到抑制,分别较对照下降了28.30%、26.47%;豌豆幼苗的根数则在香豆酸浓度达到10-5mol/L时就显著受到抑制,较对照减少23.08%。
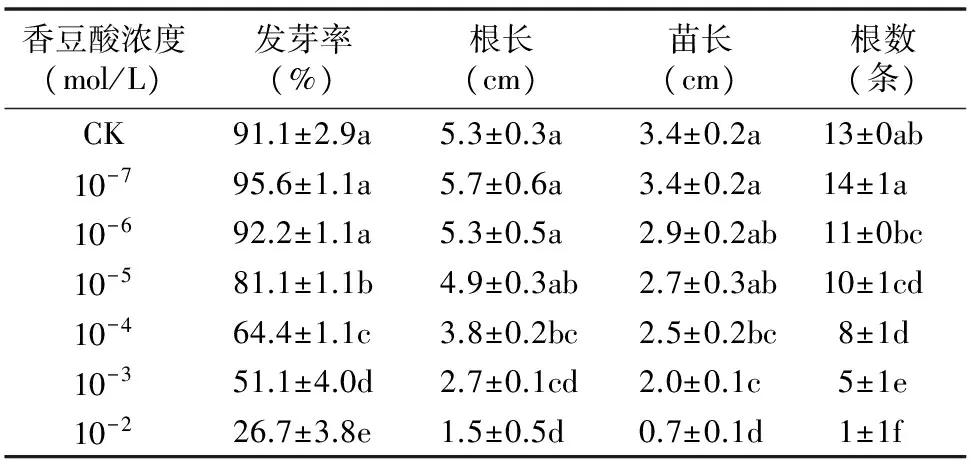
表1 不同浓度香豆酸对豌豆种子萌发特性的影响
注:同列数据后不同小写字母表示差异显著(P<0.05),表2同。
2.2 外源化感物质香豆酸对豌豆幼苗根际土壤酶活性及土壤酸碱度的影响
从表2可以看出,除了土壤酸性磷酸酶活性随着香豆酸浓度增加而呈递增的趋势外,其他5种土壤酶以及土壤pH值均有随着外源化感物质香豆酸浓度增加而呈递减的趋势。当香豆酸浓度为10-7mol/L时,土壤反硝化酶、蛋白酶较对照显著受到抑制,分别较对照降低了20.49%、8.97%;土壤脲酶、蔗糖酶活性和土壤pH值在香豆酸浓度达到 10-6mol/L 时较对照显著受到抑制,分别较对照降低 33.33%、20.13%、3.59%;土壤纤维素酶活性在香豆酸浓度达到10-5mol/L时较对照显著受到抑制,较对照降低 24.53%;而土壤酸性磷酸酶活性在香豆酸浓度达到 10-6mol/L 时较对照显著提高,较对照提高16.24%。
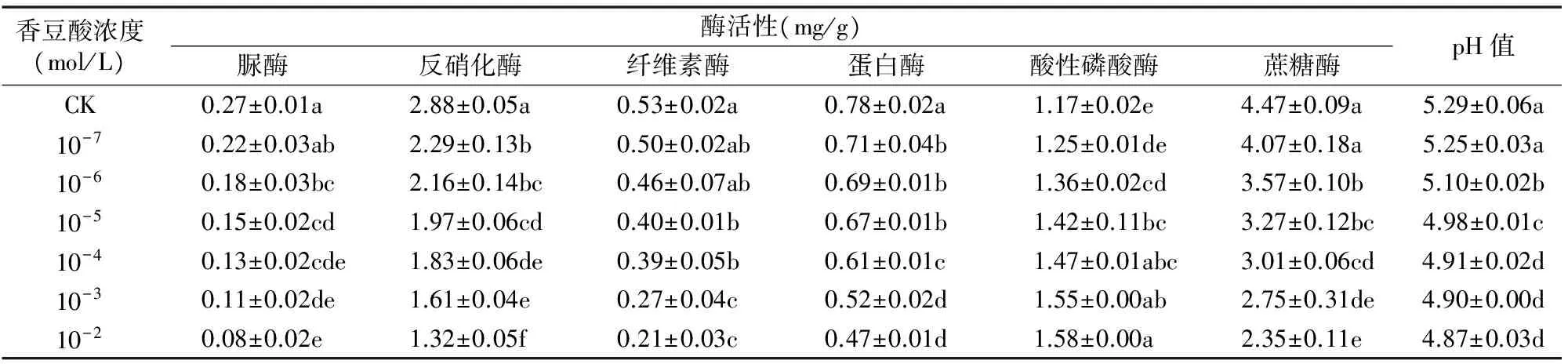
表2 不同浓度香豆酸对豌豆幼苗根际土壤酶活性及土壤酸碱度的影响
注:表中数值为平均值±SD(n=3)。
2.3 外源化感物质香豆酸对豌豆幼苗根际土壤微生物的影响
从图1可以看出,不同浓度的香豆酸对豌豆幼苗根际土壤中的细菌、真菌、放线菌的数量均产生不同程度影响,并且随着香豆酸浓度的增加,豌豆幼苗根际土壤中细菌、真菌、放线菌数量均呈递减的趋势。与对照比较,香豆酸浓度在 10-6mol/L 时较对照显著降低豌豆幼苗根际土壤细菌(图1-a)、放线菌(图1-c)的数量,分别较对照降低39.77%、31.86%。当香豆酸浓度达到10-4mol/L时,豌豆幼苗根际土壤内真菌数量较对照显著下降,较对照降低71.15%(图1-b)。
2.4 不同浓度香豆酸处理下豌豆幼苗根际土壤微生物数量及土壤酸碱度与土壤酶活性的相关关系
从表3可以看出,在不同浓度香豆酸处理下,豌豆幼苗根际土壤微生物数量均与土壤脲酶、反硝化酶、纤维素酶、蛋白酶、蔗糖酶活性以及土壤pH值呈极显著正相关,而与土壤酸性磷酸酶活性呈极显著负相关。其中,蔗糖酶与土壤pH值的相关系数最大,为0.910。
3 结论与讨论
外源化感物质香豆酸对豌豆种子萌发的影响。化感物质的作用影响植物生长的各个过程及不同的生理过程[15-17],其中影响最直接的是种子萌发阶段和幼苗生长阶段。研究结果表明,香豆酸对豌豆种子萌发及幼苗生长的形态指标均表现出低浓度促进、高浓度抑制的效应,本结论与前人的研究结果[18]类似。
外源化感物质香豆酸对豌豆幼苗根际土壤酶活性及土壤酸碱度的影响。香豆酸浓度的增大,降低了土壤pH值,提高了土壤酸性磷酸酶的活性,而降低了土壤脲酶、反硝化酶、纤维素酶、蛋白酶和蔗糖酶的活性,本研究结论与前人的研究结果[19-20]相一致。土壤是复杂的生态系统,其中土壤酶和土壤微生物对土壤中的养分循环起着重要的推动作用,而土壤理化性质又影响着土壤酶活性和土壤微生物的生物活性[21]。因此,从土壤学入手来研究化感作用是可行的,可以将土壤酶学同其他相关学科紧密结合起来进行化感作用研究。
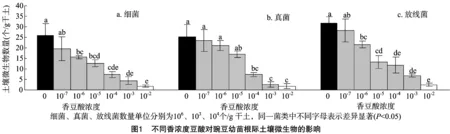
表3 土壤微生物数量以及土壤酸碱度与土壤酶活性的相关关系
注:“**”表示在0.01水平上显著。
外源化感物质香豆酸对豌豆幼苗根际微生物的影响。随着香豆酸浓度的增加,其幼苗根际细菌、真菌和放线菌的数量均呈递减的趋势,较低浓度10-6mol/L的香豆酸就已经显著抑制土壤细菌和放线菌的数量。表明不同浓度的香豆酸引起了豌豆根际微生物区系组成的定向改变,破坏了其根际微生物的平衡,潜在影响着植物,以及植物和微生物的相互作用[12]。相关研究表明,化感物质阿魏酸、4-叔丁基苯甲酸及苯甲醛进入土壤后,对微生物区系变化产生影响,导致土壤微生物胞内酶与胞外酶比例失调或改变酶的构象,增强脲酶活性[22];苜蓿根系分泌物皂苷对木霉具有抑制作用[23];白菜根系分泌物糖甙硫氰酸酯对泡囊丛枝菌根(VAM)萌发产生显著的抑制作用[2]。
香豆酸处理下豌豆幼苗根际土壤微生物、土壤酸碱度与土壤酶的相关关系。土壤细菌、真菌、放线菌等是土壤关键生态过程中土壤酶活性的重要来源[24],特定的土壤酶活性与细菌和真菌类群密切相关[25]。本研究结果表明,在不同浓度的香豆酸处理下,豌豆幼苗根际土壤微生物数量均与土壤酸性磷酸酶活性呈极显著负相关,而与其他5种土壤酶活性以及土壤pH值呈极显著正相关,表明外源化感物质香豆酸的处理影响豌豆的生长过程,改变土壤微生物区系,进而影响土壤酶活性,使得土壤环境条件向着不利于豌豆植株的生长方向演变。同时也证实了Aon等的理论,即特定的土壤酶活性与细菌、真菌等类群密切相关[25]。
[1]Chon S U,Choi S K,Jung S,et al. Effects of alfalfa leaf extracts and phenolic allelochemicals on early seedling growth and root morphology of alfalfa and barnyard grass[J]. Crop Protection,2002,21(10):1077-1082.
[2]孔垂华,胡 飞. 植物化感(相生相克)作用及其应用[M]. 北京:中国农业出版社,2001:105.
[3]何华勤,梁义元,贾小丽,等. 酚酸类物质的抑草效应分析[J]. 应用生态学报,2004,15(12):2342-2346.
[4]胡开辉,罗庆国,汪世华,等. 化感水稻根际微生物类群及酶活性变化[J]. 应用生态学报,2006,17(6):1060-1064.
[5]张恩平,赵茹月,张淑红. 土壤添加物对外源化感物质处理下番茄生长的影响[J]. 现代农业科技,2015(6):78-79.
[6]王振鸿. 豌豆的栽培技术[J]. 农村实用技术,2004(11):12-14.
[7]Saucke H,Ackermann K. Weed suppression in mixed cropped grain peas and false flax(Camelinasativa)[J]. Weed Research,2006,46(6):453-461.
[8]喻景权,松井佳久. 豌豆根系分泌物自毒作用的研究[J]. 园艺学报,1999,26(3):195-198.
[9]高 旭,张古文,胡齐赞,等. 自毒物质肉桂酸对豌豆幼苗生长及叶绿素荧光特性的影响[J]. 中国蔬菜,2013(8):44-49.
[10]宋 亮,潘开文,王进闯,等. 酚酸类物质对苜蓿种子萌发及抗氧化物酶活性的影响[J]. 生态学报,2006,26(10):3393-3403.
[11]李春龙. 水花生不同部位水浸液对豇豆种子萌发的影响[J]. 种子,2013,32(7):72-73.
[12]韩春梅,李春龙,叶少平,等. 生姜水浸液对生姜幼苗根际土壤酶活性、生物群落结构及土壤养分的影响[J]. 生态学报,2012,32(2):489-498.
[13]关松荫. 土壤酶及其研究方法[M]. 北京:中国农业出版社,1983:86-97.
[14]Visser S,Parkinson D. Soil biological criteria as indicators of soil quality:soil microorganisms[J]. American Journal of Alternative Agriculture,1992,7(2):33-37.
[15]朱 峰,何永福,叶照春. 大叶芥菜对眼子菜化感作用潜力的初步评价[J]. 杂草学报,2016,34(2):49-52.
[16]林 娟,殷全玉,杨丙钊,等. 植物化感作用研究进展[J]. 中国农学通报,2007,23(1):68-72.
[17]李 轩,卢海博,黄智鸿. 刺果瓜甲醇提取物对植物化感作用的研究[J]. 杂草学报,2016,34(4):23-27.
[18]周宝利,李 燕,李 东,等. 化感物质松香酸对辣椒种子萌发、
幼苗生长及根际微生物的影响[J]. 华北农学报,2010,25(5):155-160.
[19]黄益宗,冯宗炜,张福珠. 化感物质对土壤硝化反应影响的研究[J]. 土壤与环境,1999,8(3):203-207.
[20]林瑞余,于翠萍,戎 红,等. 苗期不同化感潜力水稻根际土壤酶活性分析[J]. 中国生态农业学报,2008,16(2):302-306.
[21]王延平,王华田. 连作人工林化感效应研究综述[J]. 世界林业研究,2008,21(4):25-30.
[22]袁光林,马瑞霞,刘秀芬,等. 化感物质对土壤脲酶的活性影响[J]. 环境科学,1998,19(2):55-57.
[23]Hoagland R E,Zablotowicz R M,Oleszek W A. Effects of alfalfa saponins oninvitrophysiological activity of soil and rhizosphere bacteria[J]. Journal of Crop Protection,2001,4(2):349-361.
[24]Diamantidis G,Efosse A,Potier P,et al. Purification and characterization of the first bacterial laccase in the rhizospheric bacteriumAzosprillumlipoferum[J]. Soil Biology and Biochemistry,2000,32(7):919-927.
[25]Aon M A,Colaneri A C. Temporal and spatial evolution of enzymatic activities and physico-chemical properties in an agricultural soil[J]. Applied Soil Ecology,2001,18(3):255-270.
