农杆菌介导的甜高粱遗传转化研究进展
2018-03-27庄义庆杜道林
杜 浩, 庄义庆, 黄 萍,3, 杜道林,3
(1.江苏大学环境与安全工程学院,江苏镇江 212013; 2.江苏丘陵地区镇江农业科学研究所,江苏句容 212013; 3.江苏大学农业工程研究院,江苏镇江 212013)
甜高粱[Sorghumbicolor(L.) Moench]最早起源于非洲,是粒用高粱的一个变种,其用途十分广泛,其种子可以作为食物也可以饲用,其茎秆则是高质量的青贮饲料。此外,甜高粱茎干中丰富的糖汁可以用于制糖和生产乙醇,而剩下的茎渣又是优质的造纸原材料,因此甜高粱又有“高能作物”的美誉,受到越来越多学者的关注[1-4]。
然而,甜高粱的种质资源匮乏,加上传统的有性杂交育种具有不亲和、育种周期长等缺点,使得甜高粱的种植和使用受到了限制。现代基因工程技术的发展,为甜高粱新品种的获得提供了一种快速有效的途径。Gao等认为,甜高粱是禾本科中最难进行组织培养和遗传转化的物种之一,获得适应性和实用性都较强的新品种较为困难[5]。目前,已开展较多的高粱遗传转化研究对甜高粱的功能基因分析、创建T-DNA插入突变体等具有重要的理论借鉴价值。本文针对甜高粱遗传转化所必须考虑的几个关键因素,就近些年来国内外的研究工作进行综述,以期为甜高粱的遗传转化提供理论参考。
1 甜高粱基因型及外植体的选择
与基因枪介导的遗传转化不同,农杆菌介导的甜高粱遗传转化受基因型的限制比较大,成功获得遗传转化的甜高粱品种不多且转化率较低。目前已报道的农杆菌介导法成功转化的甜高粱基因型有二十几种,而且不同基因型采用不同形式的受体材料,其转化效率也各不相同(表1)。其中,研究最广泛的是P898012、Tx430,转化率分别可以达到33.0%、8.3%。
愈伤组织是农杆菌介导法中最常用的一种外植体。Raghuwanshi等对32种甜高粱进行愈伤组织的诱导增殖研究,发现Ramada、R9188及Wray较其他品种在愈伤组织诱导与再生方面具有较强的优势,他们认为选择合适的甜高粱基因型获取愈伤组织是成功获得甜高粱遗传转化的关键因素之一[1]。除愈伤组织外,在农杆菌介导的甜高粱遗传转化中,最常用的外植体有幼胚、茎尖分生组织及幼穗等(表1)。采用幼胚作为外植体时,理想大小为1.0~1.5 mm,时间为授粉后9~14 d[6-9]。Zhao等采用农杆菌介导法对甜高粱P898012的幼胚进行遗传转化,首次成功获得甜高粱转基因植株[6]。Carvalho等发现,相对于预培养后的幼胚或者来源于幼穗的愈伤组织,农杆菌对幼胚的侵染较容易,他们还发现受损伤的幼穗能够抑制共培养中农杆菌的生长,不利于农杆菌的侵染[10]。除幼胚外,茎尖分生组织也是一种理想的外植体。刘宣雨等以芽顶端分生组织建立了甜高粱的高频、高效立体培养再生体系[11]。Yellisetty等采用SPV462的茎尖为外植体获得了34%~38%的转化率[12]。
2 受试材料的预处理
对甜高粱品种在农杆菌浸染前后进行适当的处理,有助于提高其转化效率。Carvalho等认为,来源于最佳生长条件下的幼胚在共培养后愈伤组织的形成状态较好,而来源于水中或者干旱胁迫条件下的幼胚,在共培养阶段会停止生长甚至死亡[10]。Zhao等发现,野外种植的甜高粱幼胚的转化率在 7.4%~10.1%,而温室收获幼胚的转化率在0.95%~2.17%[6],这与Lu等的研究结果相反,后者认为采用来源于温室的幼胚获得的转化率为1.4%,而野外获得的幼胚转化率仅为0.7%[7]。尽管对外植体的来源能否提高甜高粱转化率还存在争议,但可以认为外植体的来源也是影响转化率的一个重要因素。
Nguyen等发现,用4 ℃低温对甜高粱品种Sensako 85/1191 幼胚预处理1 d, 外植体的成活率及愈伤组织的形成
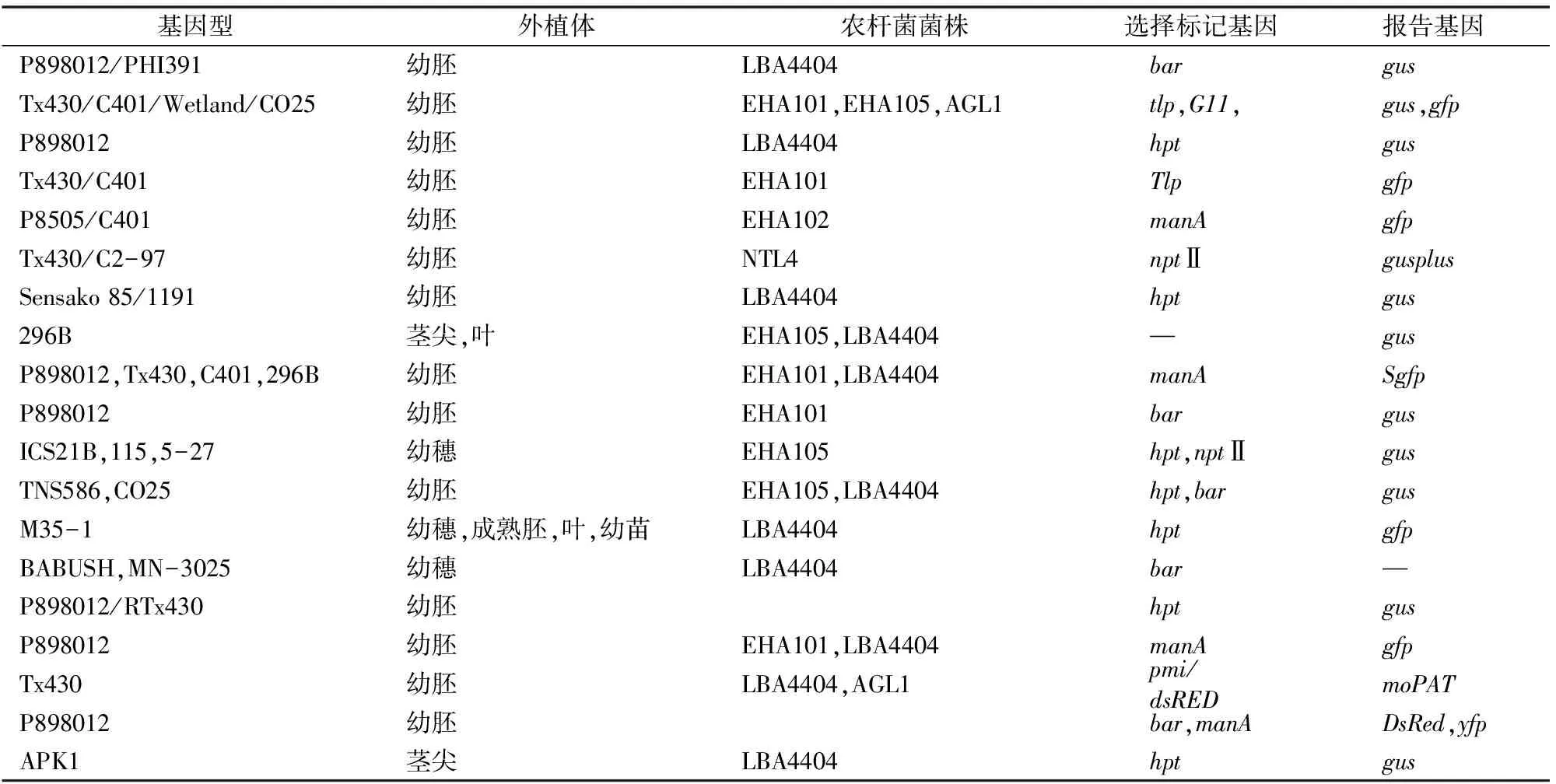
表1 用于转基因研究的不同品种甜高粱的遗传转化系统
注:bar表示双丙氨膦抗性,gfp表示绿色荧光蛋白,gus表示β-葡萄糖苷酸酶,hpt表示潮霉素磷酸转移酶,nptⅡ表示新霉素磷酸转移酶,manA表示磷酸甘露糖异构酶,DsRed表示红色荧光蛋白,yfp表示黄色荧光蛋白。
效果最佳,还可以有效降低培养基的更换频率[8]。而Gurel等发现,将甜高粱品种P898012的幼穗在4 ℃放置0~5 d,放置5 d的甜高粱幼穗GFP表达率仅为放置0 d的28.4%[9]。如果在农杆菌浸染前对幼胚进行加热处理会有助于提高GFP表达率,最佳处理条件为43 ℃预处理3 min,然后冷却至室温(25 ℃)并且不对愈伤组织进行离心处理,可获得GFP最高表达率,为49.1%,稳定转化率为8.3%。Gurel等接种前将幼胚在液体培养基上进行培养,使得GFP的表达率是在水中培养的2.67倍[9]。
3 培养基的成分
研究者对甜高粱培养基成分的改良主要集中在以下几个方面:(1)减少酚类物质产生。主要措施有选择培养基类型、更换培养基,以及添加椰子汁、聚乙烯聚吡咯烷酮(PVPP)、抗氧化剂(半胱氨酸和双对氯苯基三氯乙烷等)、活性炭。(2)提高愈伤组织的质量。主要措施是添加铜离子及激素。(3)添加乙酰丁香酮。
Raghuwanshi等发现,与DBC1、M11培养基相比,mM11培养基能够获得90%左右的胚性愈伤诱导率,显著提高了愈伤组织的形成率[1]。Zhao等认为,良好的愈伤组织是成功获得甜高粱遗传转化体的关键,通过对MS、N6培养基的比较研究发现,甜高粱在MS培养基上比在N6培养基上形成的愈伤组织更好且产生的酚类物质更少,此外,他们认为在培养基中添加椰子汁能有效抑制酚类物质的产生[6],这与Carvalho等的研究结果[10]相似,他们认为在共培养基中添加椰子汁能提高幼胚的成活率和转化效率。而Nguyen等却认为,添加椰子汁并未提高转化效率,同时他们在培养基中添加脯氨酸、脱落酸也并没有产生额外的正面效应[8],这与Elkonin等的研究结果[13]并不一致。Gao等认为,农杆菌会产生使愈伤组织坏死的物质,研究发现添加1% PVPP或者频换地更换培养基将有助于减少酚类物质的产生,促进新鲜愈伤组织的生长[5-6]。Lu等发现,PVPP较聚乙烯吡咯烷酮(PVP)对愈伤组织的坏死和褐化具有更好的效果[7],但Carvalho等则认为,虽然培养基中添加PVPP可以减轻愈伤组织的褐化程度,却不能降低幼胚的死亡率[10]。活性炭具有较强的吸附性能,Nguyen等在培养基中添加活性炭发现,活性炭能有效减少黑色物质的形成,显著提高外植体的存活率,然而活性炭的添加会吸附培养基中的2,4-D等活性成分,从而降低幼胚的愈伤诱导率[8]。
Lu等在共培养基中添加抗氧化剂半胱氨酸和双对氯苯基三氯乙烷(DDT)发现,遗传转化率会显著降低[7]。而Pandey的研究则表明,共培养基中添加半胱氨酸,GUS瞬时表达率最高,外植体的坏死率也会降低[14]。以上研究结果说明,半胱氨酸对转基因效率的影响在不同甜高粱品种之间并不相同。Wu等在共培养基中添加低浓度的铜离子并且在筛选培养基中添加一定量的苄氨基腺嘌呤(BAP),发现对提高甜高粱遗传转化的质量、生长速度及转基因愈伤组织的再生率都有很大的促进作用[15]。
此外,外源添加乙酰丁香酮是影响甜高粱遗传转化的关键因素之一。植物受到损伤后会产生酚类物质,乙酰丁香酮是双子叶植物受伤后产生的主要酚类化合物之一,这些物质会透过农杆菌的细胞膜活化和诱导VirA、VirG及其他Vir区基因的表达,从而将外源基因整合到植物的基因组中。而甜高粱缺少VIR介导化合物,这会降低农杆菌的遗传转化率。Gao等在农杆菌介导甜高粱遗传转化的研究中,添加了 100 μmol/L 乙酰丁香酮,获得了较高的转化效率[5-6]。Jambagi等研究则表明,200 μmol/L乙酰丁香酮可以获得最佳的转化效率[16-17]。这说明乙酰丁香酮在不同甜高粱品种的遗传转化中的最佳作用浓度并不相同,具体需要根据甜高粱的基因型和农杆菌的菌种来确定[18]。
4 筛选体系的选择
理想的筛选体系是在尽可能完全快速地将未转化的细胞或植株抑制或者杀死的同时尽可能多地保留转化植株,因此筛选体系的选择对甜高粱的遗传转化具有重要影响。筛选过程一般在甜高粱的再生阶段进行,也可以在植株开始分化后一段时间或者在转化后进行[19]。目前用于甜高粱遗传转化的筛选体系主要有正向筛选体系和负向筛选体系。早在1987年,就有研究者将bar基因用于抗除草剂筛选基因筛选系统中,bar基因的表达能使转基因植株产生对草胺膦(PPT)、双丙氨磷(bialaphos)、草丁膦(basta)等草甘膦类除草剂的抗性,这一类除草剂会阻断未转化植株的胺代谢途径,毒害其生长。在抗生素筛选体系中,主要应用hpt和nptⅡ基因,这2种基因编码氨基磷酸转移酶,使转化植株产生对卡那霉素、新霉素、巴龙霉素、潮霉素及G418等氨基糖苷类抗生素的抗性。筛选剂的浓度和筛选周期的选择对遗传转化的影响较大,Lu等研究认为,高浓度的筛选剂PPT(5 mg/L或者 10 mg/L)会产生酚类物质而使幼胚褐化,以及抑制转基因植株的再生,他们采用低浓度的筛选剂(2.5 mg/L PPT)配合较短的筛选周期(4~8周),并且在生芽培养基中去除筛选剂,获得了较高的阳性愈伤组织成活率[7]。
从表1中可以看出,在甜高粱遗传转化中广泛采用负向筛选系统。然而,Gao等研究认为,bar基因虽然在筛选转基因植株中具有较大的优势,但它可以通过甜高粱与其野生近缘种的天然杂交而逃逸到环境中,产生抗除草剂的“超级杂草”[20]。因此,近年来人们把目光转向正向筛选体系,目前应用最为广泛的正向筛选体系是磷酸甘露糖异构酶系统(PMI)。正向筛选系统不仅可以降低环境风险,而且可以避免使用酚类物质,从而有助于提高转化率[20-22]。在正向筛选系统中,以能编码磷酸甘露糖异构酶的manA基因为筛选基因,它能将6-磷酸甘露糖转化为6-磷酸果糖,使本来不能被植物利用的甘露糖能够转化为植株所能利用的物质。当以甘露糖作为筛选剂时,转化细胞能够以甘露糖作为碳源正常生长,而未转化细胞则由于没有可以利用的碳源停止生长[23]。
报告基因常被用来指示遗传转化的目的基因是否得到表达,然而,利用GUS作为一个报告系统的最大缺点是它需要一个破坏性的试验,妨碍了所鉴定的转化组织的进一步增殖和再生[24]。在转基因植株的早期检测过程中,GFP系统要优于GUS系统[15]。此外,Wu等也将DsRed(编码红色荧光蛋白)和YFP(编码黄色荧光蛋白)用于农杆菌介导的高粱转化研究中[15]。
5 农杆菌菌株的选择及转基因品种改良
通常用于植物遗传转化的农杆菌菌株有农杆碱型(琥珀碱型)、胭脂碱型、章鱼碱型3大类,其代表菌株分别为EHA101/EHA105、C58、LBA4404[21]。已报道的成功用于单子叶植物的菌株主要有LBA4404、C58、EHA101、EHA105、AGL0和AGL1[22]。从表1中可以看出,在甜高粱遗传转化体系中,最常用的菌种有EHA和LBA4404菌株。Pandey研究表明,EHA105比LBA4404和AGL1的瞬时表达率高,农杆菌EHA105对植物基因型依赖性较小,能有较高的GFP瞬时表达率[14]。而Wu等研究表明,AGL1与LBA4404相比,能够获得更高的转化效率,但LBA4404完整的单拷贝插入而没有质粒骨架的比例为96.4%,而AGL1为73.9%[15]。
近年来,科学家们通过农杆菌介导的植物遗传转化方法将不同来源、不同功能的基因导入甜高粱,成功获得了一批抗虫、抗病、抗逆,抗除草剂的多产、优质甜高粱品种,为新能源的开发利用作出了重大贡献。甜高粱所含人体所必需的氨基酸尤其是赖氨酸含量极低,容易引起儿童营养不良。Zhao等将富赖氨酸HT12基因转入甜高粱品种P898012和PHI391中,并成功获得含赖氨酸的高粱[28]。Lu等则将赖氨酸tRNA合成酶基因转入甜高粱品种P898012中,并提高了籽粒中赖氨酸的含量[10]。这些研究成果为世界尤其是非洲、亚洲地区以甜高粱为主食的国家带来了福音。
病虫害是影响作物提高产量和产率的关键因素,Savarimuthu等将能够编码杀虫蛋白的基因转入甜高粱中,可达到不使用除草剂就能杀死病虫的目的[24]。近年来,科学家们将杀虫晶体蛋白基因cry1Ab、Cry1C转入甜高粱中,在抗玉米螟和大螟方面取得了巨大进展[24,29-31]。在抗旱性研究方面,Gao等[5]和Yellisetty等[9]分别将编码索马甜蛋白的目的基因tlp和编码海藻糖-6-磷酸的TSP基因转入甜高粱中,获得了抗旱的甜高粱新品种。
6 展望
农杆菌介导的植物遗传转化法具有较高的转化效率,能够以单拷贝或者2~3拷贝稳定地转化到植物基因组中,并且能够稳定地遗传给后代[5-6,15,29,32]。尽管农杆菌介导的甜高粱遗传转化已经取得了较大的进展,但仍然面临一些亟待解决的问题:(1)农杆菌介导法对甜高粱的基因型及外植体类型要求较高;(2)酚类物质的产生对甜高粱外植体的毒害作用,不利于植株的再生;(3)缺乏较为成熟稳定的遗传转化体系;(4)重要农艺性状基因方面的研究缓慢,且转基因甜高粱的田间种植及推广还存在阻碍。至今尚未有甜高粱转基因植株的田间种植的正式报道。
今后对甜高粱遗传转化的研究可以集中在以下几个方面:(1)对转化体系中的参数进行优化,如外植体的类型、农杆菌菌株、共培养时间及筛选体系的优化等;(2)提高甜高粱的多抗性和营养品质改良,研究可以在后代分离标记基因的转基因体系,提高转基因植物的安全性;(3)发展应用分子标记、基因工程及分子设计等新元件和新技术,并与常规育种有机结合,加速新种质和品种的培育[26];(4)利用特殊的地理位置,在一些沿海滩涂及盐碱地规范化种植甜高粱品种,为甜高粱的应用推广打下基础。
[1]Raghuwanshi A,Birch R G. Genetic transformation of sweet sorghum[J]. Plant Cell Reports,2010,29(9):997-1005.
[2]Zheng L Y,Guo X S,He B,et al. Genome-wide patterns of genetic variation in sweet and grain sorghum (Sorghumbicolor)[J]. Genome Biology,2011,12(11):R114.
[3]Li M,Feng S,Wu L,et al. Sugar-rich sweet sorghum is distinctively affected by wall polymer features for biomass digestibility and ethanol fermentation in bagasse[J]. Bioresource Technology,2014,167(3):14-23.
[4]Olweny C,Jamoza J,Dida M M,et al. High genetic diversity for improvement of sweet sorghum [Sorghumbicolor(L.) Moench] genotypes for sugar and allied products[J]. Molecular Plant Breeding,2014,5(6):29-35.
[5]Gao Z,Jayaraj J,Muthukrishnan S,et al. Efficient genetic transformation ofSorghumusing a visual screening marker[J]. Genome,2005,48(2):321-333.
[6]Zhao Z Y,Cai T,Tagliani L,et al. Agrobacterium-mediated sorghum transformation[J]. Plant Molecular Biology,2000,44(6):789-798.
[7]Lu L,Wu X R,Yin X Y,et al. Development of marker-free transgenic sorghum[Sorghumbicolor(L.) Moench]using standard binary vectors with bar as a selectable marker[J]. Plant Cell,Tissue and Organ Culture,2009,99(1):97-108.
[8]Nguyen T V,Thanh Thu T,Claeys M,et al. Agrobacterium-mediated transformation of sorghum [Sorghumbicolor(L.) Moench] using an improved in vitro regeneration system[J]. Plant Cell Tissue and Organ Culture,2007,91(2):155-164.
[9]Gurel S,Gurel E,Kaur R,et al. Efficient,reproducibleAgrobacterium-mediated transformation of sorghum using heat treatment of immature embryos[J]. Plant Cell Reports,2009,28(3):429-444.
[10]Carvalho C H S,Zehr U B,Gunaratna N S,et al. Agrobacterium-mediated transformation of sorghum:factors that affect transformation efficiency[J]. Genetics and Molecular Biology,2004,27(2):259-269.
[11]刘宣雨,刘树君,宋松泉. 建立甜高粱(Sorghumbicolor)高频、高效再生体系的研究[J]. 中国农业科学,2010,43(23):4963-4969.
[12]Yellisetty V,Reddy L A,Mandapaka M. In planta transformation of sorghum [Sorghumbicolor(L.) Moench] usingTPS1 gene for enhancing tolerance to abiotic stresses[J]. Journal of Genetics,2015,94(3):425-434.
[13]Elkonin I A,Lopushanskaya R F,Pakhomova N V. Initiation and maintenance of friable,embryogenic callus of sorghum [Sorghumbicolor(L.) Moench] by amino acids[J]. Maydica,1995,40:153-157.
[14]Pandey A K,Bhat B,Balakrishna D,et al. Genetic transformation of sorghum [Sorghumbicolor(L.) Moench.][J]. International Journal of Biotechnology and Biochemistry,2010,6(1):45-53.
[15]Wu E,Lenderts B,Glassman K,et al. OptimizedAgrobacterium-mediated Sorghum transformation protocol and molecular data of transgenic sorghum plants[J]. In Vitro Cellular & Developmental Biology-Plant,2013,50(1):9-18.
[16]Jambagi S,Bhat R S,Bhat S,et al. Agrobacterium-mediated transformation studies in sorghum using an improvedgfpreporter gene[J]. SAT Agricultural Research,2010,8:1-5.
[17]Umamaheswari S. Agrobacterium mediated transformation of sorghum bicolor for disease resistance[J]. International Journal of Pharma and bio Sciences,2010,1(4):272-281.
[18]Jeoung J,Krishnaveni S,Muthukrishnan S. Optimization of sorghum transformation parameters using genes for green fluorescent protein andβ-glucuronidase as visual markers[J]. Hereditas,2002,137(1):20-28.
[19]Khanna H K,Daggard G E. Agrobacterium tumefaciens-mediated transformation of wheat using a superbinary vector and a polyamine-supplemented regeneration medium[J]. Plant Cell Reports,2003,21(5):429-436.
[20]Gao Z,Xie X,Ling Y,et al. Agrobacterium tumefaciens-mediated sorghum transformation using a mannose selection system[J]. Plant Biotechnology Journal,2005,3(6):591-599.
[21]Gurel S,Gurel E,Miller T I,et al. Agrobacterium-mediated transformation ofSorghumbicolorusing immature embryos[J]. Methods in Molecular Biology,2012,847(10):109-122.
[22]Urriola J,Rathore K S. Temporal and spatial activities of a rice glutelin promoter in transgenic sorghum[J]. Plant Cell,Tissue and Organ Culture,2014,116(2):227-234.
[23]Joersbo M. Advances in the selection of transgenic plants using non-antibiotic marker genes[J]. Physiologia Plantarum,2001,111(3):269-272.
[24]Girijashankar V,Swathisree V. Genetic transformation of Sorghum bicolor[J]. Physiology and Molecular Biology of Plants:an International Journal of Functional Plant Biology,2009,15(4):287-302.
[25]Ellar D. Colloid-osmotic lysis is a general feature of the mechanism of action ofBacillusthuringiensisδ-endotoxins with different insect specificity[J]. Biochimica et Biophysica acta,1987,924(3):509-518.
[26]刘宣雨,王青云,刘树君,等. 高粱遗传转化研究进展[J]. 植物学报,2011,46(2):216-223.
[27]Lowe B. Factors influencingAgrobacterium-mediated transformation of monocotyledonous species[J]. In Vitro Cellular & Developmental Biology-Plant,2004,40(1):31-45.
[28]Zhao Z,Glassman K,Sewalt V. Nutritionally improved transgenic sorghum[C]// Vasil I K. Plant Biotechnology 2002 and Beyond,Florida:Kluwer Academic Publishers,2003:413-416.
[29]Alan P. Development of transgenicSorghumbicolor(L.) Moench resistant to theChilopartellus(Swinhoe) throughAgrobacterium-mediated transformation[J]. Molecular Biology and Genetic Engineering,2014,2(1):1-8.
[30]张明洲,唐 乔,陈宗伦,等. 农杆菌介导Bt基因遗传转化高粱[J]. 生物工程学报,2009,25(3):418-423.
[31]朱 莉,郎志宏,李桂英,等. 农杆菌介导甜高梁转Btcry1Ah的研究[J]. 中国农业科学,2011,44(10):1989-1996.
[32]Howe A,Sato S,Dweikat I,et al. Rapid and reproducibleAgrobacterium-mediated transformation of sorghum[J]. Plant Cell Reports,2006,25(8):784-791.
[33]刘公社,周庆源,宋松泉,等. 能源植物甜高粱种质资源和分子生物学研究进展[J]. 植物学报,2009,44(3):253-261.
