草鱼肠道拮抗性芽孢杆菌的冻干保护剂优化研究
2018-03-27闫有利
张 涛,闫有利
(辽宁省淡水水产科学研究院,辽宁 辽阳 111000)
目前,随着我国淡水渔业的发展,高密度集成养殖成为我国淡水渔业养殖的主要发展趋势,而伴随的水产养殖动物疾病频发,死亡率增大等突出问题,也是水产工作者面临亟需解决的问题。现在常用的广谱抗菌类药物由于耐药性[1-6],药物残留导致的环境污染等副作用严重影响了淡水养殖产业的健康发展,所以如何寻找一条既可以提高水产养殖动物免疫能力,降低水产动物发病率和死亡率,又可以降低药物在长期使用后的不良副作用的途径势在必行。
芽孢杆菌(Bacillus)是一种好氧微生物,不仅能够改善水质[7-12],而且能在肠道中产生生物工程利用价值极高的脂肽类和肽类抗生素,同时能产生多种消化酶[13-14],提高水产养殖动物的免疫能力[15-16],并抑制有害细菌的繁殖,促进水产养殖动物的健康成长[17]。研究表明,饲料中添加芽孢杆菌能有效改变鱼虾肠道内的细菌种群,从而能显著提高水产养殖动物的非特异性免疫指标和消化酶活性,促进水产动物健康生长[18-24]。
已有的试验表明,在草鱼(Ctenopharyngodonidellus)肠道内筛选出抑菌活性很强的芽孢杆菌,并以一定含量搅拌到草鱼的饲料中,能提高草鱼的生长率,降低草鱼的发病率和死亡率。而如何较好的保存由草鱼肠道提取的病原拮抗性芽孢杆菌的活性和稳定性的报道较少。由脱脂乳、海藻糖、甘油、谷氨酸4种组分组成的混合保护剂可在冷冻干燥中对日本金龟子芽孢杆菌(B.popilliae)的孢子提供最有效的支持和保护,其最佳组合为10%脱脂乳,8%海藻糖,2%甘油,0.2%谷氨酸,在冻干过程中孢子的活性保持率达到90%以上[25]。笔者通过冷冻干燥方法,设计不同保护剂配方的正交试验,从而筛选出对草鱼拮抗性芽孢杆菌保存较好的试验配方,为后期草鱼养殖过程中的病害防治和制剂学研究提供一定的科学数据。
1 材料与方法
1.1 材料
草鱼健康无病,采自于辽宁省淡水水产科学研究院试验基地。麦芽糊精、海藻糖和甘氨酸来源、性状等见表1。

表1 试验药物性状
1.2 方法
1.2.1 病原拮抗性芽孢杆菌的处理
采用80 ℃水浴法[26]从草鱼肠道内分离并纯化芽孢杆菌,再通过牛津杯法[27]筛选出病原拮抗性芽孢杆菌。将实验室制得的病原拮抗性芽孢杆菌接种到装有灭过菌的普通液体培养基的三角瓶中,并在37 ℃恒温摇床中培养48 h;培养后的菌悬液放入灭菌过的50 mL离心管中,并在4 ℃、6000 r/min的冷冻离心机中离心6 min后,倒出上清液,留有的沉淀既是扩增后的菌体;在沉淀中加入灭菌生理盐水洗涤细胞,去除上清液;再加入灭菌的15 mL的不同保护剂溶液(表2~3),混匀后加入10 mL西林瓶中,每个西林瓶加入5 mL菌悬液,共3个平行组;放入-80 ℃冰箱24 h后,移至FD5505冷冻干燥机中冷冻干燥48 h,以冻干后菌体存活率为评价指标,优选病原拮抗性芽孢杆菌冻干保护剂配方,并以对照组为参照。
冻干条件:将每个装有5 mL菌悬液的西林瓶从-80 ℃冰箱拿出后,放至FD5505冷冻干燥机中,经过预冻后的菌悬液分别进行冷凝干燥和解析干燥;第一步冷凝干燥时,将冷冻干燥箱的前箱隔板温度设置为-35 ℃,后箱冷阱温度设置为-80 ℃,时间设置为25 h,压力设置为10 Pa;第二步解析干燥时,将冷冻干燥箱的前箱隔板温度设置为20 ℃,后箱冷阱温度设置为-80 ℃,时间设置为23 h,压力设置为10 Pa。冷凝干燥和解析干燥结束后,对每个西林瓶进行手动压盖,即制成菌体冻干品。
冻干后菌体成活率:冻干后的菌体用5 mL蒸馏水加入10 mL西林瓶中复溶,并采用平板菌落计数法[28],分别记录菌体冻干前后的菌体数,并通过1.3中的公式计算冻干后菌体成活率。
设置麦芽糊精、甘氨酸和海藻糖3个变量因素,采用三因素三水平(表2),即L9(34)正交试验法优选病原拮抗性芽孢杆菌冻干保护剂最佳配比含量,每组试验设定3个平行组。
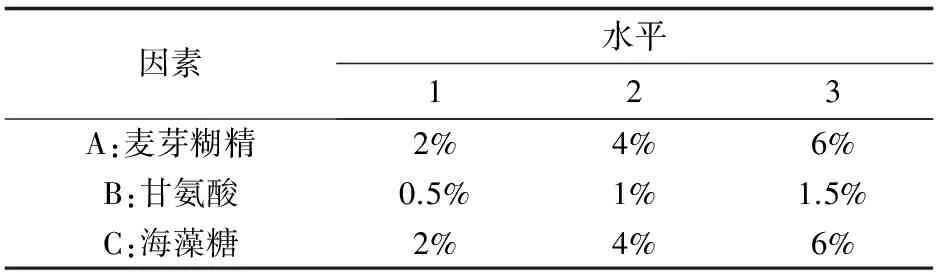
表2 因素水平表
1.2.2 菌体稳定性试验
根据上述正交试验测试结果,筛选出菌体成活率较高的两组冻干保护剂配方,分别将实验室制得的菌体加入筛选出的冻干保护剂后(方法同1.2.1),经过冷冻干燥放在4 ℃冰箱中保存,在分别测试1、3、5、7、9、12个月后的菌体成活率,每组3个平行(表5~6)。菌体成活率测试方法与1.2.1相同。
1.3 数据的统计和分析
记录冻干后菌体成活率,试验数据用平均值±标准差表示,采用SPSS 15.0在α=0.05水平下进行统计分析,数据经方差分析后进行组间两两比较和显著性检验(P<0.05),并采用层次分析法统计正交试验结果[29]。
式中,S为菌体成活率,S1为菌体冻干前菌群数量(cfu/mL),S2为菌体冻干后菌群数量(cfu/mL)。
2 结果与分析
以冻干后菌体存活率为考察指标时,极差R值大小显示各因素对菌体存活率作用影响为A>B>C(表3)。其中,B、C因素R值<空列组R值,说明A因素对冻干后菌体存活率作用最重要;其中,A1B3C3的冻干保护剂配方对菌体存活率高达(93.30±2.21)%,高于A1B1C1和A2B1C2的冻干保护剂配方对菌体存活率,但不显著(P>0.05),显著高于其他冻干保护剂配方对菌体的存活率(P<0.05)。
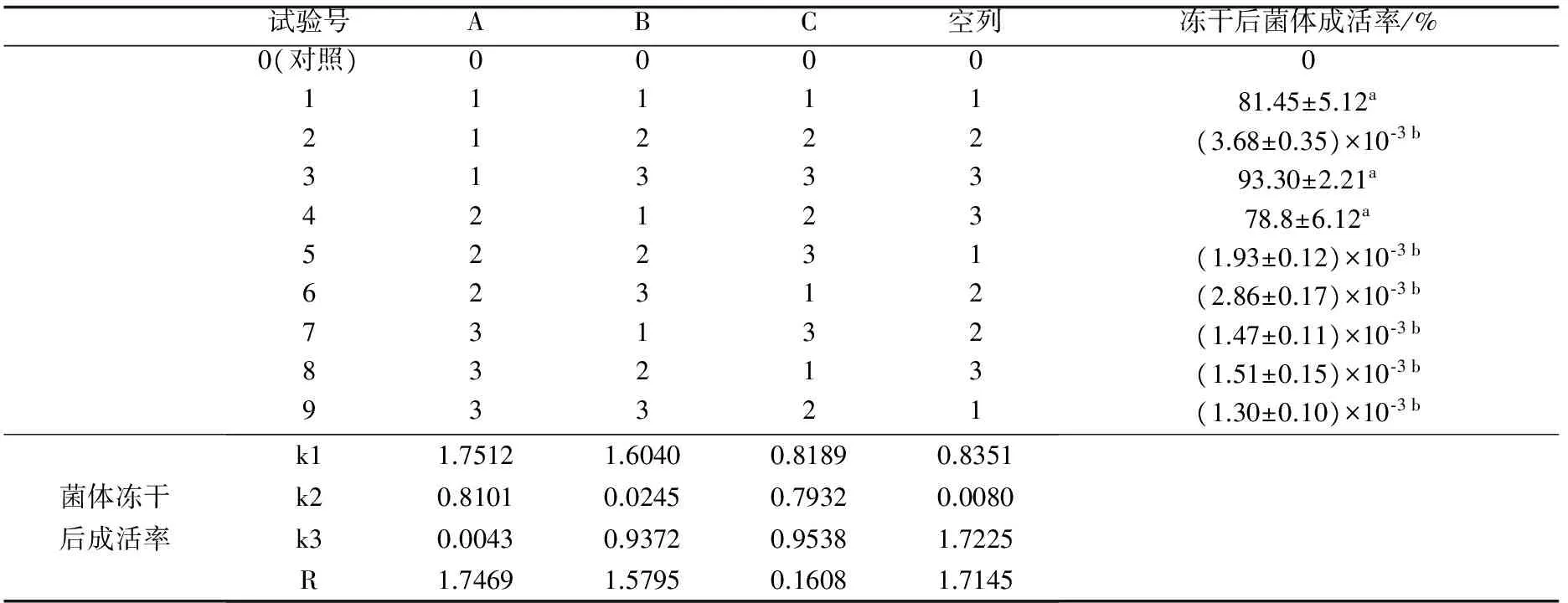
表3 菌体冻干保存试验测定结果
注:同列中标有不同字母的平均值之间有显著性差异(P<0.05).
方差分析表明各因素无显著差异(P>0.05)(表4)。从正交试验(表3)和方差分析(表4)综合结果可知,以冻干后菌体存活率为考察指标时,菌体冻干保护剂最佳配方为A1B1C3。由正交试验(表3)和方差分析(表4)综合结果中,筛选出2种冻干保护剂配方(表5)。
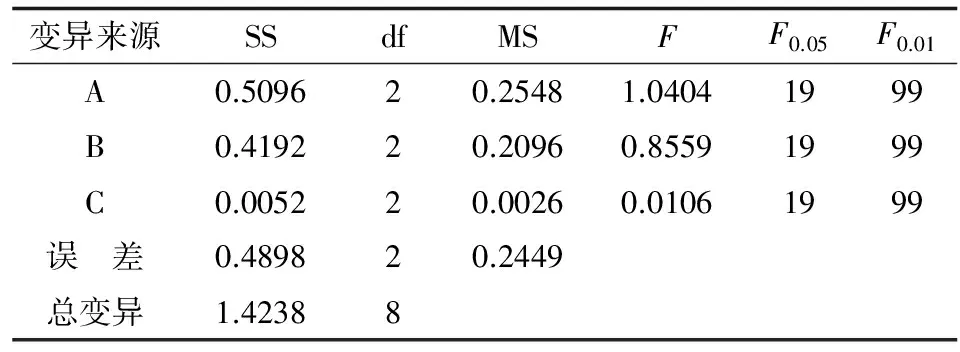
表4 菌体冻干后成活率方差分析结果

表5 菌体冻干保存剂的筛选配方
在经过12个月的稳定性试验(表6)可知,A1B1C3的冻干保护剂配方对菌体存活率高于A1B3C3的冻干保护剂配方对菌体存活率,但不显著(P>0.05)。
综合上述正交试验和稳定性试验结果分析,A1B1C3的冻干保护剂配方可以有效的保护菌体的成活;在经过12个月后,仍然可以使菌体达到80%以上的存活率,基本达到了益生菌经过长期保存而不失活的目的。

表6 菌体冻干后稳定性试验
注:同列中标有不同字母的平均值之间有显著性差异(P<0.05).
3 讨 论
目前,我国关于芽孢杆菌在淡水渔业养殖上的应用报道较多[30-33]。这些报道表明,芽孢杆菌不仅具有改善水质的能力,而且能够有效改变水产养殖动物的肠道细菌种群,抑制有害细菌的产生,从而提高了水生动物的防病能力;而如何能在水产养殖应用过程中保存其生物活性和稳定性是芽孢杆菌提取和保存工艺的重要一环。
本试验采用冷冻干燥的方法保存病原拮抗性芽孢杆菌,与其他方法比较,主要有以下几方面优势:(1)芽孢杆菌属于原核细胞型微生物,对温度比较敏感,在高温条件下易繁殖、老化和死亡;而在低温干燥条件下,芽孢杆菌其生物活性损失较少。(2)芽孢杆菌属于好氧微生物,在真空干燥条件下,环境的氧气极少,芽孢杆菌处于休眠状态,不易繁殖,其生物活性可以得到有效保护。(3)冷冻干燥法可以去除菌悬液95%~99%的水分,并保持芽孢杆菌生物活性的稳定性,从而便于其运输和长期保存。
微生物冻干燥过程中赋形剂的选择是决定冷冻干燥能否成功的关键因素。目前,根据化学性质,微生物冻干赋形剂有单糖(葡头糖、半乳糖等)、二糖(乳糖、海藻糖等)和多糖类(糊精、淀粉等),多元醇类保护剂(甘油、甘露醇等)、氨基酸类保护剂(甘氨酸、色氨酸等)、蛋白质和多肽类保护剂(生长因子、激素等)以及聚合物类保护剂(牛血清白蛋白、麦芽糊精等)[34]。
为防止冻干过程中芽孢杆菌生物活性的损失,本试验选取了海藻糖、麦芽糊精和甘氨酸作为芽孢杆菌的冻干赋形剂,其主要依据以下几方面因素[35]:(1)与单糖、多糖和还原性二糖比较,海藻糖属于非还原二糖,不存在与冻干品发生还原性Mailard反应;同时,海藻糖作为二糖能在冻结过程中更好的起到低温保护剂的作用,并在干燥脱水过程中起到脱水保护剂的作用。(2)与多元醇类、多肽类及其他聚合物赋形剂比较,麦芽糊精作为一种聚合物赋形剂成本较低,在冷冻干燥过程中,其优先析出,具有一定的表面活性,并在细菌分子之间产生“位阻”作用,从而减少芽孢杆菌的生物活性损失;同时,麦芽糊精能更好的提高菌悬液水溶液黏度,提高玻璃化转变温度,抑制小分子赋形剂海藻糖的结晶和pH值的降低;在微生物冷冻干燥过程中,麦芽糊精在冻结过程和脱水过程中都能提供更好的有效保护作用。(3)笔者在前期试验筛选氨基酸类冻干赋形剂发现,芽孢杆菌在快速冻结过程中,甘氨酸作为氨基酸类冻干赋形剂,能够更有效的抑制菌悬液的pH值变化,减少了芽孢杆菌生物活性的损失。(4)聚合物冻干保护剂一般不单独使用,当麦芽糊精作为一种聚合物保护剂与糖类或氨基酸类物质联合使用时,可以与蛋白质物质形成很强的氢键作用,更好的保证了冻干微生物的稳定性。
综合上述试验结果和几方面因素分析,芽孢杆菌的生物活性总体趋势与时间有一定关系,时间越长,生物活性越低,说明这3种赋形剂对微生物细菌冻干粉活性影响随着时间的增长会逐渐降低,从而影响到芽孢杆菌生物活性稳定性。3种赋形剂对芽孢杆菌生物活性影响依次为麦芽糊精>甘氨酸>海藻糖,各赋形剂差异虽不显著(P>0.05),但海藻糖、甘氨酸并不是起主要作用的赋形剂,这说明聚合物类的赋形剂保护功能强于低聚糖及氨基酸类赋形剂。上述3种赋形剂的正交试验结果表明,当以冻干后菌体成活率为评价指标时,3种赋形剂最佳配方为A1B1C3。
通过试验筛选出的病原拮抗性芽孢杆菌保存配方A1B1C3,即2%麦芽糊精,0.5%甘氨酸,6%海藻糖,经过12个月保存后,其生物活性仍然超过80%,为后期草鱼养殖过程中的病害防治,减少鱼体发病和死亡率起到了保驾护航的作用。
[1] Claude E B,Laurence M.Risks associated with the use of chemicals in pond aquaculture[J].Aquacultural Engineering ,1999,20(2):113-124.
[2] 张林中.耐药性产生的原因及控制措施[J].渔业致富指南,2011(23):64.
[3] 张俊楠.水产用抗菌药物耐药性的相关研究进展[J].江西水产科技,2017(2):33-34.
[4] 蔡丽娟,许宝青,林启存等.水产致病性嗜水气单胞菌耐药性比较与分析[J].水产科学,2011,30(1):42-45.
[5] 林璐明,苏跃朋.水产抗生素类药物的耐药性机制及合理应用[J].河北渔业,2009(5):42-43.
[6] 王瑞旋,陈毕生.喹诺酮类药物在水产养殖中的应用研究概况[J].南方水产,2007,3(3):73-79.
[7] Lalloo R,Ramchuran S,Ramduth D,et al.Isolation and selection of Bacillus spp.as potential biological agents for enhancement of water quality in culture of ornamental fish [J].J Appl Microbiol,2007,103(5):1471-1479.
[8] 李卫芬,邓斌,陈南南,等.芽孢杆菌对草鱼生长和肠粘膜抗氧化功能及养殖水质的影响[J].水生态学杂志,2012,33(1):65-70.
[9] 罗勇胜,李卓佳,杨莺莺,等.光合细菌与芽孢杆菌协同净化养殖水体的研究[J].农业环境科学学报,2006,25(增刊):206-210.
[10] 陈芳,杨代勤,苏应兵,等.芽孢杆菌对黄鳝养殖水体水质的影响[J].养殖与饲料,2008(6):83-85.
[11] 宋学宏,耿英慧,杨彩根,等.一种生物净水剂对河蟹养殖水体水质净化效果研究[J].水生态学杂志,2009,30(6):89-93.
[12] 张峰峰,谢凤行,赵玉洁,等.枯草芽孢杆菌水质净化作用的研究[J].华北农学报,2009,24(4):218-221.
[13] Popova Z P,Nikonorova A K.A new probiotic for animal husban [J].Zootekhniya,1995(11):21-22.
[14] 张德强,关晓燕.枯草芽孢杆菌株B2的生长特性及其对仿刺参的益生特性[J].水产科学,2016,35(3):234-238.
[15] 华雪铭,周洪琪,张冬青,等.多糖和益生菌对暗纹东方鲀免疫功能的调节[J].水产学报,2006,30(2):230-235.
[16] 刘慧玲,黄翔鹄,李长玲,等.不同浓度的枯草芽孢杆菌对罗非鱼鱼苗的养殖水体水质及其抗病能力的影响[J].水产养殖,2009,30(10):5-9.
[17] Capkin E,Altinok I.Effects of dietary probiotic supplementations on prevention/treatment of yersiniosis disease [J].Journal of Applied Microbiology,2009,106(4):1147-1153.
[18] 沈文英,傅玲琳,李卫芬.枯草芽孢杆菌表达的VP28对南美白对虾免疫力和抗病毒感染的影响[J].水生生物学报,2012,36(2):375-378.
[19] Kummar R,Mukherjee S C,Prasad K P,et al.Evaluation ofBacillussubtilisas a probiotic to Indian major carpLabeorohita[J].Aquaculture Research,2006,37(12):1215-1221.
[20] Aly S M,Ahmed Y A G,Aharrrb A A A,et al.Studies onBacillussubtilisandLactobacillusacidophilus,as potential probiotics,on immune response and resistance of tilapia nilotica (Oreochriomisniloticus) to challenge infections [J].Fish & Shellfish Immunology,2008,25(1/2):128-136.
[21] Ai Q,Xu H,Mai K,et al.Effect of dietary supplementation ofBacillussubtilisand fructooligosaccharide on growth performance,survival,non-specific immune response and disease resistance of juvenile yellow croaker,Larimichthyscrocea[J].Aquaculture,2011,317(1/4):155-161.
[22] Shen W Y,Fu L L,Li W F,et al.Effect of dietary supplementation withBacillussubtilison the growth,performance,immune response and antioxidant activities of the shrimps (Litopenaeusvannamei) [J].Aquaculture Research,2010,41(11):1691-1698.
[23] 丁贤,李卓佳,陈永青,等.芽孢杆菌对凡纳对虾生长和消化酶活性的影响[J].中国水产科学,2004,11(6):580-584.
[24] 江永明,付天玺,张丽,等.微生物制剂对奥尼罗非鱼生长及消化酶活性的影响[J].水生生物学报,2011,36(6):998-1004.
[25] 李石.体外培养的日本金龟子芽孢杆菌的回收及冷冻干燥保护剂的研究[D].天津:天津大学,2011.
[26] 周金敏,吴志新,曾令兵,等.黄颡鱼肠道病原拮抗性芽孢杆菌的筛选与特性研究[J].水生生物学报,2012,36(1):78-84.
[27] Hjelm M,Bergh O,Riaza A,et al.Selection and identification of autochthonous potential probiotic bacteria from turbot larvae (Scophthalmusmaximus) rearing units[J].Systematic and Applied Microbiology,2004,27(3):360-371.
[28] 沈萍,范秀容,李广武.微生物学实验[M].3版.北京:高等教育出版社,1996:92-95.
[29] 郭穗勋,黄榕波.正交试验层次分析法[J].大学数学,2004,20(1):114-117.
[30] 沈斌乾,陈建明,郭建林,等.饲料中添加枯草芽孢杆菌对青鱼生长、消化酶活性和鱼体组成的影响[J].水生生物学报,2013,37(1):48-53.
[31] 程远,黄凯,黄秀芸,等.饲料中添加枯草芽孢杆菌对吉富罗非鱼幼鱼生长性能、免疫力和抗氧化功能的影响[J].动物营养学报,2014,26(6):1503-1512.
[32] 李卫芬,张小平,宋文辉,等.养殖水体中添加芽孢杆菌对草鱼免疫和抗氧化功能的影响[J].中国水产科学,2012,19(6):1027-1033.
[33] 白亚荣.一种微生态制剂对鲫鱼养殖水化学指标的影响[J].当代畜禽养殖业2014(2):9-11.
[34] 于永翔.海水养殖中常见病原菌冻干保护剂配方与冻干工艺研究[D].青岛:中国海洋大学,2014.
[35] 华泽钊,刘宝林,左建国.药品和食品的冷冻干燥[M].北京:科学出版社,2007.
