伪结核棒状杆菌的分离鉴定及病原性研究
2018-03-26李基棕李文良杨蕾蕾张纹纹江杰元
李基棕, 李文良, 毛 立, 郝 飞, 杨蕾蕾, 张纹纹, 江杰元
(江苏省农业科学院兽医研究所/农业部兽用生物制品工程技术重点实验室/国家兽用生物制品工程技术研究中心,江苏南京 210014)
羊伪结核(pseudotuberculosis)又称干酪性淋巴结炎(caseous lymphadenitis),是由伪结核棒状杆菌(Corynebacteriumpseudotuberculosis)引起的一种人兽共患慢性传染病[1]。该病主要多发于山羊和绵羊,但也可感染骆驼、马、牛和兔等多种动物[2]。病原体可通过破损的皮肤、污染的饲料及破溃的脓汁在羊群中直接接触传播,发病羊体温升高、食欲减退、生产性能下降、皮下及淋巴结出现化脓性病变,呈脓性干酪样坏死,孕畜出现死胎、畸胎,严重者导致死亡[3]。由于该病发病较慢,致死率不高,常被人们忽视。然而病原菌一旦入侵畜群,将很难被清除,常给养殖户带来较大的经济损失,因此被农业部列为三类动物疫病[4]。安徽省某羊场发病羊皮下和周边淋巴结出现局灶性脓肿,患病羊精神食欲较差、消瘦、被毛粗乱。切开肿块,流出或可挤出黄白色脓汁,本研究从脓汁中分离鉴定1株伪结核棒状杆菌,同时进行了耐药谱分析和致病性研究,以期为该病的防治提供科学依据。
1 材料与方法
1.1 主要试剂
绵羊鲜血琼脂培养基、微量生化反应管、抗菌药物药敏纸
片均购自浙江杭州微生物试剂公司;TaqDNA聚合酶、dNTP、DNA Marker等均购自北京全氏金生物技术有限公司。其他试剂均为国产分析纯。
1.2 试验动物
6~8周龄BALB/c小鼠购自扬州大学比较医学中心;4月龄左右山羊购自无伪结核棒状杆菌感染羊场。
1.3 病原的分离
将无菌采集的脓汁接种于鲜血琼脂平板上,培养24 h后,挑取单个菌落进行纯化。并将纯化的菌落涂片进行革兰氏染色镜检。
1.4 生化试验
选取纯化的菌落,分别接种于葡萄糖、果糖、麦芽糖、硫化氢等生化鉴定管中,置于37 ℃恒温培养箱中培养,观察其生化特性。
1.5 PCR鉴定
参照Çetinkaya等设计的伪结核棒状杆菌16S rRNA引物(P1:5′-ACCGCACTTTAGTGTGTGTG-3′;5′-P2:TCTCTAC GCCGATCTTGTAT-3′)[5]进行PCR扩增,预期扩增片段大小为816 bp。以纯培养细菌的染色体DNA为模板,PCR反应体系为25 μL:TaqDNA聚合酶0.5 μL,DNA模板2 μL,引物P1、P2各1 μL,10×PCR Buffer 2.5 μL,dNTPs 1 μL,无菌水17 μL。反应程序:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。反应结束后取PCR产物于1.0%的琼脂糖凝胶中电泳检测。将目的片段切胶回收,并与pMD18-T载体连接,转化DH5α感受态细胞,经鉴定正确后送江苏南京金斯瑞生物技术有限公司测序。
1.6 耐药性试验
采用纸片扩散法进行药敏试验,将分离的伪结核棒状杆菌均匀涂布于鲜血琼脂平板上,然后将药敏纸片紧贴于琼脂表面,37 ℃培养24 h,测量抑菌圈直径。
1.7 人工感染试验
1.7.1 小鼠致病力试验 将分离纯化的菌株接种于含犊牛血清的LB液体培养基中,37 ℃培养24 h,取菌液10倍系列稀释,进行活菌平板计数。取小鼠40只,随机分为8组,1~5组小鼠进行腹腔注射,每只0.2 mL菌液(109、108、107、106、105CFU/mL),6~7组小鼠进行皮下注射,每只0.2 mL菌液(109、108CFU/mL),测定其致病性,对照组注射等量的培养基。对死亡小鼠进行剖检,观察组织病变,同时采集肺、脾、肝进行细菌分离培养。
1.7.2 山羊致病力试验 另取10只健康山羊,随机分成5组,每组2只,分别颈部皮下注射108、106、104、103CFU/mL菌液,每只2.0 mL,对照组注射等量的培养基。接种后每天测量体温,观察临床症状并记录结果,连续观察21 d。
1.8 组织病理学观察
将皮下接种的小鼠和山羊剖检后进行病理学检查,采集注射部位的皮肤、肌肉及周边淋巴结固定于10%福尔马林中。样品固定后进行常规脱水,石蜡包埋,连续切片,HE染色后镜检观察。
2 结果与分析
2.1 发病情况及临床症状
该养殖场的83只羊中,有9只发病,发病率达10.84%。发病羊的头颈部、腹部、四肢或肩前淋巴结处出现大小不等的脓肿,触之有波动感,随着时间延长,脓肿逐渐增大,最后形成脓胞。切开脓胞,脓汁呈牙膏状,白色至灰白色。发病羊同时出现体温升高、精神沉郁、食欲减退、体质量下降等症状。
2.2 细菌的分离培养
病原菌在绵羊鲜血琼脂平板上培养24 h后,形成圆形、不透明、干燥、松脆、瓷白色、不溶血的小菌落。革兰氏染色呈阳性小球杆菌(图1)。

2.3 生化鉴定
该菌可发酵葡萄糖、果糖、麦芽糖、蔗糖、甘露糖,不发酵乳糖、木糖、甘露醇,不产生硫化氢,硝酸盐还原阴性,符合伪结核棒状杆菌生化特性。
2.4 PCR鉴定
将PCR产物在1.0%琼脂糖凝胶中电泳,得到大小约800 bp的特异性条带,与预期结果一致(图2)。经测序分析,该片段大小为816 bp;经BLAST比对分析发现,与GenBank中收录的CP003212、CP003217、CP0131146、CP013327、CP013697、CP013698、CP013699、BX248356、BX248357、BX248359、BX248360、NR037079、NR103937、NR117209、EU352542、GQ087586等伪结核棒状杆菌的16S rRNA同源性高达99.0%以上,进一步确定该分离株为伪结核棒状杆菌。进化树分析发现,该毒株与CP0131146、CP013697、CP013698、CP013699、CP013327亲缘关系最近,共同组成一组微小分支(图3)。

2.5 药敏试验
分离的菌株进行药敏试验,结果表明该细菌对青霉素、头孢曲松、左氧氟沙星和氟苯尼考敏感;对新霉素、庆大霉素、氨苄西林、恩诺沙星、头孢噻肟和红霉素中度敏感;对链霉素、丁胺卡那霉素、环丙沙星、林可霉素和大观霉素耐药(表1)。

2.6 致病性试验
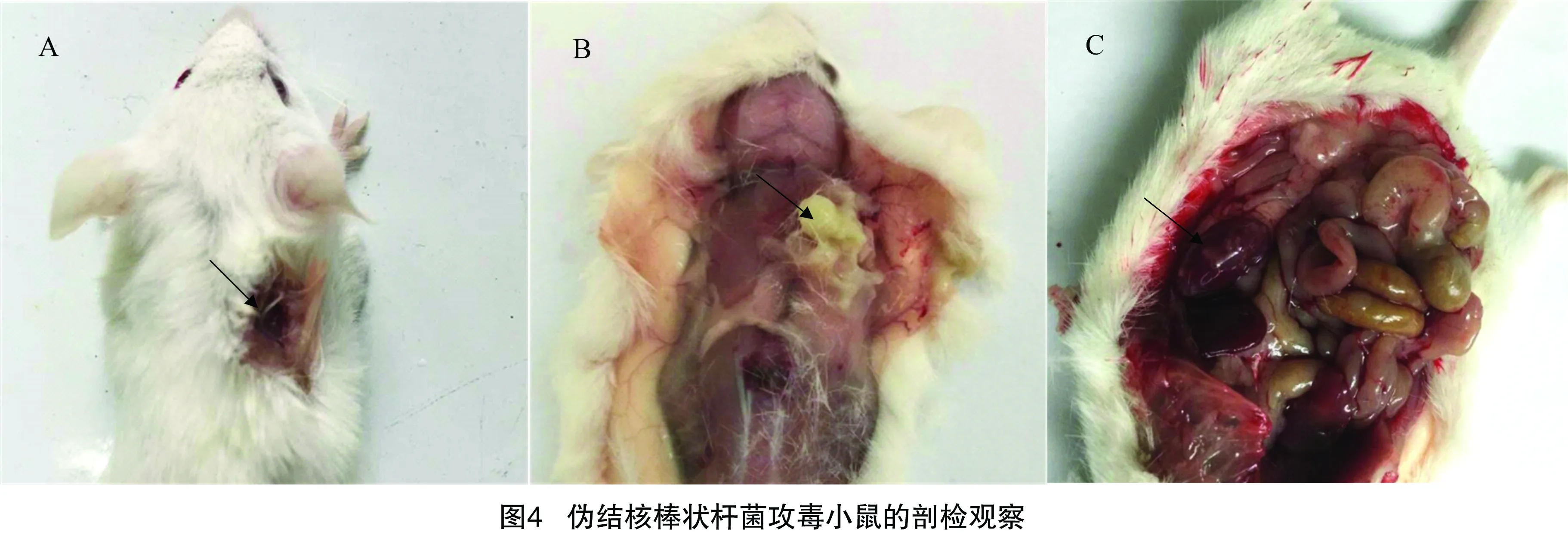
2.6.1 小鼠致病性试验结果 不同剂量细菌腹腔接种小鼠,5 h后0.2×109、0.2×108CFU/mL剂量组小鼠均有不同程度发病,10 h后除0.2×105CFU/mL剂量组均出现死亡,剖检可见肝脏和脾脏脓肿,对照组小鼠未见异常(表2),该分离菌对6~8周龄BALB/c小鼠的LD50为1×10-6.0CFU/mL。如图4-A、图4-B可见,皮下注射小鼠在接种部位出现大小不等的脓肿;如图4-C可见,剖检接种部位化脓,肾脏表面有多个化脓灶。
2.6.2 山羊致病性试验结果 2×108CFU/mL攻毒组山羊在感染2 d起出现精神沉郁、采食量减少等症状,体温持续升高3 d以上(40.1~40.9 ℃)。感染3 d,注射部位肿胀明显,
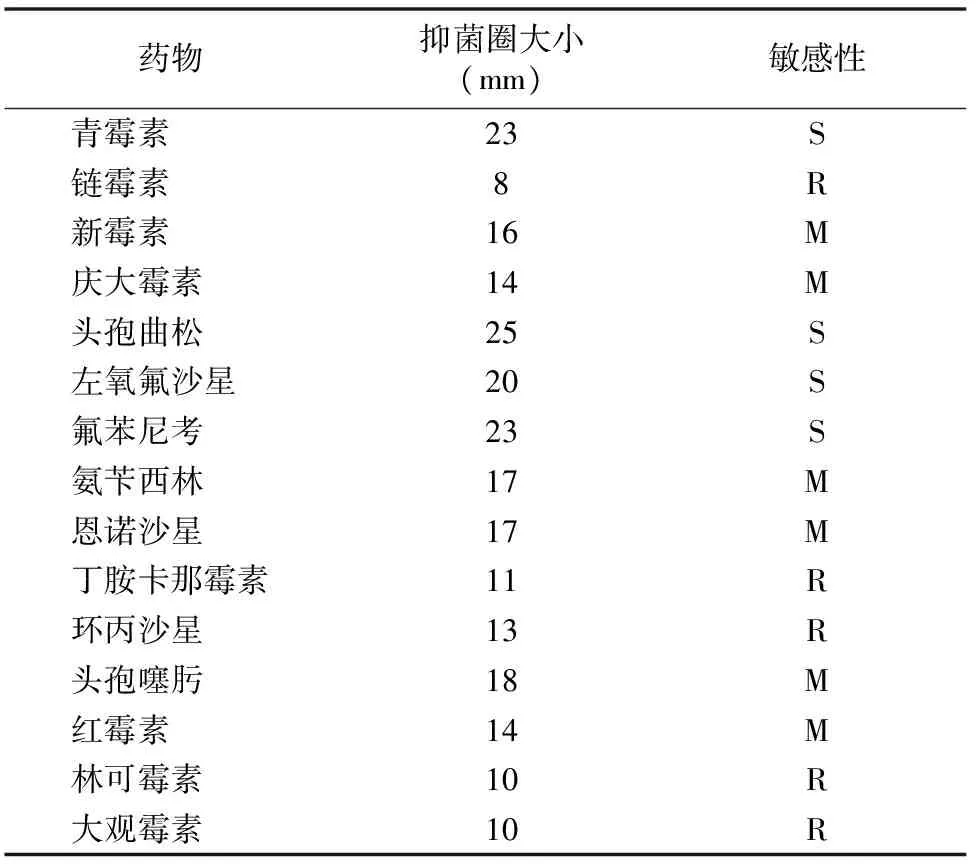
表1 伪结核棒状杆菌分离株药敏试验结果
注:R表示耐药,S表示敏感,M表示中度敏感。

表2 不同稀释度伪结核棒状杆菌的致病性试验
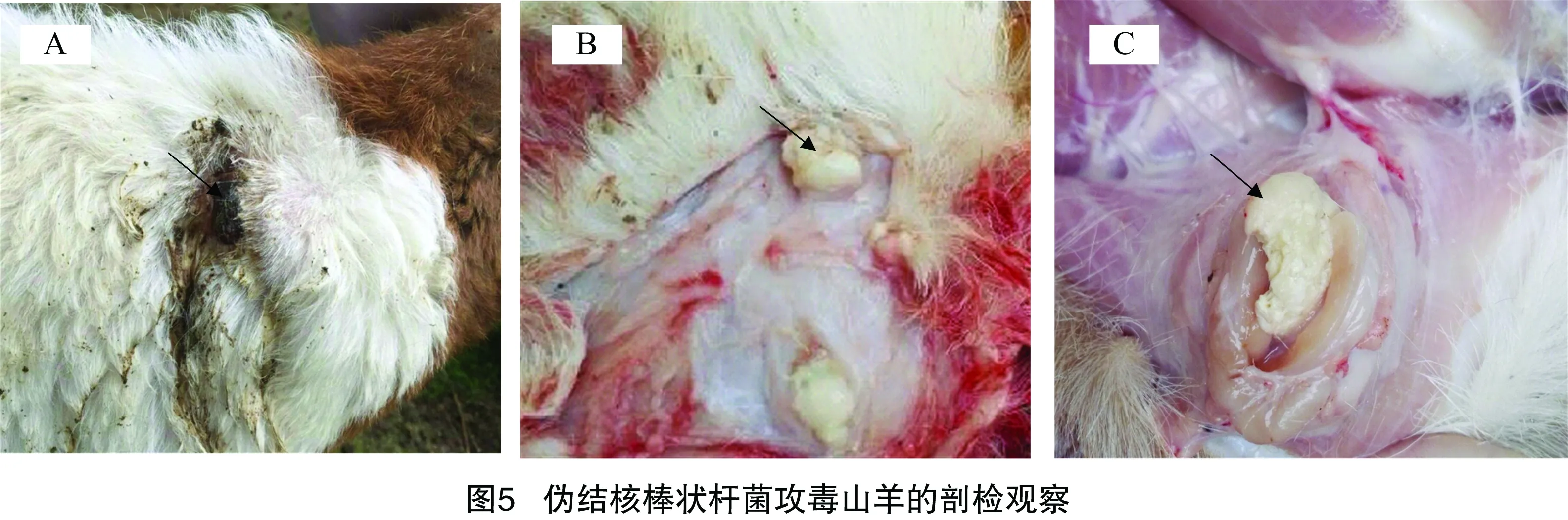
指压有波动感,6 d接种部位相关淋巴结开始出现肿大,随着病情发展,肿胀日益明显,皮肤表面、皮下肌肉层和周边淋巴结的肿块切开后出现干酪样脓汁,呈黄白色黏稠液体(图5),并从脓汁中分离到与攻毒菌相同的菌株。
2×106CFU/mL攻毒组山羊在感染3 d起接种部位出现肿胀,并出现持续2 d体温升高,随后肿胀逐渐变大,将肿块切开后有干酪样脓汁排出,但形成的肿块小于2×108CFU/mL 攻毒组山羊。
2×104、2×103CFU/mL攻毒组山羊感染后接种部位触摸无肿胀,无体温升高。2×104CFU/mL攻毒组山羊剖检观察到淋巴结轻度肿大,切开后无脓汁排出。2×103CFU/mL 攻毒组山羊在整个试验过程中接种部位皮肤表面、皮下肌肉层和周边淋巴结均无脓肿形成。
2.7 组织病理学观察
2.7.1 小鼠组织病理学观察结果 发病小鼠皮肤表皮未见明显病理变化,真皮及皮下组织可见坏死灶,并有大量炎性细胞浸润(图6-A);皮下出现坏死,上皮样细胞及成纤维细胞增生(图6-B);皮下组织部可见肉芽组织形成(图6-C);肌纤维断裂、坏死,并有大量炎性细胞浸润(图6-D)。
2.7.2 山羊组织病理学观察结果 发病山羊表皮观察到出血和坏死(图7-A);表皮及真皮组织出现坏死,并有大量中性粒细胞浸润(图7-B);坏死灶周围可见肉芽组织形成(图7-C);皮肤化脓灶内大量脓细胞(图7-D)。肌肉层可见大的坏死灶,肌纤维断裂坏死,残留肌纤维之间有大量淋巴细胞浸润,成纤维细胞增生(图7-E);肌肉组织下化脓灶中心部分有大量崩解坏死的组织及中性粒细胞碎片(图7-F);肌肉肌纤维出现断裂坏死,残留肌纤维之间大量淋巴细胞浸润,成纤维细胞增生(图7-G)。淋巴结内有大小不等的化脓灶(图7-H);化脓灶周围有大量上皮样细胞增生(图7-I);化脓灶周围成纤维细胞增生(图7-J)。

3 讨论
伪结核棒状杆菌属棒状杆菌属(Corynebacterium),为兼性细胞内寄生菌,该细菌能够产生坏死性、溶血性外毒素,其主要成分为磷脂酶[6]。病原菌侵入机体后,经过血液循环到达淋巴间隙或其他器官进行繁殖,形成特征性的局部化脓性坏死灶。该病主要通过消化道或创口感染, 肺脏亦可形成脓肿并经鼻腔排出病原菌,随后经过皮肤伤口、口腔、呼吸道和生殖道侵入机体形成感染。澳大利亚、美国、日本和土耳其等国家均有伪结核感染的报道[7-10];我国的内蒙古、陕西、甘肃、 新疆、云南、贵州、上海、浙江和广东等地的羊群均有该病的发生[6,11-14]。本研究从安徽省马鞍山市某养羊场发病羊的脓汁中分离到1株致病菌,经形态学特征观察、生化分析和PCR检测确定其为伪结核棒状杆菌。

随着我国养羊业迅速发展,羊群交易和调运频繁,该病的发生呈上升趋势,但是尚无特效疫苗可预防。目前,治疗该病的方法主要有药物治疗和手术治疗,临床上常根据诊断结果,将发病羊的脓肿切开,排出脓汁,用H2O2清洗创口,撒上广谱抗生素,同时进行肌肉注射用药[15]。伪结核棒状杆菌易产生耐药性,治疗前进行药敏试验,参考其结果用药,可获得良好的治疗效果。同时,治疗药物交替使用,可降低耐药性的产生。本试验的药敏结果显示,分离细菌对青霉素、头孢曲松、左氧氟沙星和氟苯尼考最敏感,其次是新霉素、庆大霉素、氨苄西林、恩诺沙星、头孢噻肟和红霉素,对链霉素、丁胺卡那霉素、环丙沙星、林可霉素和大观霉素产生了耐药性。因此,临床上应根据具体情况用药,降低成本,提高治疗效果。
本研究将伪结核棒状杆菌进行人工感染试验发现,腹腔注射的小鼠5 h出现不同程度发病症状,10 h开始死亡;皮下注射的小鼠接种部位出现大小不等的脓肿,感染小鼠的肾脏和肝脏均出现化脓灶。因此,分离菌株对小鼠的致病性较强。本研究还将不同剂量的病原菌皮下注射感染山羊,2×108CFU/mL 和2×106CFU/mL剂量组山羊攻毒后,观察到体温升高,注射部位出现肿大化脓,细菌通过淋巴管移行至相关淋巴结定殖,随后肩前淋巴结开始肿大,切开肿胀的皮肤和淋巴结,均有干酪样脓汁排出;2×104、2×103CFU/mL剂量组山羊攻毒后,无明显的临床症状,2×104CFU/mL剂量攻毒羊仅出现肩前淋巴结肿大,因此本研究攻毒用的伪结核棒状杆菌感染山羊的最小发病剂量为2×106CFU/mL。潘淑惠等报道,细菌感染到达深部肌肉组织时,病原菌可通过淋巴管移行至淋巴结外,通过血管直至体内组织器官,在肺脏、肝脏和脾脏形成局灶性脓肿[16],然而本试验的攻毒羊各内脏均无脓肿形成。组织病理学检查观察到皮肤局部出现坏死灶,并有大量炎性细胞浸润和肉芽组织形成;肌肉肌纤维断裂坏死,大量炎性细胞浸润和成纤维细胞增生;淋巴结内出现化脓灶,并在化脓灶周围观察到大量上皮样细胞和成纤维细胞增生。该结果与潘淑惠等和兰宇等研究得出的伪结核棒状杆菌感染家兔和山羊的结论[16-17]一致,有助于正确理解该病原菌的发病机理和发病过程。
在养羊生产中,特别是放牧羊伪结核棒状杆菌发病率较高,但由于其致死亡率较低,常被养殖户忽视。然而,该病却是世界公认的难以防治的传染病之一,目前国内没有疫苗进行防控,因此养羊场应采取综合性的预防措施,隔离饲养发病羊,及时手术切除排出的脓汁并抗菌治疗,同时搞好环境消毒,加强饲养管理,提高羊群的免疫力。由于该病原菌为人兽共患细菌,在处理病羊和清理污物时应加强个人防护[18]。
[1]杨雪红,郭雪洁,马宁君,等. 羊干酪性淋巴结炎研究进展[J]. 上海畜牧兽医通讯,2008(1):2-3.
[2]Dorella F A,Pacheco L G,Oliveira S C,et al.Corynebacteriumpseudotuberculosis:microbiology,biochemical properties,pathogenesis and molecular studies of virulence[J]. Veterinary Research,2006,37(2):201-218.
[3]Baird G J,Fontaine M C.Corynebacteriumpseudotuberculosisand its role in ovine caseous lymphadenitis[J]. Journal of Comparative Pathology,2007,137(4):179-210.
[4]中华人民共和国农业部.中华人民共和国农业部公告第1125号 一、二、三类动物疫病病种名录[EB/OL]. (2008-12-23)[2015-11-30]. http://www.moa.gov.cn/zwllm/tzgg/gg/200812/t20081223_1194404.htm.2008-12-23.
[5]Çetinkaya B,Karahan M,Atil E,et al. Identification ofCorynebacteriumpseudotuberculosisisolates from sheep and goats by PCR[J]. Veterinary Microbiology,2002,88(1):75-83.
[6]赵宏坤,范伟兴,胡敬东,等. 羊伪结核研究进展[J]. 中国预防兽医学报,2000,22(3):236-237.
[7]Baird G J,Fontaine M C.Corynebacteriumpseudotuberculosisand its role in ovine caseous lymphadenitis[J]. Journal of Comparative Pathology,2007,137(4):179-210.
[8]Dercksen D P,Brinkhof J M,Dekker-Nooren T,et al. A comparison of four serological tests for the diagnosis of caseous lymphadenitis in sheep and goats[J]. Veterinary Microbiology,2000,75(2):167-175.
[9]Paton M W,Rose I R,Hart R A,et al. New infection withCorynebacteriumpseudotuberculosisreduces wool production[J]. Australian Veterinary Journal,1994,71(2):47-49.
[10]Ilhan Z. Detection ofCorynebacteriumpseudotuberculosisfrom sheep lymph nodes by PCR[J]. Revue De Medecine Veterinaire,2013,164(2):60-66.
[11]赵宏坤,王春芬. 内蒙古东部地区羊伪结核病调查[J]. 中国畜禽传染病,1995(4):13-14.
[12]邢福珊,云世雄,李景河. 波尔山羊干酪性淋巴结炎的病原鉴定及防治[J]. 上海畜牧兽医通讯,2004(5):48-48.
[13]王韦华,张彦明,邢福珊,等. 羊伪结核棒状杆菌的分离鉴定及 ELISA 检测方法建立[J]. 中国兽医学报,2005,25(1):34-36.
[14]李福刚,袁玉国,聂春应,等. 奶山羊假结核棒状杆菌病的诊治[J]. 江西畜牧兽医杂志,2002(5):23-24.
[15]马玉忠. 羊病诊治原色图谱[M]. 北京:化学工业出版社,2014:71-72.
[16]潘淑惠,王 璇,万晴姣,等. 山羊伪结核棒状杆菌感染途径及病理变化观察[J]. 上海畜牧兽医通讯,2007(5):24-25.
[17]兰 宇,李一经,唐丽杰,等. 伪结核棒状杆菌试验感染家兔的临床与病理学变化[J]. 中国兽医科学,2013,43(3):299-303.
[18]曾 泽,韦雷飞,黄秀君,等. 一起山羊伪结核棒状杆菌感染的诊断[J]. 动物医学进展,2014,35(3):131-133.
