水稻雄性不育突变体cnj7的遗传分析和基因定位
2018-03-26杨志刚孙海燕李晶晶
杨志刚, 孙海燕, 罗 兵, 李晶晶, 周 莉
(常熟理工学院生物工程系,江苏常熟 215500)
水稻雄性不育是在其有性繁殖过程中不能产生正常雄配子的现象,广泛存在于开花植物中[1]。水稻雄性不育分为2种,一种是细胞质雄性不育;另一种是细胞核雄性不育,由核基因突变产生,它的不育性是受细胞核控制,在植物中是比较普遍的,多为隐性细胞核不育。细胞核不育性彻底、稳定,有利于缩短育种周期与提高产量[2-4]。目前已经发现一些细胞核上的基因,控制雄性器官发育从而使雄性不育,如TDR、OsAPI5、Udt1、OsMYB80和PTC1等控制绒毡层发育[5];OsMSP1控制孢子母细胞的数量;PCK、SDS、OsRAD21-3、PAIR2控制同源染色体配对;DPW、CYP704B2、Wda1、OsCP1、AID1等控制花药小孢子的发育[6],若是这些基因缺失或突变,不能产生花粉,从而导致雄性不育。更多雄性不育基因的发现将有助于更深入了解雄配子体发育机制。
本研究对粳稻品种93-63和引04-2杂交后代常农粳7号中一个自然突变的雄性不育材料cnj7进行了初步的表型观察、遗传性状分析和分子标记定位,为该基因的精细定位、克隆及其功能研究与利用奠定基础。
1 材料与方法
1.1 试验材料
水稻雄性不育突变体材料cnj7来源于一个93-63/引 04-2 杂交组合后代的自然突变体。其他野生型水稻材料明恢86 和R1128由常熟市农业科学研究所提供。
1.2 突变体形态观察及花粉育性鉴定
取突变体颖花做解剖镜和半薄切片形态观察;取花药捣碎用1% I2-KI染色观察,根据花粉粒形态和染色状况分析花粉育性及败育类型[7]。
1.3 突变性状的遗传
群体构建[8]:2014年在常熟以cnj7突变体为母本,分别与明恢86和R1128杂交,在海南三亚种植F1并套袋自交,2015年在常熟种植F2。同时利用其与明恢86和R1128杂交衍生的F1作为父本与突变体测交,在常熟种植回交一代的植株,成熟时以群体为单位分析单株突变性状分离的情况,进行遗传分析。
1.4 基因定位
1.4.1 作图群体 以组合cnj7/明恢86的F2群体作为该基因的定位群体,其中含有突变型单株112株,收集不育株,提取DNA。
1.4.2 水稻DNA的提取[9]将少许新鲜水稻叶片在液氮环境下磨碎倒入1.5 mL EP管中,加入650 μL CTAB,EP管放入65 ℃恒温水浴30 min,加入650 μL氯仿,剧烈振荡 30 min,12 000 r/min离心10 min,取上清液,加入2倍体积无水乙醇,-20 ℃静置1~2 h,再12 000 r/min离心10 min,弃上清,加入500 μL 70%乙醇,洗去CTAB,干燥后加200 μL ddH2O溶解DNA,-20 ℃冰箱保存备用。
1.4.3 SSR分析 微卫星引物分析[10-14]:以均匀分布于水稻染色体上的216对微卫星引物[序列由康乃尔大学公布,由生工生物工程(上海)股份有限公司合成]筛选亲本,差异标记分别在由cnj7、明恢86、3株可育株、3株不育株构成的小群体中进行连锁分析。对小群体得到的连锁标记进一步在所有的不育单株中进行连锁验证和分析。
PCR扩增:反应体系总体积20 μL,包括10.8 μL ddH2O、2 μL buffer、2 μL dNTP、2 pmol SSR、前后引物各1 μL、1 μL DNA模板、0.2 μLTaqDNA聚合酶、2 μL 50%甘油;扩增程序为:95 ℃预变性5 min;95 ℃变性20 s,52 ℃退火20 s,72 ℃ 延伸20 s,40个循环;72 ℃ 延伸5 min;12 ℃保存。
电泳:PCR扩增产物加入10 μL Loading Buffer,沸水浴 10 min 后冰浴10 min,垂直板聚丙烯酰胺凝胶电泳,1×TBE缓冲液,电压220 V电泳2~3 h。
染色:染色液1 g/L的AgNO3,显色液NaOH、Na2CO3、甲醛混合液。可见光下记录电泳分离结果。
1.5.4 遗传作图 在凝胶电泳分离结果中将具有明恢86带型的单株标记为“1”,具有cnj7突变体带型的单株标记为“2”,具有二者杂合带型的单株记为“3”,利用Mapmaker 3.0软件对分离群体的不育性状和分子标记的分离数据进行连锁分析,并进行遗传图距(cM)的计算。
2 结果与分析
2.1 突变体形态及花粉育性
由图1可知,突变体植株整体及抽穗情况与正常植株无明显差异性(图A、图B)。突变体最显著的特点是不育,套袋自交的结实率接近于0%,自然环境下,异花授粉结实率低于8%。突变体小花解剖观察发现,雌蕊形态数目与正常材料并无不同,雄蕊数目也正常;正常植株雄蕊颜色是淡黄色,且长势饱满(图C、图E);突变体雄蕊颜色偏白,接近透明,形体萎缩(图D、图F)。将花药捣碎碘染,显微镜下观察,正常植株有染色很深的花粉粒,而突变体染色花粉粒稀少接近于无(图G、图H),花药内没有成熟花粉,该突变体是雄性不育株。

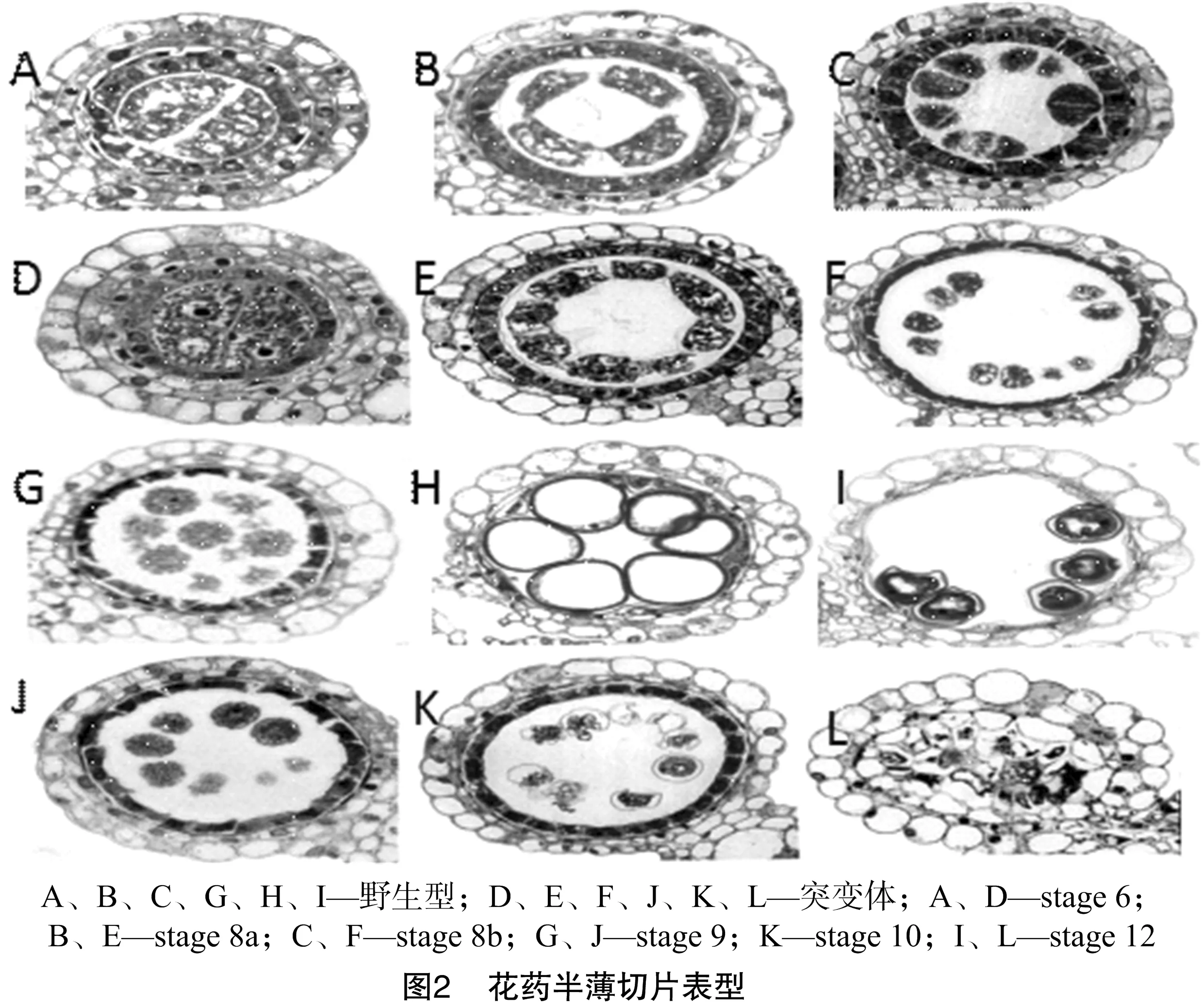
2.2 突变体半薄形态观察
由图2可知,野生型和突变体在小孢子母细胞阶段没有明显变化,小孢子母细胞呈多面体形,胞质浓厚,药壁4层细胞分化和花粉母细胞发育完成;野生型花粉母细胞进行减数分裂;形成胼胝质包裹的二分体、四分体,绒毡层细胞空泡化,胼胝质壁降解,小孢子从四分体释放;小孢子体积增大,内部空泡增多,小孢子外壁逐渐增厚,经2次有丝分裂,形成三孢花粉。而突变体从二分体时期即表现异常,小孢子个数增多,之后内容物发生渗漏并最终导致小孢子降解,不能形成花粉。
2.3 突变性状的遗传
表1以突变体cnj7作为母本,分别与R1128、明恢86杂交衍生F2群体,同时利用cnj7×R1128、cnj7×明恢86的F1与突变体cnj7回交衍生BC1F1代植株,调查突变体形状在各种背景下的分离,所有种群F1植株的育性均表现正常,但F2和BC1F1的育性出现分离,这表明育性性状受核基因控制,不育性状为隐性性状。在所有杂交组合衍生的F2群体中,关于育性性状的分离均符合3 ∶1 的分离规律,而在杂交组合的F1植株育性性状分离则符合1 ∶1的分离规律,表明该不育性状为单个基因控制的隐性突变[18]。
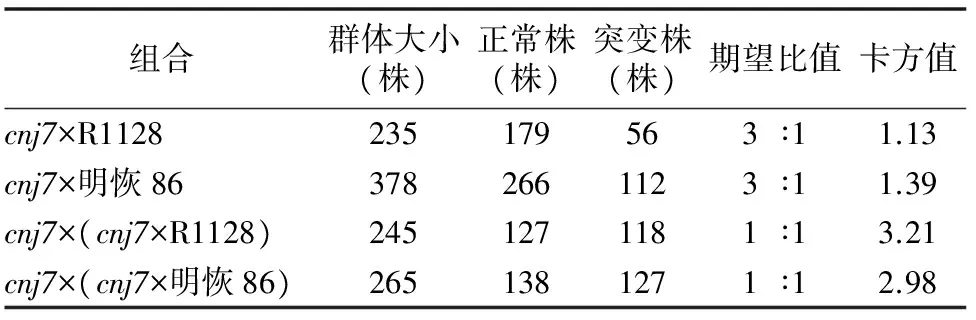
表1 突变性状在群体中的分离
2.4 cnj7(t)基因的初步定位
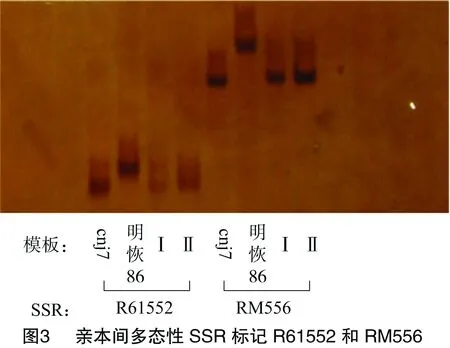
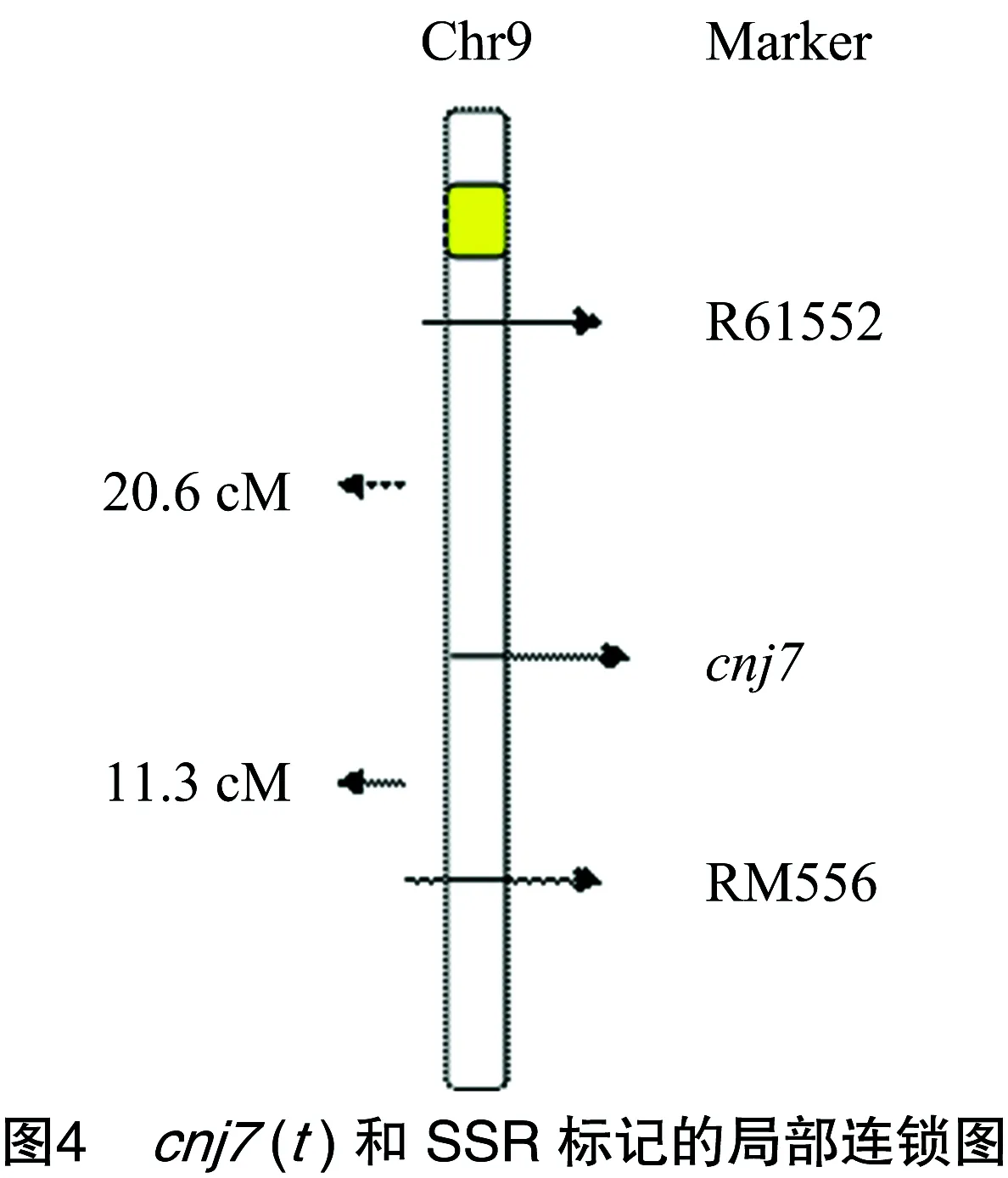
以常农粳7号、明恢86和杂交F1代构成小群体,利用水稻12号染色体上均匀分布的微卫星标记,实验室合成216对标记引物在亲本cnj7雄性不育突变体和明恢86间筛选具有多态性差异的标记[13]。将筛选出的58个多态性SSR标记引物分别对所有F2代不育性状的样本进行分析,结果发现第9号染色体上微卫星标记的R61552、RM556与突变体基因表现明显的连锁现象(图3)。根据各标记在基因组上的位置,该突变基因被初步定位在第9号染色体的微卫星标记 R61552~RM556之间,遗传距离分别为20.6、11.3 cM(图4)。
3 讨论
水稻的雄性不育有2种,一种是细胞核不育,可稳定遗传;另一种是细胞质不育,可以在某种条件下恢复育性。根据不育性状的表达规律将细胞核不育分为隐性细胞核不育和显性细胞核不育。根据文献记载,发现了大约120种不育基因,细胞质雄性不育的基因有20多个;其余的属于细胞核不育基因,目前已有7个不育基因在第9号染色体明确并克隆,它们分别是OsDDM1a、OsCesA9、PAIR2、PTC1、OsGEN-L、OsUgp1和Ugp1,并且它们都属于细胞核雄性不育;其中,OsDD1a影响水稻基因组的DNA甲基化水平;OsCesA9是纤维素合酶催化亚基,它可能形成一个纤维素合成复合体从而参与次生细胞壁的合成;PAIR2在能够控制水稻细胞减数分裂时同源染色体的配对;PTC1是一个控制绒毡层发育、影响花粉粒形成的关键基因;OsGEN-L在水稻小孢子的发育初期有重要作用;OsUgp1和Ugp1催化葡萄糖的一系列反应[9-12]。
隐性核不育这一类植株有利于改良水稻群种。通过杂交、测交、回交等手段将有利基因集中到一起,表达出更好的性状,利用优势改良创造出更为优质的杂交水稻品种[18]。该研究利用不育突变体cnj7与明恢86杂交衍生分离群体,成功地将cnj7(t)定位在第9号染色体上SSR标记RM556~R61552之间,遗憾的是,可能是由于亲本遗传性状差别并不是很大[9-12],另外可能是由于标记引物的缺陷,并未能更加精确地确定雄性核不育突变基因的位置,所以进一步精确定位基因,重要的前提条件是亲本间遗传差异要足够大、F1植株育性正常的分离群体。目前,我们正在研究配置亲缘关系较远、遗传差异较大的一些杂交组合,期望能够实现对该基因的精细定位。
[1]娄雪源. 百日草雄性不育两用系的遗传及杂交育种研究[D]. 武汉:华中农业大学,2010.
[2]严雯奕. 水稻衰老和雄性不育突变体生理性状及基因定位[D]. 上海:上海师范大学,2010.
[3]杨学乐,陶芬芳. 作物生态雄性不育遗传和基因定位的研究进展[J]. 作物研究,2015,29(5):544-549.
[4]刘庆昌. 遗传学[M]. 3版.北京:科学出版社,2015.
[5]Zhu Q H,Ramm K,Shivakkumar R,et al. TheANTHERINDEHISCENCE1 gene encoding a single MYB domain protein is involved in anther development in rice[J]. Plant Physiology,2004,135(3):1514-1525.
[6]Inukai Y,Kaneko M,Ueguchi-Tanaka M,et al. Loss-of-function mutations of the riceGAMYBgene impair theα-amylase expression in aleurone and flower development[J]. Plant Cell,2004,16(1):33-44.
[7]李园园. 水稻雄性不育突变体的细胞学研究及遗传分析[D]. 雅安:四川农业大学,2008.
[8]初明光,李双成,王世全,等. 一个水稻雄性不育突变体的遗传分析和基因定位[J]. 作物学报,2009,35(6):1151-1155.
[9]卓 敏. 水稻包穗突变体esp1的遗传分析与ESP1(t)基因定位[D]. 福州:福建农林大学,2010.
[10]罗远章. 水稻新型卷叶突变体rll2(t)的遗传分析和基因定位[D]. 重庆:西南大学,2010.
[11]焦航宇. 水稻RH1基因的遗传分析与基因定位[D]. 福州:福建农林大学,2010.
[12]马慧坤. 水稻雄性核不育突变体的表型观察及基因初步定位[D]. 福州:福建农林大学,2014.
[13]成钦淑,叶邦全,袁 灿,等. 水稻白条纹叶突变体stl1的遗传分析与基因定位[J]. 中国水稻学,2015,29(1):14-21.
[14]张文辉,严 维,陈竹锋,等. 水稻雄性不育突变体oss125的遗传分析及基因定位[J]. 中国农业科学,2015,48(4):621-629.
