不同浓度葡萄糖对大鼠骨髓来源内皮祖细胞增殖、迁移及血管形成的影响
2018-03-26李中轩陈韵岱
李中轩,陈韵岱
糖尿病是一种复杂的代谢综合征,特点是血糖升高伴随胰岛功能降低。糖尿病高血糖会导致血管相关并发症,包括视网膜病变、脑血管病变、心血管病变[1]。其中心血管病变最为严重,糖尿病产生多种有害代谢产物,如晚期糖化终末产物(AGEs)[2],会损伤完整的血管内皮,并诱发炎症级联反应,经过一系列病理生理过程最终导致动脉粥样硬化斑块形成。若不稳定斑块发生破裂出血,将导致心肌梗死和心源性死亡。与正常人群相比,糖尿病患者伴随胰岛功能受损,加速胆固醇在巨噬细胞中聚集,形成泡沫细胞[3],加速冠心病进展。同时糖尿病患者损伤的内皮会释放多种炎症因子,加重氧化应激以及炎症反应,并导致严重心血管事件发生[4]。
修复损伤血管内皮成为治疗糖尿病相关心血管病变的重要靶点。内皮祖细胞(EPCs)为内皮细胞的前体细胞,在修复损伤、维持管腔完整性等方面具有重要作用。研究发现EPCs不仅参与血管形成,同时也参与出生后血管生成和内皮损伤后的修复[5,6]。高糖环境会损伤EPCs,导致其功能障碍。本研究探究了不同浓度葡萄糖对EPCs增殖、迁移及血管形成能力的影响,为后续在高糖环境下研究EPCs病理生理机制提供合适的模型。
1 材料与方法
1.1 实验动物与主要试剂 SPF级SD大鼠购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001。EGM-2培养基(Lonza),histopaque-1083(Sigma-Aldrich),Fibronectin(R&D),胎牛血清(Gibco),DilacLDL(Thermo Fisher Scientific),FITC-UEA-I(Sigma-Aldrich),结晶紫(Beyotime),基质胶(Corning),Cell counting kit-8(Dojindo Molecular Technologies),24-well Transwell chamber(Corning),酶标仪(BioTek),荧光倒置显微镜(Nikon),激光共聚焦扫描显微镜(Leica Microsystems)。
1.2 EPCs的分离与培养 将大鼠用戊巴比妥钠麻醉后,颈椎脱臼法处死。然后将处死大鼠放入预先准备好的75%酒精中消毒30 min。分离出大鼠后肢长骨,将表面神经、肌肉、筋膜尽量去除,暴露出两侧干骺端。用吸取EGM-2培养基的注射器至干骺端刺入后反复冲洗,直至骨髓腔内容物被完全吹出,长骨变白。反复吹打分离得到的骨髓腔内容物至分散均匀,将骨髓冲洗液用0.22 μm滤器过滤,得到骨髓单细胞悬液。1:1比例将淋巴细胞分离液与单细胞悬液依次加入离心管中,室温1400 rpm离心30 min。吸出骨髓单个核细胞层与EGM-2培养基重悬,室温1000 rpm离心10 min洗涤2遍。然后将骨髓单个核细胞接种于纤维蛋白包被的培养皿上培养12 h。首次更换培养基轻摇培养皿,将未贴壁细胞重新接种于另一纤维蛋白包被的培养皿上,换液步骤同原培养皿。以后每24 h更换一次培养基,在此过程中将非EPCs集落刮除,待细胞融合至80%时进行传代。1.3 EPCs吞噬功能鉴定 通过吞噬结合实验鉴定EPCs吞噬Dil-acLDL与FITC-UEA-I结合的特性。将生长状态良好的EPCs用0.25%胰蛋白酶消化,吹散细胞使之变为单细胞悬液。胎牛血清中和胰蛋白酶后,用EGM-2培养基调整细胞密度。24孔板每孔1×104个细胞制作爬片。细胞长至80%进行染色。稀释Dil-acLDL浓度至10 μg/ml,FITCUEA-I至20 μg/ml,同时加入孔板中,于细胞培养箱避光孵育4 h。预冷PBS浸洗10 min。用4%多聚甲醛4℃固定1 h。再用PBS浸洗3遍,每次10 min。封片后在激光共聚焦显微镜下任选5个视野,观察并计算荧光双染细胞数量。
1.4 EPCs增殖能力检测及绘制生长曲线 CCK-8试剂盒检测EPCs在不同浓度葡萄糖中的增殖能力。将EPCs分为5组,EGM-2培养基含有5 mM葡萄糖,将5 mM组设为对照组,添加葡萄糖使10 mM组、15 mM组、20 mM组、25 mM组达到相应的浓度,每组设置3个复孔,共观察72 h。每12 h检测一次,将原培养基去除后,1:10的比例加入CCK-8与新培养基,避光孵育2 h,酶标仪检测450 nm处吸光度值。
1.5 EPCs迁移能力检测 通过Transwell实验检测EPCs在不同浓度葡萄糖条件下的迁移能力。Transwell小室中加入培养基平衡1 h,每孔1×104个细胞用无FBS的EGM-2培养基重悬后加入上室,下室加入含有10% FBS及不同浓度葡萄糖的EGM-2培养基。将小室放入细胞培养箱培养24 h后,未迁移至下室的细胞用棉签轻轻擦去。下室细胞用4%多聚甲醛固定1 h,PBS洗涤3遍。最后用结晶紫染色,倒置显微镜下任选5个视野观察并计数。
1.6 EPCs体外血管形成能力检测 于使用前一晚将基质胶放入冰箱中使之融化。96孔板每孔加入100 μl基质胶,放入细胞培养箱使之凝固,然后每孔加入1×104个细胞,放入培养箱培养24 h后,于倒置显微镜下观察并计算新生管壁的长度。
1.7 统计学分析 使用SPSS 17.0统计软件处理所有的数据,计量资料采用均数±标准差(±s)表示,两组间均数比较采用t检验,多组间均数比较采用方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠EPCs形态学观察 大鼠骨髓来源原代EPCs培养12 h后,第一次换液,贴壁细胞呈类圆形,细胞体积小(图1A)。细胞培养7 d后,倒置显微镜下观察,细胞两端逐渐伸出伪足,细胞体积增大,呈纺锤形集落分布(图1B)。继续培养至14 d,细胞紧密排列,呈典型的铺路石样分布(图1C),细胞融合成片,为三角或多边形(图1D)。培养过程中不断清除非EPCs集落。2.2 大鼠EPCs鉴定 于激光共聚焦显微镜下观察,吞噬Dil-acLDL后EPCs呈现红色(图2A),特异性结合FITC-UEA-I后EPCs呈绿色(图2B)。将图片融合后显示黄色的为EPCs(图2C),阳性率为(93.10±0.85)%。阴性对照细胞未能观察到荧光。
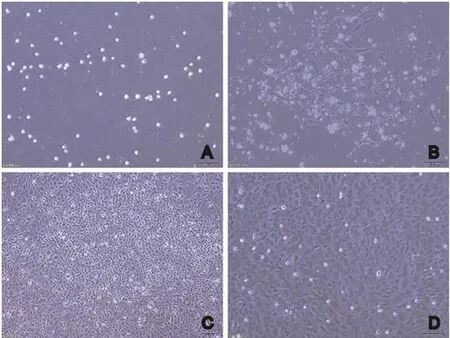
图1 大鼠原代EPCs形态学观察
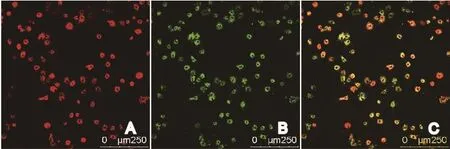
图2 大鼠EPCs鉴定
2.3 不同浓度葡萄糖对EPCs增殖能力的影响 各组细胞葡萄糖干预后,每12 h测量一次吸光度值并绘制生长曲线。结果显示,同一时间点随着葡萄糖浓度升高,吸光度值降低,增殖下降,培养72 h后,在25 mM达到最大抑制程度。同一浓度,12 h开始进入对数生长期,48 h进入平台期(图3)。
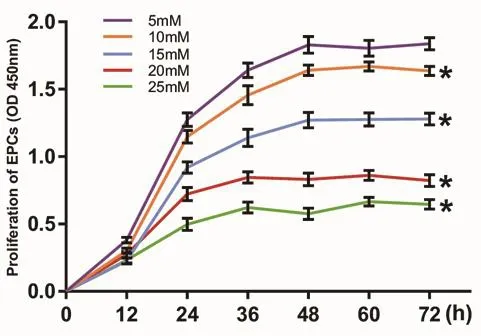
图3 不同浓度葡萄糖对EPCs增殖的影响
2.4 不同浓度葡萄糖对EPCs迁移能力的影响 随着葡萄糖浓度的升高,迁移至下室EPCs比例逐渐减少(5 mM:1.00±0.05;10 mM:0.68±0.06;15 mM:0.56±0.03;20 mM:0.40±0.04;25 mM:0.23±0.03)(图4A~E),与5 mM组对比,25 mM组迁移比例最低[(0.23±0.03) vs .(1.00±0.05)],差异有统计学意义(P<0.01)(图4F)。说明高糖抑制EPCs的迁移能力,且25 mM浓度时抑制最明显。
2.5 不同浓度葡萄糖对EPCs体外血管形成能力的影响 随着葡萄糖浓度升高,体外血管形成能力逐渐降低,5 mM所形成管腔完整,至25 mM浓度时已基本不能形成完整管腔(5 mM:1.00±0.04;10 mM:0.81±0.04;15 mM:0.70±0.04;20 mM:0.63±0.03;25 mM:0.56±0.03)(图5A~E)。与5 mM组对比,25 mM组血管形成抑制作用最明显[(0.56±0.03) vs. (1.00±0.04)],差异有统计学意义(P<0.01),说明高糖抑制EPCs体外血管形成能力,且在25 mM时最明显(图5F)。
3 讨论
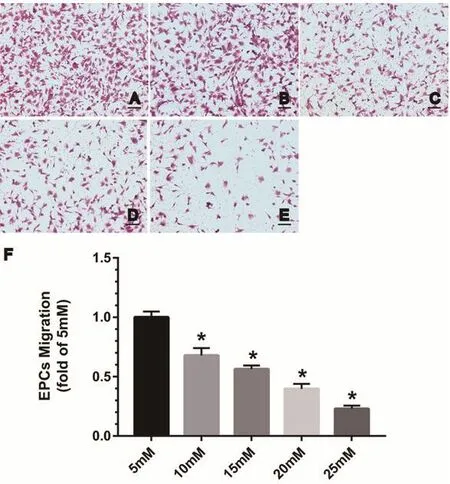
图4 EPCs在不同浓度葡萄糖中的迁移能力
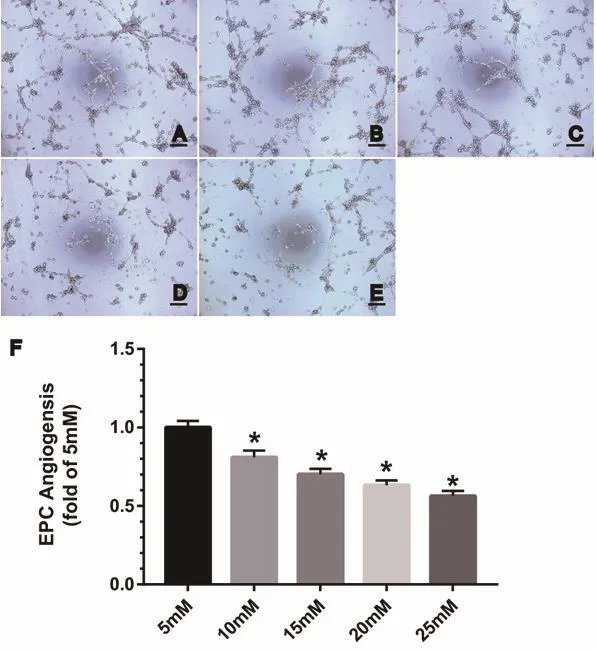
图5 EPCs在不同浓度葡萄糖条件下的体外血管形成能力
糖尿病不仅增加心血管并发症、心血管疾病早期死亡以及致残率,还加重社会经济负担[7]。研究发现糖尿病是动脉粥样硬化、慢性肾脏衰竭、心力衰竭的病因[8-10]。本研究首先对EPCs形态学进行观察以及鉴定,然后观察不同浓度葡萄糖对EPCs的影响。为后续EPCs在高糖环境下的病理生理机制探究提供合适浓度。
骨髓和外周血来源的EPCs在内皮修复、血管生成、血管新生和改善血管功能中起关键作用。EPCs是内源性修复系统的一个重要组成部分[11],对心血管系统有重要保护作用[12],EPCs在特定刺激下被动员或释放到血液循环中,通过旁分泌调控,参与血管形成和内皮修复[13,14]。
EPCs参与维持心血管稳态,其衰竭或功能障碍可能加速糖尿病相关心血管并发症的发生。EPCs参与维持心血管损伤和修复间的平衡,对于维持心脏重塑、心功能、内膜完整性、内皮功能和预防心血管并发症至关重要[15]。高糖环境的EPCs病理生理研究是目前研究热点。EPCs的迁移和血管新生能力在修复损伤方面十分重要[16]。
因此,本研究探究不同浓度葡萄糖对EPCs增殖、迁移及体外血管形成能力的影响,结果发现,随着葡萄糖浓度的升高,无论是EPCs迁移能力,还是体外血管形成能力均被抑制,25mM时抑制达到最高程度,为后续建立高糖模型提供了理论与技术支持。
[1] Tousoulis D,Kampoli AM,Stefanadis C. Diabetes mellitus and vascular endothelial dysfunction: current perspectives[J]. Current Vascular Pharmacology,2012,10(1):19-32.
[2] Kränkel N,Adams V,Linke A,et al. Hyperglycemia Reduces Survival and Impairs Function of Circulating Blood-Derived Progenitor Cells[J]. Arteriosclerosis Thrombosis & Vascular Biology,2005,25(4):698-703.
[3] Alsheikh-Ali AA,Kitsios GD,Balk EM,et al. The vulnerable atherosclerotic plaque: scope of the literature[J]. Annals of Internal Medicine,2010,153(6):387.
[4] Bentzon JF,Otsuka F,Virmani R,et al. Mechanisms of plaque formation and rupture.[J]. Circulation Research,2014,114(12):1852.
[5] Balaji S,King A,Crombleholme TM,et al. The Role of Endothelial Progenitor Cells in Postnatal Vasculogenesis: Implications for Therapeutic Neovascularization and Wound Healing[J]. Advances in Wound Care,2013,2(6):283.
[6] Urbich C,Dimmeler S. Endothelial progenitor cells: characterization and role in vascular biology[J]. Circulation Research,2004,95(4):343-53.
[7] Stöckl D,Rückert-Eheberg IM,Heier M,et al. Regional Variability of Lifestyle Factors and Hypertension with Prediabetes and Newly Diagnosed Type 2 Diabetes Mellitus: The Population-Based KORA-F4 and SHIP-TREND Studies in Germany[J]. Plos One,2016, 11(6):e0156736.
[8] Busch M,Nadal J,Schmid M,et al. Glycaemic control and antidiabetic therapy in patients with diabetes mellitus and chronic kidney disease- cross-sectional data from the German Chronic Kidney Disease(GCKD) cohort[J]. BMC Nephrology,2016,17(1):59.
[9] Kamceva G,Vavlukis M,Kitanoski D,et al. Newly Diagnosed Diabetes and Stress Glycaemia and Its’ Association with Acute Coronary Syndrome[J]. Open Access Macedonian Journal of Medical Sciences,2015,3(4):607-12.
[10] Abdullatef WK,Al-Aqeedi RF,Dabdoob W,et al. Prevalence of Unrecognized Diabetes Mellitus in Patients Admitted With Acute Coronary Syndrome[J]. Angiology,2013,64(1):26.
[11] Fadini GP,De KSA,Baesso I,et al. Circulating CD34+ cells, metabolic syndrome, and cardiovascular risk[J]. Eur Heart J,2006,27(18):2247.
[12] Friedrich EB,Walenta K,Scharlau J,et al. CD34+/CD133+/VEGFR-2+Endothelial Progenitor Cell Subpopulation With Potent Vasoregenerative Capacities[J]. Circulation Research,2006,98(3):e20.
[13] Berezin AE,Kremzer AA,Berezina TA,et al. Data regarding association between serum osteoprotegerin level, numerous of circulating endothelial-derived and mononuclear-derived progenitor cells in patients with metabolic syndrome[J]. Data In Brief,2016,8:717-22.
[14] Berezin AE,Kremzer AA. Circulating endothelial progenitor cells as markers for severity of ischemic chronic heart failure[J]. Journal of Cardiac Failure,2014,20(6):438-47.
[15] Tesfamariam B. Endothelial Repair and Regeneration Following Intimal Injury[J]. Journal of Cardiovascular Translational Research,2016,9(2):91-101.
[16] Dai X,Zeng J,Yan X,et al. Sitagliptin-mediated preservation of endothelial progenitor cell function via augmenting autophagy enhances ischaemic angiogenesis in diabetes[J]. Journal of Cellular &Molecular Medicine,2017,22(1):89-100.
