紫杉醇水蛭素支架涂层复合物对LPS诱导的HCASMC炎性活化过程中核转录因子NF-κB p65及其下游炎症因子的调控作用
2018-03-26李红梅王显
李红梅,王显
支架血栓是介入领域所面临的挑战,目前新一代药物涂层支架血栓发生率已降至0.2%[1]。尽管支架血栓的发生率较低,但其后果严重,死亡率较高,是经皮冠状动脉介入治疗(PCI)最主要的死亡原因之一,如何将血栓形成的风险降至最低是国内外支架研发的焦点和前沿领域[2]。
研究证实,冠状动脉平滑肌细胞增殖、迁移引起血管内膜过度增生是导致PCI术后再狭窄的主要原因,涂层药物抑制平滑肌细胞增殖的同时延缓血管内皮化进程是导致迟发性血栓形成的关键因素[3,4]。在此背景下,本团队基于前期研究并结合现代药理研究进展,选用紫杉醇和水蛭素按一定比例组成支架涂层复合物,在小型猪模型研究中效果肯定,且显示出明显的抗炎作用,但具体作用机制未知。NF-κB p65是细胞内重要的核转录因子,通过调控多种基因表达参与炎症、免疫、细胞凋亡、细胞增殖等过程[5-8],在炎症介质表达的调控中,NF-κB p65被激活和核转位是关键一步[9,10]。本研究选用人冠状动脉平滑肌细胞(HCASMC),用脂多糖(LPS)模拟体内细胞炎症状态,紫杉醇水蛭素进行干预,探讨紫杉醇水蛭素复合物对LPS诱导的NF-κB p65细胞信号转导及下游炎症因子的影响,从炎症角度初步探究紫杉醇水蛭素复合药物防治PCI术后再狭窄和迟发性血栓形成的作用机制。
1 材料与方法
1.1 主要试剂 HCASMC(货号:FC-0031)、细胞培养基、胰酶、胰酶抑制剂、冻存液均购自美国Lifeline公司;细胞培养级脂多糖1 mg/ml(货号:L6529),Sigma(L2880);紫杉醇储存液100 μl(KGA8221),南京凯基生物科技发展有限公司;科研级天然水蛭素冻干粉500AT-U/g,武汉胜天宇生物科技有限公司;人IL-6 ELISA试剂盒(货号:SEA079Hu,96T),人IL-1β ELISA试剂盒(货号:SEA563Hu,96T),人肿瘤坏死因子-α(TNF-α)ELISA试剂盒(货号:SEA133Hu,96T),均购自武汉USCN公司;兔NF-κB p65亚基多克隆抗体,Abcam公司;HRP标记的羊抗兔IgG,武汉博士德公司;TRIZOL通用型RNA快速提取试剂盒,Inventrogen公司;反转录试剂盒,美国Bio-Rad公司。
1.2 主要仪器 超净工作台CJT-E-Ⅱ(北京昌平长城空气净化工程公司)、倒置相差显微镜(Olympus CKX×41)、低速离心机LD4-2(北京雷勃尔离心机有限公司)、培养箱(MCO-20AIC,SANYO Elecronic.Ltd.JAPEN)、-80℃低温冰箱(美国REVCO Legaci)、电热恒温水箱(HH.W21.420)、荧光PCR仪、SDS-PAGE凝胶电泳仪、电转仪均为美国Bio-Rad公司产品。
1.3 方法
1.3.1 人冠状动脉平滑肌细胞培养 将保存于液氮中的细胞取出后立刻放到干冰上,然后放入37℃水浴中,待细胞悬液融化后将细胞接种于培养瓶并放入培养箱中(37℃,5%CO2)培养,次日更换培养基。之后2~3 d传代一次。实验使用第4~6代细胞,将生长至融合期的HCASMC以胰蛋白酶消化,细胞悬液接种于6孔细胞培养板,置于5%CO2、37℃培养箱中培养,待细胞融合成单层开始实验。
1.3.2 实验分组及处理 实验分组:设置空白对照组(正常HCASMC,未做任何处理)、LPS模型组(1 μg/ml的LPS干预48 h)、紫杉醇水蛭素高浓度组(1 μmol/L紫杉醇+0.2 mg/ml水蛭素干预4 h后加入1 μg/ml的LPS刺激48 h)、紫杉醇水蛭素低浓度组(1 μmol/L紫杉醇+0.0125 mg/ml水蛭素干预4 h后加入1 μg/ml的LPS刺激48 h)。每组设置3个复孔。
1.3.3 Q-PCR法测定NF-κB p65、TNF-α、白介素-6(IL-6)和白介素-1β(IL-1β)的mRNA表达 用TRIZOL通用型RNA提取试剂盒提取样品RNA,使用反转录试剂盒将RNA反转录为cDNA,按照以下反应体系进行:模板(RNA)1 μg;5×Reaction Mix 4 μl;Reverse Transcriptase 1 μl;DEPC处理水至20 μl,混匀,25℃ 5 min,42℃ 30 min,85℃ 5 min。Q-PCR检测按照以下反应体系进行:模板(cDNA)/ddH2O 7.5 μl;4 μM引物F/R,5 μl;SYBR 12.5 μl,混匀,置于荧光定量PCR仪中。目的基因相对表达量用ΔΔCT法计算,ΔCT(目的基因)=CT(目的基因)-CT(内参基因),ΔΔCT=ΔCT(处理组)-ΔCT(空白组)。目的基因相对表达水平=2-ΔΔCT ,内参β-actin校正(表1)。

表1 各引物序列信息
1.3.4 Western Blotting检测NF-κB p65的表达 提取细胞总蛋白,检测浓度,制备样品,上样,12% SDS-PAGE电泳3 h,然后转至PVDF膜,5%脱脂奶粉封闭1 h,加入NF-κB p65一抗(1:1000)、β-actin一抗(1:1000),4℃过夜,洗涤后加入辣根过氧化物酶标记的羊抗兔IgG(1:2000),室温孵育1 h,洗涤后发光压片,用凝胶图像扫描仪进行半定量分析。
1.3.5 ELISA法检测炎症因子TNF-α、IL-6和IL-1β表达 吸出孔内培养基,4℃ 12000 r/min离心20 min,吸出上清液待测。ELISA加样:分别设置标准孔、空白孔和测试孔。标准孔7孔,依次加入100 μl不同浓度的标准品,空白孔加入100 μl标准品稀释液,余孔加入细胞上清100 μl,设立6个复孔。酶标板加上覆膜,37℃温育2 h。之后弃去液体,甩干,加检测溶液,洗涤,每孔加底物溶液90 μl,37℃避光显色,加终止液终止反应,用酶标仪在450 nm波长测量各孔的光密度(OD)值。
1.4 统计学处理 使用SPSS 20.0统计软件处理数据,计量资料采用均数±标准差(±s)表示,多组间均数的比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞NF-κB p65、TNF-α、IL-6和IL-1β mRNA的表达比较 与空白对照组比较,LPS模型组NF-κB p65、TNF-α、IL-6和IL-1β的mRNA表达水平明显升高,差异有统计学意义(P均<0.05),提示成功诱导HCASMC炎性活化。HCASMC经高、低浓度紫杉醇水蛭素复合物预处理LPS刺激后,上述指标低于LPS模型组,差异有统计学意义(P均<0.05)(图1)。
2.2 各组细胞NF-κB p65蛋白表达比较 LPS模型组NF-κB p65蛋白表达水平明显高于空白对照组,而紫杉醇水蛭素预处理组NF-κB p65蛋白表达水平较LPS模型组明显降低,其中高浓度处理组降低更为显著(图2)。
2.3 各组细胞TNF-α、IL-1β和IL-6表达比较 与空白对照组比较,LPS模型组TNF-α、IL-1β和IL-6表达升高,差异有统计学意义(P均<0.05)。与LPS模型组比较,紫杉醇水蛭素低浓度与高浓度组TNF-α、IL-1β和IL-6表达明显降低,差异有统计学意义(P均<0.05)。其中高浓度紫杉醇水蛭素复合物干预后IL-1β表达下降较低浓度组更为显著,差异有统计学意义(P<0.05)(图3)。
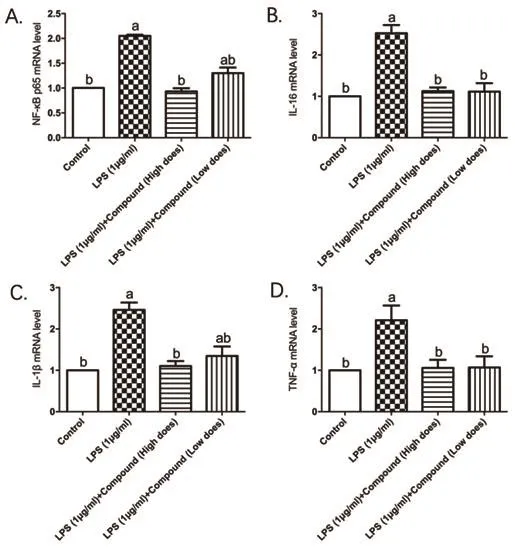
图1 各组细胞的mRNA表达比较
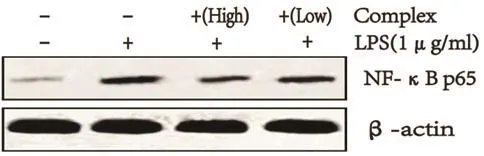
图2 各组细胞NF-κB p65蛋白表达比较(n=3)
3 讨论
自1977年Gruentzig在世界上完成首例经皮冠状动脉腔内成形术以来,经皮冠状动脉介入治疗(PCI)在短短30多年间经历了三个阶段:单纯球囊扩张时代、金属裸支架时代和药物洗脱支架(DES)时代,目前PCI已经成为狭窄性冠状动脉疾病的标准治疗方法,尤其新一代DES的广泛使用,然而支架置入后出现的慢性炎症反应、晚期及极晚期支架血栓形成等风险仍然存在[11-13]。PCI围手术期血栓形成的机制主要包括两个环节:凝血酶活化和血小板激活,其中凝血反应在该过程中发挥承上启下的作用,有效抑制凝血酶在抗细胞增殖、抗再狭窄治疗中意义重大[14,15]。
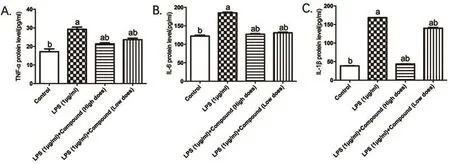
图3 各组细胞TNF-α、IL-1β和IL-6表达比较
这种背景下,本团队优化现有支架涂层药物紫杉醇,选择水蛭素按一定配比组成紫杉醇水蛭素复合物,制备出紫杉醇水蛭素复合药物涂层支架,小型猪在体试验中取得满意效果,且发现其抗再狭窄和血栓形成作用可能与抑制血管局部的炎症反应有关。进而选用不同浓度LPS(0.01、0.1、0.5、1、10 μg/m1)刺激HCASMC不同时间(6 h、24 h、48 h),筛选诱导HCASMC炎性活化的最佳条件,摸索出1 μg/ml的LPS干预HCASMC 48h可保证HCASMC处于持续的高炎性活化状态,为本研究抗炎机制探索建立了基础[16-18]。
本研究在已成功建立的HCASMC炎性活化模型基础上,分别选用高、低浓度紫杉醇水蛭素复合物对其进行药物干预,以NF-κB p65及其下游炎症因子的表达变化作为突破点,发现高、低浓度紫杉醇水蛭素复合物均能有效下调NF-κB p65及TNF-α、IL-1β和IL-6的基因表达水平,且在蛋白表达过程中发挥显著的抑制作用,高浓度的复合药物体现出更强的抗炎效果。以上结果说明,紫杉醇水蛭素复合物影响LPS激活NF-κB p65的转录和表达,下调炎症活化的级联反应,对LPS刺激下的HCASMC具有保护作用,从高、低浓度复合药物的抗炎效果差异来看,紫杉醇水蛭素复合物对HCASMC的保护作用在一定范围内呈现剂量依赖性。
NF-κB p65作为动脉粥样硬化性疾病的始动因素之一,广泛存在于人体组织细胞中,其被激活后暴露出核定位位点,可快速转移至细胞核中,大量分泌炎症因子及趋化因子,造成局部血管脂质沉积,快速促发平滑肌细胞增殖迁移,直接影响斑块稳定性,并成为导致PCI术后再狭窄及血栓形成的关键因素[19,20]。本研究从紫杉醇水蛭素支架涂层复合物对NF-κB p65及其信号转导通路下游炎症因子的影响进行了初步探索,为后续研究奠定了基础,下一步我们将从经典的TLR4-MyD88-NF-κB通路进行深入研究,以期能准确寻找出紫杉醇水蛭素复合物的作用靶点,为其抗PCI术后再狭窄及血栓形成提供科学数据支持。
[1] Jensen LO,Thayssen P,Christiansen EH,et al. Safety and efficacy of everolimus-versus sirolimus-eluting stents: 5-year results from SORT OUT IV[J]. J Am Coll Cardiol,2016, 67(7):751-62.
[2] Monlnne RA,Hoole SP,West NE. Prehospital ticagreler in ST-segment evevation myocardial infarction[J]. N Engl J Med,2014,371(24):1338- 2339.
[3] Stone GW,Lansky AJ,Pocock SJ,et al. Paclitaxel-eluting stents versus bare-metal stents in acute myocardial infarction[J]. N Engl J Med,2009,360(19):1946-59.
[4] Vecih Oduncu,Ayhan Erkol,Ibrahim Halil Tanboga,et al. Late bare metal stent thrombosis[J]. Turk Kardiyol Dern Ars-Arch Turk Soc Cardiol,2010,38(6):422-5.
[5] 任晓霞. 紫杉醇水蛭素复合物对兔血管内皮细胞和平滑肌细胞生长的影响[D]. 山西:山西医科大学,2011.
[6] 李红梅. 络风宁0号方对体外培养的人冠状动脉平滑肌细胞和内皮细胞生长的影响[D]. 北京:北京中医药大学,2015.
[7] 李红梅,王显. 水蛭素对体外培养的人冠状动脉平滑肌细胞和内皮细胞生长的影响[J]. 中国循证心血管医学杂志,2015,7(6):792-4,797.
[8] 李红梅,王显. 络风宁0号方对体外培养的人冠状动脉平滑肌细胞和内皮细胞生长的影响[J]. 世界中西医结合杂志,2016,11(1):29-33.
[9] Senftleben U,Karin M. The IKK/NF-κB pathway[J]. Crit Care Med,2002,30(1):S105-11.
[10] Zingarelli B,Sheehan M,Wong HR. Nuclear factor-κB as a therapeutic expression by PPM-18, a novel anti-inflammatory agent in vitro and in vivo[J]. Biochem J,1997,328(12):363-9.
[11] Shen Y,Li C,Zhang RY,et al. Association of increased serum CTRP5 levels with in-stent restenosis after coronary drug-eluting stent implantation: CTRP5 promoting inflammation, migration and proliferation in vascular smooth muscle cells[J]. Int J Cardiol,2017, 228(1):129-36.
[12] Gabbasov Z,Kozlov S,Byazrova S,et al. Blood level of CD45+ platelets and development of restenosis after drug-eluting stent implantation in patients with stable coronary artery disease[J]. Wien Klin Wochens chr,2016,128(23-24):898-905.
[13] Lih E,Jung JW,Joung YK,et al. Synergistic effect of anti-platelet and antiinflammation of drug-coated Co-Cr substrates for prevention of initial instent restenosis[J]. Colloids Surf B Biointerfaces,2016,140:353-60.
[14] Bliden KP,Tantry US,Gesheff MG,et al. Thrombin-Induced Platelet-Fibrin Clot Strength Identified by Thrombelastography: A Novel Prothrombotic Marker of Coronary Artery Stent Restenosis[J]. J Interv Cardiol,2016,29(2):168-78.
[15] Nijiati M,Saidaming A,Tuohuti A,et al. Clinical and Experimental Analysis of Platelet Micro Particles Inducing Thrombosis after Coronary Stenting[J]. Clin Lab,2016,62(9):1619-24.
[16] 李红梅,王显. 基于脂多糖诱导人冠状动脉平滑肌细胞炎性活化的热毒生风型络风内动细胞模型构建[J]. 中华中医药杂志,2016,31(8):3057-62.
[17] 李红梅,王显. LPS对体外培养的人冠状动脉平滑肌细胞炎症因子表达的影响——对建立支架内再狭窄炎症细胞模型的探索[J]. 中国循证心血管医学杂志,2016,8(3):297-301.
[18] 李红梅,王显. 脂多糖对体外培养的人冠状动脉平滑肌细胞生长的影响——对建立支架内再狭窄炎症细胞模型的探索[J]. 中国循证心血管医学杂志,2016,8(1):29-33.
[19] Landry DB,Couper LL,Bryant SR,et al. Activation of the NF-kappa B and I kappa B system in smooth muscle cells after rat arterial injury. Induction of vascular cell adhesion molecule-1 and monocyte chemoattractant protein-1[J]. Am J Pathol,1997,151(4):1085.
[20] Luciana L,Molinero,Maria-Luisa Alegre. Role of T cell-NF-κB in Transplantation[J]. Transplant Rev(Orlando),2012,26(3):189-200.
