心脏磁共振T1 Mapping技术和ECV评估扩张型心肌病心肌纤维化应用分析
2018-03-26李燕黄凌波付兵杨智赵志勇王波
李燕,黄凌波,付兵,杨智,赵志勇,王波
扩张型心肌病(DCM)属于临床常见原发性心肌病,调查显示发病年龄多在20~50岁,男性发病率高于女性,近年来发病率呈逐渐上升趋势,患者常伴发心律失常和肺栓塞,死亡率较高[1]。心肌纤维化是DCM较明显的的病理特征,若治疗不及时会形成瘢痕灶[2]。心脏磁共振成像(CMR)是检测DCM的常用手段,其中延迟钆增强(LGE)是评定心肌局部纤维化的金标准,但扫描技术与生理因素会对心肌纤维化定量评估造成一定误差[3]。最新研究显示,心室T1 Mapping技术可以无创测定T1弛豫时间来对心肌结构纤维化进行评定,被认为是CMR检测以外的重要辅助性检测方法[4]。本研究旨在探究T1 Mapping成像技术在DCM者心肌纤维化评定中的应用。
1 资料与方法
1.1 研究对象及分组 收集2015年11月~2017年3月于成都市第五人民医院放射科检查的63例DCM患者作为DCM组。DCM组纳入标准:①患者均经MR检测符合DCM诊断标准[5];②未接受心脏介入治疗;③无MR检查禁忌症;④研究对象均知情同意。DCM排除标准:①存在糖尿病、高血压、心脏病等病史;②贫血、心脏器质性病变、慢性肾炎等疾病;③心律不齐、心脏瓣膜病、肺心病、全身系统性疾病;④妊娠、精神疾病者。DCM组中男性41例,女性22例,年龄22~68岁,平均年龄(48.38±12.64)岁。选取成都市第五人民医院同期进行体检的52例健康者作为对照组,其中男性35例,女性17例,年龄27~71岁,平均年龄(47.86±11.51)岁。两组研究对象性别、年龄方面对比,差异无统计学意义(P>0.05)。所有入组对象均签署知情同意书。
1.2 检测方法 检测设备采用Philips Achieva 1.5T双梯度超导型磁共振设备(最大梯度场强66 mmT/m,最大梯度切换率180 T/m/s,爬升时间为0.18 ms,Achieva Noval Dual),采用16通道体部相控阵线圈。患者进行检查前由工作人员向其进行呼吸训练,取仰卧位,使用心电门控技术(ECG)检测。扫描序列为MOLLI序列T1 Mapping扫描,主要参数设置为TR:2.6 ms,TE:1.12 ms,FOV:360 mm×360 mm,矩阵:216×256,层厚10 mm。注射对比剂前在心室基底、中央以及心尖部位短轴层面进行MOLLI扫描,主要参数设置为TR/TE:2.4/1.14 ms,矩阵:144×256,FOV:270 mm×340 mm,层厚10 mm,加速因子2,扫描2个心动周期采集T1图像。采集T1图像后,对患者肘部采用高压注射器注射0.05 mol/L钆造影剂(马根维显,德国Bayer Schering Pharma AG公司,批号:20150701规格:1 mg/ml ),注射速率为2 ml/s,注射剂量为0.2 mmol/kg(体质量),采用 PSIR FLASH序列扫描,参数设置为:TR/TE:4.1/1.6 ms,矩阵:130×256,FOV:260 mm×350 mm,层厚8 mm,5 min后对两腔心、四腔心以及短轴进行图像采集。在注射对比剂5、10、15 min后进行中增强T1 Mapping扫描,序列参数设置同前。
1.3 图像分析
1.3.1 心功能分析 采用Q-Mass软件进行心功能分析,将心室基底、中央以及心尖部位短轴层扫描图像载入后截取舒张末期与收缩末期图像,采用手动勾画心内膜与心外膜并进行调整选取感兴趣区域(ROI),期间注意避开乳头肌、血池,根据计算机自动计算心功能相关指标,主要包括左心室质量指数、左室射血分数(LVEF)、左室舒张末期容积(LVEDV)、左室收缩末期容积(LVEDI)、每搏输出量、心率。
1.3.2 T1 Mapping图像分析 由成都市第五人民医院放射科两名资深影像学医师判定患者是否存在(LGE),意见不一致经讨论后达成一致对结果进行综合判断。根据DCM者是否存在LGE,分为LGE组与非LGE组,记录ROI区域(面积为1 m2)平均T1值,记录心室基底、中央以及心尖部位短轴层面增强前后T1值,ECV计算公式为心肌ECV=(1-HCT)/(心肌ΔR1-血流ΔR1),ΔR1=1/注射前T1-1/注射后T1,HCT为心肌细胞以及外间隙血液平衡时的血细胞比容,注射后T1为注射对比剂5、10、15 min后,计算三次增强前后ΔR1,计算增强后5 min、15 min、30 min平均ECV。
1.4 观察指标 对比DCM组与对照组及LGE组与非LGE组增强前T1值、增强后5 min、15 min、30 min T1值、ECV值。构建受试者工作特征(ROC)曲线,分析增强前TI、ΔTI、ECV区分DCM组与对照组的曲线下面积(AUC)并比较TI、ΔTI、ECV的诊断效能。
1.5 统计学方法 应用SPSS21.0软件对数据进行统计学分析,计数资料采用例数(百分比)表示,两组间比较采用χ2检验;计量资料采用(±s)表示,两组间比较采用t检验,多组间比较采用方差分析。ROC曲线分析比较各指标区分两组的AUC,通过约登指数确定截断值,得到以该截断值区分两组的灵敏度、特异度和准确度。以P<0.05为差异有统计学意义。
2 结果
2.1 基线资料比较 两组体质指数(BMI)、收缩压、舒张压、肌酐水平对比,差异均无统计学意义(P>0.05)(表1)。
2.2 两组患者心功能相关指标对比 DCM组左心室质量指数、LVEDV、LVEDI高于对照组,LVEF、每博输出量低于对照组,差异均有统计学意义(P均<0.05)。两组患者心率比较,差异无统计学意义(P>0.05)(表2)。
2.3 各组患者增强前后T1、ECV测定结果比较DCM组增强前T1、增强后5 min T、15 min 、30 min T1、ECV均高于对照组,差异有统计学意义(P<0.05)。DCM组中LGE组43例,非LGE组19例,LGE组增强前T1、增强后5 min T、15 min 、30 min T1、ECV均高于非LGE组,差异有统计学意义(P<0.05)(表3~4)。
表1 两组基线资料比较(±s)
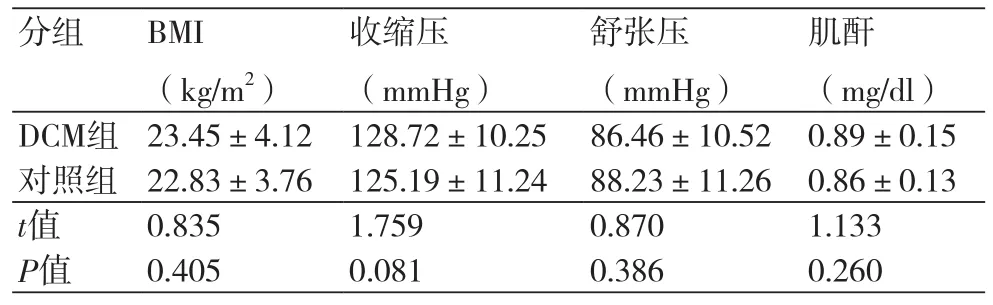
表1 两组基线资料比较(±s)
注:BMI:体质指数
分组 BMI(kg/m2)收缩压(mmHg)舒张压(mmHg)肌酐(mg/dl)DCM组 23.45±4.12 128.72±10.25 86.46±10.52 0.89±0.15对照组 22.83±3.76 125.19±11.24 88.23±11.26 0.86±0.13 t值 0.835 1.759 0.870 1.133 P值 0.405 0.081 0.386 0.260
表2 两组患者心功能指标比较(±s)

表2 两组患者心功能指标比较(±s)
注:LVEF:左室射血分数;LVEDV:左室舒张末期容积;LVEDI:左室舒张末期容积指数
DCM组(n=63) 72.35±5.37 62.39±7.64 26.37±7.39 257.43±87.13 124.38±39.82 51.64±16.37对照组(n=52) 69.78±9.36 51.19±8.24 52.64±12.73 115.67±38.92 57.71±17.39 64.38±21.27 t值 1.844 7.536 13.809 10.865 11.216 3.628 P值 0.068 0.000 0.000 0.000 0.000 0.000
表3 各组患者增强前后T1、ECV测定结果比较(±s)

表3 各组患者增强前后T1、ECV测定结果比较(±s)
注:ECV:细胞外容积
DCM组(n=63) 992.43±42.67 453.26±41.27 476.18±42.16 502.43±42.66 0.38±0.07对照组(n=52) 964.23±51.37 476.18±32.18 504.29±35.92 530.43±38.19 0.25±0.03 t值 3.039 3.009 3.517 3.408 11.225 P值 0.003 0.003 0.001 0.001 0.000
表4 LGE组与非LGE组增强前后T1、ECV测定结果比较(±s)

表4 LGE组与非LGE组增强前后T1、ECV测定结果比较(±s)
注:ECV:细胞外容积
LGE组(n=44) 1346.87±146.29 413.36±71.64 476.18±42.16 502.43±42.66 0.51±0.11非LGE组(n=19) 1164.23±115.37 478.46±82.19 523.16±61.42 562.32±45.36 0.26±0.04 t值 3.039 3.009 3.517 3.408 11.225 P值 0.003 0.003 0.001 0.001 0.000
2.4 增强前TI、ΔTI、强化后T1、ECV对DCM心肌纤维化的评估价值 ROC曲线区分DCM组和对照组,ECV的AUC值高于ΔTI和增强前T1。增强前TI、ΔTI、ECV区分两组的敏感度、准确率对比,差异有统计学意义(P<0.05)。ECV敏感度、准确率高于增强前T1,差异有统计学意义(P<0.05),ΔTI和ECV敏感度、准确率对比,差异无统计学意义(P>0.05)(图1~2,表5~6)。

图1(A)初始T1 mapping
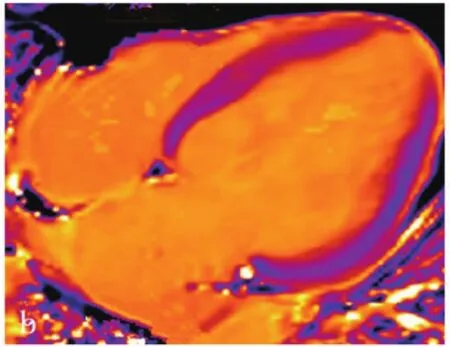
图1(B)强化后T1 mapping

图1(C)延迟强化(箭头代表LEG阳性区)
3 讨论
心肌纤维化形成的机制是胶原在细胞外逐渐聚集造成细胞外基质扩张,胶原合成与降解失衡,发病过程涉及免疫系统、RAAS系统以及其它多种因子共同参与,心肌纤维化会导致心室重构改变,影响心脏机械活动和电活动,最终使患者发生心力衰竭,使病死率升高[6,7]。
较多研究显示心肌纤维化使心肌僵硬性增加,顺应性降低,因此导致心脏收缩功能与舒张功能均降低,且纤维化严重程度与收缩运动功能存在一定的相关性[8]。本研究结果显示 DCM组左心室质量指数、LVEDV、LVEDI高于对照组,LVEF、每博输出量低于对照组,表明DCM组左心功能收缩、舒张功能明显降低,提示出现心肌病变。以往临床上常采用LGE对心肌纤维化进行评定,但由于依赖钆造影剂在纤维化心肌与正常心肌间的信号差异,因此存在一定的局限性,仅能反应病变的空间分布,不能对病变程度进行区分[9]。有研究显示当出现高血压、糖尿病等引起的弥漫性心肌纤维化时,以病理结果作为金标准LGE则会低估纤维化程度[10]。T1值为心肌的固有参数能够对心肌组织中含水量、纤维化以及胶原含量进行定量。最新研究显示T1 Mapping能够对组织的T1直接测量,具有可重复性且能降低心肌纤维评定的主观性,进而纵向研究心脏病变[11]。有学者研究表明采用钆增强翻转恢复序列测定T1能够评估心肌纤维化程度,并且测量结果与证实纤维化程度相关性程度较高[12]。本研究结果显示DCM组增强前T1、增强后5 min T、15 min 、30 min T1均高于对照组,提示患者心肌出现纤维化,以既往研究结果相符[13,14]。增强后的T1值均低于增强前,分析原因可能是受到组织间质间存留的对比剂的影响,使T1值降低,此外可能还有到肾小球滤过率、代谢率、对比剂使用量的影响。ECV主要通过增强前T1、增强后T1值计算得出细胞外体积分数,衡量组织内外细胞容积,随着胶原沉积的聚集ECV值逐渐增大,因此能够反应心肌病变看,ECV值较稳定,测定结果不受钆对比剂的使用量、血池中的廓清影响。病理组织结果证实ECV值随着心肌纤维化程度的加重,逐渐升高[15]。本研究结果显示DCM组ECV值明显高于正常组,且LGE组ECV值明显高于非LGE组,表明心肌纤维化加重则ECV值越高,提示ECV值可以预测患者心肌纤维化程度。

图2 增强前TI、ΔTI、强化后T1、ECV区分两组的ROC曲线分析

表5 增强前T1、ΔTI、ECV区分两组的ROC诊断效能对比

表6 增强前T1、ΔTI、ECV区分两组的AUC比较
国外学者研究显示T1 Mapping在对心肌斌患者心肌纤维化诊断时,其诊断特异度、灵敏度均达90%以上,且敏感性高于T2-STIR,能够对纤维瘢痕进行精确评估[16]。本研究结果显示ΔTI、ECV敏感度、准确率均高于增强前T1,且均在90%以上,表明ΔTI、ECV在评价心肌纤维化方面敏感性、准确度较高,且ROC曲线分析显示ECV的AUC值高于ΔTI、增强前T1,均大于0.9,表明两者在诊断心肌纤维化当面诊断价值较高,但强化后T1值AUC值小于0.5,提示不适合用于评定心肌纤维化,这与国外研究结果强化后T1值AUC值大于0.9不相符[17],分析原因可能受到序列、及其或者患者心室壁厚度、病变区域等影响,是T1测量值存在误差,此外容积效应也会给测量结果造成误差。
然而,本次研究存在一定的局限性,未对心肌纤维化不同区域进行研究,未对出现LGE区的纤维化形态进行深入研究,仅统计发生LGE的数量;未提供患者病理结果以LEG作为金标准进行对比;未进一步探究患者心肌应变力,有待后续深入研究。
综上所述,DCM者对心肌T1值变化较敏感,通过对患者测定心肌增强前后T1值、ECV值能够对患者是否发生心肌纤维化进行评价,对于DCM的治疗具有一定参考意义。
[1] 李世娥,侯杰,王铜,等. 中国北方非克山病病区扩张型心肌病患病率[J]. 中国地方病防治杂志, 2013,28(3):184-7.
[2] 童敏,张强,董佳敏,等. 扩张型心肌病患者血清可溶性ST2水平与Ⅰ型胶原代谢标志物相关性研究[J]. 临床心血管病杂志,2016,32(11):1146-9.
[3] 汪朝晖,廖玉华. 延迟钆增强能成为扩张型心肌病猝死预测因子吗?[J]. 临床心血管病杂志,2016,32(2):109-11.
[4] 孙英杰,程敬亮,张文博,等. T1 mapping评价扩张型心肌病心肌纤维化[J]. 中国医学影像技术,2016,32(4):509-12.
[5] Mangin L,Charron P,Tesson F,et al. Familial dilated cardiomyopathy:clinical features in French families[J]. European Journal of Heart Failure, 2014,1(4):353-61.
[6] 冯寒,张城林,吴丹,等. CTRP3通过抑制Smad3通路和肌成纤维细胞转化减轻心肌梗死后心肌纤维化[J]. 中国病理生理杂志,2015,31(10):1793.
[7] Touvron M,Escoubet B,Mericskay M,et al. Locally expressed IGF1 propeptide improves mouse heart function in induced dilated cardiomyopathy by blocking myocardial fibrosis and SRF-dependent CTGF induction.[J]. Disease Models & Mechanisms,2012,5(4):481-91.
[8] 唐惠芳,吴书林,邓春玉. 辛伐他汀减轻舒张功能不全心力衰竭大鼠心肌纤维化[J]. 中国动脉硬化杂志, 2012,20(11):976-80.
[9] 高红玲,张怡,许华燕. 肥厚型心肌病室性早搏分级与心肌纤维化程度的关系研究[J]. 实用心电学杂志,2017,26(1):39-42.
[10] 马兴鸿,汪蕾,王文尧,等. 特发性扩张型心肌病合并甲状腺功能减退加重心肌损伤的影像学评价[J]. 中华核医学与分子影像杂志,2014,34(3):161-5.
[11] 马晓海,赵蕾,李松南,等. 磁共振T1 mapping成像评价肥厚型和扩张型心肌病弥漫性心肌纤维化[J]. 中国医学影像技术,2016,32(1):52-6.
[12] Liu CY,Liu YC,Wu C,et al. Evaluation of Age-Related Interstitial Myocardial Fibrosis With Cardiac Magnetic Resonance Contrast-Enhanced T1 Mapping in the Multi-Ethnic Study of Atherosclerosis(MESA)[J]. Journal of the American College of Cardiology,2013,62(14):1280-7.
[13] 马晓海,赵蕾,李松南,等. MR纵向弛豫时间定量成像技术评价心肌病心肌纤维化及与心功能的相关性研究[J]. 中华放射学杂志,2016,50(1):13-7.
[14] 殷亮,喻思思,龚良庚. 磁共振T1mapping在心脏疾病中的应用[J].放射学实践,2016,31(6):546-9.
[15] 张丽君,范占明,贺毅,等. T1 mapping和ECV技术评估陈旧心梗左心室非梗死区心肌重构的应用价值[J]. 医学影像学杂志,2016,26(5):799-803.
[16] Salerno M, Kramer CM. dvances in parametric mapping withCMR imaging[J]. JACC Cardiovasc Imaging, 2013,6(8):929-30.
[17] Bauner KU,Biffar A,Theisen D,et al. Extracellular volume fractions in chronic myocardial infarction.[J]. Investigative Radiology,2012,47(9):538-45.
