NADPH氧化酶在阿霉素心脏毒性的表达及意义
2018-03-26王震王梦龙刘剑芳叶晶徐瑶姜慧敏叶迪万军
王震,王梦龙,刘剑芳,叶晶,徐瑶,姜慧敏,叶迪,万军
阿霉素(ADR)是一种广谱抗肿瘤药物,属蒽环类抗生素,临床上广泛用于治疗各种恶性肿瘤[1]。多项研究证实,心肌细胞对阿霉素有极强的亲和力,阿霉素极易在心肌细胞蓄积,产生氧化应激损伤,导致严重的心脏毒性反应[2]。阿霉素心脏毒性作用早期表现非特异性的心电图改变,如心律不齐,T波低平、ST-T改变和QT间期延长等,晚期则表现为顽固性的充血性心力衰竭。阿霉素心脏毒性具有累积效应,通常发生在积累量大于500 mg/m2[3]。然而,最近研究表明仍有21%的患者在积累量低于300 mg/m2时出现治疗相关的心脏毒性[4]。因此,阐明阿霉素心脏毒性的具体机制,寻找有效的防治药物,对改善患者预后具有重要意义。
氧化应激是指机体内在各种理化因素的刺激下,活性氧类(ROS)和活性氮类(RNS)大量蓄积,导致严重的组织细胞损伤过程。NADPH氧化酶(Nox)是心肌组织ROS和RNS的主要来源之一[5]。目前研究证实,Nox参与调控多种心血管疾病,包括心力衰竭、动脉粥样硬化、心肌缺血再灌注损伤、高血压病和心肌病等[6]。Matsushima等[7]证实在心肌缺血再灌注损伤模型中,Nox2和Nox4表达显著上调,同时伴随ROS水平升高,提示Nox在调控心肌缺血再灌注损伤的过程中发挥重要作用。然而,尚无研究阐明Nox介导的氧化应激与阿霉素心脏毒性的联系。因此,本实验构建小鼠阿霉素急性心脏毒性模型,探讨Nox在阿霉素心脏毒性模型中的表达及其内在机制,旨在为防治阿霉素心脏毒性提供新的思路和理论依据。
1 材料与方法
1.1 实验动物模型建立 40只8~10周龄SPF级野生型C57BL/6J雄性小鼠,由武汉大学动物实验中心提供,体重为24±2 g,饲养于武汉大学心血管病研究所动物房。待小鼠适应环境1周后分组,随机分为对照组和模型组,每组各20只。其中,模型组一次性腹腔注射20 mg/kg的阿霉素,对照组注射等量生理盐水。2组小鼠均于第5 d处死,称量并记录小鼠体重、心脏质量和胫骨长度,计算心重胫骨长度比。
1.2 实验仪器、药品和试剂 组织研磨仪(MM400,Retsch),超声裂解仪(XL-2000,Misonix ),全自动酶标仪(Synergy H4,BioTek),电转仪(XCell SureLock™,Invitrogen),实时荧光定量PCR检测仪(Cycler 480,Roche),电泳仪(DYY-6C,北京六一),离心机(1-14ED,Sigma),电泳槽及转膜槽(DYCP-31DN,北京六一),双色红外激光成像系统(Oddesy,LICOR),脱水机(JJ-12J,武汉俊杰),包埋机(JB-P5,武汉俊杰),病理切片机(RM2016,上海徕卡),组织摊片机(KD-P,浙江科迪),烤箱(DGX-9003B,上海福玛),倒置荧光显微镜(NIKON ECLIPSE TI-SR,日本尼康),TRIzol(10296010,Thermo Fisher Scientific),逆转录试剂盒(04897030001,Roche),Anti-GAPDH、anti-Nox2和anti-Nox4抗体购自美国Santa Cruz公司,TUNEL试剂盒购自Roche公司。阿霉素注射剂购自浙江海正药业股份有限公司。1.3 荧光TUNEL检测 每组都各取10个心脏用4%多聚甲醛固定、脱水机内梯度酒精脱水,包埋后将蜡块固定在石蜡切片机上切片,然后将切片摊平后置于烤箱内烘干,待脱蜡至水后微波修复。切片稍甩干后滴加破膜工作液破膜,将TUNEL试剂盒中的试剂1(TdT)和试剂2(dUTP)按2:29混合后加到切片上孵育2 h,待DAPI复染细胞核后用抗荧光淬灭封片剂封片,最后将切片置于倒置荧光显微镜下观察并采集图像。
1.4 心肌组织mRNA表达检测 于-80℃冰箱取出样本,放入研磨仪中研磨,每管加入1 ml TRIzol,用力摇晃后静置10 min。加入200 ul三氯甲烷后放入4℃离心机,12 000 r离心15 min。离心后吸取上层清液,加入500 ul异丙醇并12 000 r离心10 min以沉淀RNA。离心后可见絮状沉淀位于管壁和管底,用微量移液器去掉上清溶液,用1 ml 75%乙醇漂洗3次。漂洗后吸尽75%乙醇,室温干燥10 min,然后加入12 ul DEPE水溶解RNA,同时放入55℃水浴锅中10 min,以促进RNA的溶解。待RNA完全溶解后,用紫外分光光度计测定RNA浓度,计算RNA提取量。待RNA反转录为cDNA后,构建PCR反应体系,以GAPDH作为内参,采用2-△△Ct法进行定量分析。利用Primer-BLAST在线设计引物,特异性引物序列由北京擎科新业生物技术有限公司合成,Nox2和Nox4的特异性引物序列见表1。
1.5 心肌组织Nox2和Nox4蛋白表达水平检测 取30~40 mg心肌组织,按照100 mg/1 ml加入RIPA裂解液,研磨后用超声裂解仪裂解样本。裂解后将标本放入4℃离心机,12 000 r离心15 min,然后吸取上清液并记录上清液体积。待组织样本定量后,72℃水浴10 min使蛋白变性,放入-80℃备用。将配制好的10%SDS凝胶放进电泳槽,按40 ug/样品上样电泳。电泳结束后取出凝胶,将凝胶平铺在特制的夹板上,将PVDF膜覆盖其上后转膜,转膜完成后用封闭液封闭1 h。封闭结束后加入适量一抗,4℃孵育过夜,然后二抗孵育1 h,利用双色红外荧光成像系统扫膜,以GAPDH为内参分析和计算Nox2和Nox4蛋白表达水平。
1.6 统计学方法 采用SPSS 18.0软件进行统计学处理。计量数据以均数±标准差表示,两组间比较采用独立样本t检验,非正态分布数据采用非参数检验。 P<0.05为差异有统计学意义。
2 结果
2.1 小鼠各项指标比较 相较于对照组,模型组小鼠体重(20.18±1.01)g vs.(24.63±1.32)g、心脏重量(99.3±3.21)mg vs.(120.95±3.87)mg和心重胫骨长度比(5.52±0.16)mg/mm vs.(6.71±0.21)mg/mm均明显减小(P<0.05)(图1)。
2.2 荧光TUNEL结果 相较于对照组,模型组小鼠心肌细胞凋亡指数明显增加(15.23±0.52)%vs.(2.03±0.15)%, 差异具有统计学意义(P<0.05)(图2)。

表1 Nox2和Nox4特异性引物序列
2.3 Nox2和Nox4 mRNA和蛋白质的表达 与对照组相比,模型组小鼠心肌Nox2和Nox4 mRNA和蛋白质表达升高(P<0.05),表明在阿霉素诱导的心脏毒性模型,Nox表达增加(图3~5)。
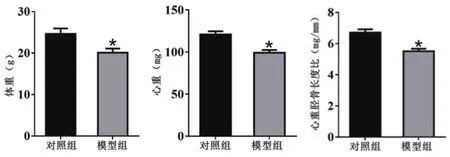
图1 2组小鼠体重、心重和心重胫骨长度比情况

图2 2组小鼠心肌细胞凋亡指数

图3 Nox2和Nox4 mRNA在心肌组织的表达(与对照组比较,*P<0.05)

图4 Nox2和Nox4蛋白电泳图

图5 Nox2和Nox4蛋白在心肌组织的表达情况(与对照组比较,*P<0.05)
3 讨论
阿霉素的心脏毒性一直是基础和临床研究的热点课题,但其具体机制至今仍未完全阐明。目前的主流观点认为阿霉素的心脏毒性是多种因素共同作用的结果,包括氧化应激损伤、钙超载、铁代谢失衡、线粒体损伤、细胞凋亡等。阿霉素诱导的ROS主要有二种途径:一是阿霉素的蒽环结构直接与胞内Fe3+结合,形成Fe3+-蒽环复合体,导致大量羟自由基的产生;二是阿霉素的蒽环在多种还原酶的作用下被还原为半酰自由基,通过与氧结合产生大量的ROS[8,9]。机体内的ROS主要包括超氧阴离子(O2-)、羟自由基(·OH)、过氧化氢(H2O2)和次氯酸(HOCl)等,ROS通过破坏细胞膜结构的完整性和改变膜蛋白的功能,增加细胞膜的通透性,导致核酸和蛋白质合成受阻,进而引起细胞凋亡。此外,ROS在线粒体大量堆积,干扰线粒体有氧呼吸电子传递链、三羧酸循环和脂肪酸氧化等过程,抑制三磷酸腺苷合成和分解,导致能量代谢障碍[10,11]。目前,ROS在阿霉素心脏毒性中的重要作用日益受到重视,多种抗ROS物质已被证明对阿霉素心脏毒性具有保护作用。
Nox是一类跨膜蛋白家族,包括Nox1、Nox2、Nox3、Nox4、Nox5、双功能氧化酶1和双功能氧化酶2等。 Nox主要由胞膜亚基(gp91phox和p22phox)和胞浆亚基(p67phox、p47phox、p40phox和Rac2GTP酶)两部分组成。其中,gp91phox是Nox主要的功能亚单位,而p22phox通过与Nox的激活因子结合,胞内调节作用[12]。心肌细胞主要表达Nox2和Nox4,其中,Nox2主要催化产生O2-,而Nox4主要产生大量H2O2[13]。Nox是细胞内ROS产生的主要来源之一,参与调控细胞增殖、凋亡及基因转录等。多项研究表明,Nox在心力衰竭、动脉粥样硬化、心肌缺血再灌注损伤、高血压病和心肌病等多种心血管疾病的发生发展过程起着重要的作用,但仍存在较大争议。最近的研究发现,在血管紧张素Ⅱ诱导的高血压模型,Nox2的表达升高,敲除Nox2可减轻血管紧张素Ⅱ诱导的升压效应,而过表达Nox2则加重血管紧张素Ⅱ诱导高血压[14]。Zhao等[15]也证实,过表达Nox4加剧血管紧张素Ⅱ诱导的心肌肥厚和间质纤维化,而使用Nox4抑制剂可通过改善氧化应激和ROS生成,减轻心肌重构和纤维化。本课题组前期研究结果表明,心力衰竭患者心肌氧化应激水平升高,心肌组织Nox4表达上调,且通过激活丝裂原活化蛋白激酶通路参与心肌纤维化过程,而Nox2的表达无统计学意义,提示针对Nox4的干预可能改善心力衰竭和心肌纤维化[16]。
本研究首先通过大剂量注射阿霉素诱导心脏毒性反应,模型组小鼠心重、体重和心重胫骨长度比均明显下降,心肌细胞凋亡加重,表明心脏功能严重受损。同时,模型组小鼠心肌组织中Nox2和Nox4 mRNA和蛋白质水平均明显上调,推测阿霉素可能通过上调心肌组织Nox和氧化应激水平,加重心肌细胞凋亡,从而导致严重的心肌损伤。总之,本研究结果提示Nox通路参与阿霉素心脏毒性的损伤过程,而对Nox通路的干预有可能成为蒽环类抗癌药相关心脏毒性防治的有效靶点。
[1] 栾晓东,盖延红,万越,等. 右丙亚胺在应用蒽环类药物乳腺癌患者中的疗效观察[J]. 中国循证心血管医学杂志,2015(4):482-3.
[2] Vejpongsa P,Yeh ET. Prevention of anthracycline-induced cardiotoxicity: challenges and opportunities[J]. J Am Coll Cardiol,2014,64(9):938-45.
[3] Carvalho FS,Burgeiro A,Garcia R,et al. Doxorubicin-induced cardiotoxicity: from bioenergetic failure and cell death to cardiomyopathy[Z]. 2014:34(1),106-35.
[4] Kankeu C,Clarke K,Passante E,et al. Doxorubicin-induced chronic dilated cardiomyopathy-the apoptosis hypothesis revisited[J]. J Mol Med (Berl),2017,95(3):239-48.
[5] Roy J,Galano JM,Durand T,et al. Physiological role of reactive oxygen species as promoters of natural defenses[J]. FASEB J,2017,31(9):3729-45.
[6] 王梦龙,万军. NADPH氧化酶在常见心血管疾病中的表达与作用[J]. 中国医药导报,2015(26):34-8.
[7] Matsushima S,Kuroda J,Ago T,et al. Broad suppression of NADPH oxidase activity exacerbates ischemia/reperfusion injury through inadvertent downregulation of hypoxia-inducible factor-1alpha and upregulation of peroxisome proliferator-activated receptor-alpha[J].Circ Res,2013,112(8):1135-49.
[8] Carvalho FS,Burgeiro A,Garcia R,et al. Doxorubicin-induced cardiotoxicity: from bioenergetic failure and cell death to cardiomyopathy[J]. Med Res Rev,2014,34(1):106-35.
[9] Khan MA,Singh M,Khan MS,et al. Alternative approach for mitigation of doxorubicin-induced cardiotoxicity using herbal agents[J]. Curr Clin Pharmacol,2014,9(3):288-97.
[10] Zhang M,Shah AM. ROS signalling between endothelial cells and cardiac cells[J]. Cardiovasc Res,2014,102(2):249-57.
[11] Aggarwal NT,Makielski JC. Redox control of cardiac excitability[J].Antioxid Redox Signal,2013,18(4):432-68.
[12] Sirokmany G,Donko A,Geiszt M. Nox/Duox Family of NADPH Oxidases: Lessons from Knockout Mouse Models[J]. Trends Pharmacol Sci,2016,37(4):318-27.
[13] Zhang M,Perino A,Ghigo A,et al. NADPH oxidases in heart failure:poachers or gamekeepers?[J]. Antioxid Redox Signal,2013,18(9):1024-41.
[14] Santillo M,Colantuoni A,Mondola P,et al. NOX signaling in molecular cardiovascular mechanisms involved in the blood pressure homeostasis[J].Front Physiol,2015,6(7):194.
[15] Zhao QD,Viswanadhapalli S,Williams P,et al. NADPH oxidase 4 induces cardiac fibrosis and hypertrophy through activating Akt/mTOR and NFkappaB signaling pathways[J]. Circulation,2015,131(7):643-55.
[16] 王梦龙,刘剑芳,刘梦林,等. NADPH氧化酶在心力衰竭患者心肌中的基因表达及其与心肌纤维化关系的研究[J]. 疑难病杂志,2015(07):675-8.
