Alirocumab对临床心血管事件影响的荟萃分析
2018-03-26朱玉菡沈晓旭王臻李洁白
朱玉菡,沈晓旭,王臻,李洁白
Alirocumab是前蛋白转化酶枯草溶菌素9(PCSK9)抑制剂类的新型降脂药,主要作用机制是通过阻断PCSK9介导的低密度脂蛋白胆固醇(LDL-C)受体的降解来降低血浆LDL-C水平[1]。目前临床研究已证实Alirocumab可显著降低LDL-C水平[2,3],在他汀类药物不耐受的患者中可以作为替代他汀类药物的新型降脂药。但Alirocumab在降低LDL-C的同时是否存在心血管获益仍有待进一步研究。本文旨在通过检索国内外关于Alirocumab对心血管事件影响的随机对照研究,评价Alirocumab的心血管获益情况,为临床提供更可靠的理论依据。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型 随机对照试验(RCT)。
1.1.2 研究对象 高脂血症的患者。
1.1.3 干预措施 试验组:Alirocumab干预治疗;对照组:安慰剂或他汀类药物干预治疗。
1.1.4 结局指标 心源性死亡率、心肌梗死发生率、冠状动脉(冠脉)血运重建(TLR)发生率、卒中发生率、因不稳定性心绞痛住院率、临床总心血管事件发生率。
1.1.5 排除标准 ①重复发表的文献;②个案报告、综述、会议论文、文摘;③资料数据错误或不全,联系作者无果的研究;④非中、英文文献。
1.2 文献策略 计算机检索PubMed、The Cochrane Library、EMbase、Web of Science、中国生物医学文献数据库(CBM)、万方(WanFang Data)、维普(VIP)、中国知网(CNKI)数据库,检索时间均从建库至2017年5月。检索采用MeSH主题词和自由词相结合的方式检索。英文检索词包括 “Alirocumab”、 “PCSK-9” 、“hypercholesterolemia”、 “randomized”等;中文检索词包括 “Alirocumab”、“蛋白转换酶枯草杆菌蛋白酶/溶菌素 9”、 “高脂血症”、“随机对照”等。
1.3 文献筛选、资料提取与偏倚风险评价 由评价员进行2次独立筛选文献,提取资料并进行纳入研究的偏倚风险评估。如遇分歧,则讨论解决或经由第三方面协助解决。缺乏资料尽量与原作者联系并予以补充。进行文献筛选时首先剔除重复文献,然后阅读文题与摘要,排除病例报告、综述和明显不相关的文献,再进一步阅读全文,排除非RCT和数据不全的文献,最后确定纳入的文献。进行资料提取时采用自制的Excel表格提取,主要提取内容包括:①纳入研究的基本信息,包括文题、第一作者、发表时间、注册编号等;②研究设计类型及质量评价的主要因素;③试验组与对照组患者基本特征,例如纳入例数、干预措施、随访时间等;④结局指标和结果测量数据。纳入文献的偏倚风险评估采用Cochrane手册[4]的标准,主要针对以下方面进行评价:①随机分组方案;②分组隐藏;③盲法;④数据完整性;⑤选择性报道;⑥有无其他偏倚。
1.4 统计分析 采用Stata 12.0统计软件进行Meta分析。二分类变量采用相对危险度(RR)及95%可信区间(CI)表示。纳入研究的异质性检验采用χ2检验,同时结合I2定量判断异质性大小,若P>0.1、I2<50%,可认为多个同类研究具有同质性,采用固定效应模型进行Meta分析;如果P≤0.1、I2≥50%,可认为多个同类研究具有异质性,则进一步分析异质性来源,并进行敏感性分析或亚组分析,除外明显临床异质性后采用随机效应模型进行Meta分析。发表偏倚采用Egger检验和漏斗图进行检测。Meta分析的检验水准设为α=0.05。
2 结果
2.1 文献检索结果 初检出相关文献1439篇,经逐层筛选后,最终纳入9个RCT[5-13],共4799例患者,其中Alirocumab组3123例,对照组1676例。文献筛选流程及结果见图1。
2.2 纳入研究的基本特征 本研究共纳入9个随机对照研究,发表年份为2014年~2016年。9个研究均为多中心、双盲RCT。单个研究样本量最大2341例,最小107例。随访时间最短24周,最长104周。具体资料见表1,偏倚风险评价结果见表2。
2.3 Meta分析结果
2.3.1 心源性死亡率 共纳入7个RCT[7-13],4057例患者。异质性检验结果示:P=0.862,I2=0%;采用固定效应模型Meta分析结果示:Alirocumab组与对照组相比心源性死亡率显著降低,差异有统计学意义(RR=0.36,95%CI:0.14~0.93,P=0.035)(图2)。
2.3.2 心肌梗死发生率 共纳入6个RCT[7-12],3884例患者。异质性检验结果示:P=0.201,I2=31.3%;采用固定效应模型Meta分析结果示:Alirocumab较对照组相比心肌梗死发生率未见明显降低,差异无统计学意义(RR=0.72,95%CI:0.43~1.20,P=0.207)(图3)。

图1 文献筛选流程图
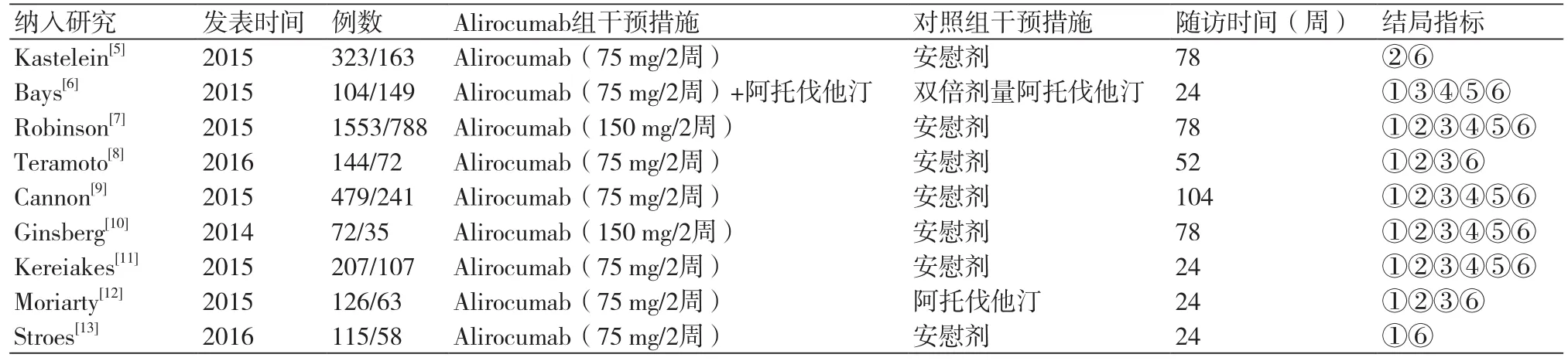
表1 纳入研究的基本特征(Alirocumab组/对照组)

表2 文献偏倚风险评估表

图2 Alirocumab组与对照组比较的心源性死亡率森林图
2.3.3 冠脉血运重建发生率 共纳入6个RCT[7-12],3884例患者。异质性检验结果示:P=0.771,I2=0%;采用固定效应模型Meta分析结果示:Alirocumab较对照组相比冠脉血运重建率未见明显降低,差异无统计学意义(RR=1.25,95%CI:0.83~1.88,P=0.292)(图4)。
2.3.4 卒中发生率 共纳入4个RCT[7,9,10,11],3479例患者。异质性检验结果示:P=0.616,I2=0%;采用固定效应模型Meta分析结果示:Alirocumab较对照组相比卒中发生率未见明显降低,差异无统计学意义(RR=1.82,95%CI:0.56~5.94,P=0.321)(图5)。
2.3.5 因不稳定性心绞痛住院率 共纳入4个RCT[7,9,10,11],3479例患者。异质性检验结果示:P=0.602,I2=0%;采用固定效应模型Meta分析示:Alirocumab较对照组相比因不稳定性心绞痛住院率未见明显降低,差异无统计学意义(RR=0.51,95%CI:0.07~3.60,P=0.496)(图6)。
2.3.6 临床总心血管事件发生率 共纳入9个RCT[5-13],4799例患者。异质性检验结果示:P=0.879,I2=0%;采用固定效应模型Meta分析示:Alirocumab较对照组相比临床总心血管事件发生率未见明显降低,差异无统计学意义(RR=1.10,95%CI:0.81~1.49,P=0.537)(图7)。

图3 Alirocumab组与对照组比较的心肌梗死发生率森林图

图4 Alirocumab组与对照组比较的冠脉血运重建发生率森林图
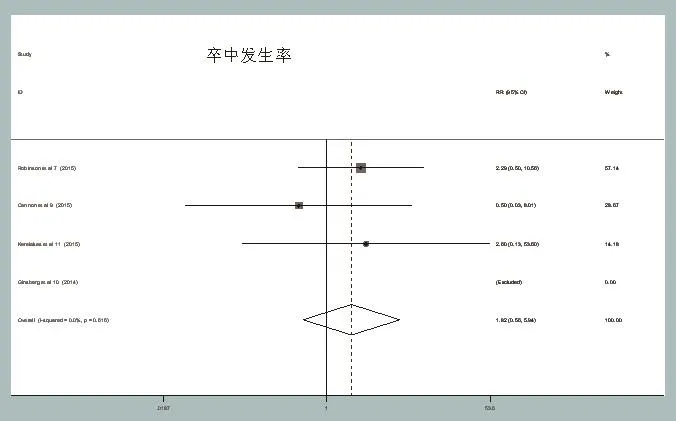
图5 Alirocumab组与对照组比较的卒中发生率森林图

图6 Alirocumab组与对照组比较的因不稳定性心绞痛住院率森林图
2.4 敏感性分析 本篇荟萃分析纳入研究异质性较小,剔除随访时间较短的研究,对剩余研究重新进行Meta分析,结果显示合并效应量并未发生明显变化。2.5 发表偏倚 以临床总心血管事件发生率为例,采用Egger检验对纳入研究进行发表性偏倚检验,由于本研究纳入的研究数量有限,结果示可能存在一定的发表性偏倚(P=0.028),漏斗图见图8。

图7 Alirocumab组与对照组比较的临床总心血管事件发生率森林图
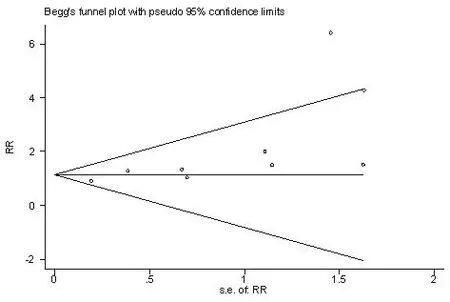
图8 基于临床总心血管事件发生率的漏斗图
3 讨论
自2003年Seidah首次发现PCSK9突变基因以来,PCSK9已成为降脂治疗的新靶点[14-20]。PCSK9抑制剂主要通过阻断PCSK9介导的LDL-C受体的降解来降低血浆LDL-C水平。关于PCSK9抑制剂在降低LDL-C的同时是否存在心血管获益也成为这类新型降脂药备受关注的焦点。近年来有研究发现PCSK9抑制剂Evolovumab可以降低早期心肌梗死发生风险和1年心血管事件风险[21,22]。Alirocumab作为PCSK9抑制剂类药物之一,目前国内外关于Alirocumab的心血管获益情况的大样本随机对照研究较少值得临床进一步研究。
本篇荟萃分析共纳入9个随机对照研究,总计4799例患者。纳入研究均为多中心、双盲设计,纳入研究总体质量较高。研究结果显示Alirocumab可显著降低患者心源性死亡率,但在心肌梗死发生率、冠脉血运重建发生率、卒中发生率、因不稳定性心绞痛住院率以及临床总心血管事件发生率并未显示明显优势。Alirocumab的心血管获益尚不明确。但本篇荟萃分析纳入研究相对较少,关于Alirocumab的心血管获益情况还需临床大样本随机对照试验进一步验证。
本偏荟萃分析仍存在一定的局限性:①缺乏灰色文献资料,如未发表的研究资料。②本篇荟萃分析纳入研究相对较少,病例数有限。③虽然本研究制定统一的纳入标准和排除标准以尽量减少纳入研究的异质性,但由于纳入研究的干预措施仍有差别,因此不能排除存在偏倚的可能。④本篇荟萃分析纳入的研究中PCSK9抑制剂的用药剂量单一,其他不同剂量的PCSK9抑制剂是否存在心血管获益还未可知,仍需后续进一步研究。
综上所述,当前证据表明Alirocumab可显著降低患者心源性死亡率风险,但对心肌梗死发生率、冠脉血运重建发生率、卒中发生率、因不稳定性心绞痛住院率及临床总心血管事件发生率上并未显示明显优势。Alirocumab的心血管获益尚不明确。上述结论仍需更多高质量RCT加以验证。
[1] Farnier M,Colhoun HM,Sasiela WJ,et al. Long-term treatment adherence to the proprotein convertase subtilisin/kexin type 9 inhibitor alirocumab in 6 ODYSSEY Phase III clinical studies with treatment duration of 1 to 2 years[J]. J Clin Lipidol,2017,2874(17): 30342-2.
[2] Kastelein JJ,Hovingh GK,Langslet G,et al. Efficacy and safety of the proprotein convertase subtilisin/kexin type 9 monoclonal antibody alirocumab vs placebo in patients with heterozygous familial hypercholesterolemia[J]. J Clin Lipidol,2017,11(1):195-203.
[3] Robinson JG,Rosenson RS,Farnier M,et al. Safety of Very Low Low-Density Lipoprotein Cholesterol Levels With Alirocumab: Pooled Data From Randomized Trials[J]. J Am Coll Cardiol,2017,69(5):471-82.
[4] Higgins JP,Green S. Cochrane Handbook for Systematic Reviews of Interventions(Version 5.1.0)[EB/OL]. Available at: http://www.cochrane-handbook.org.
[5] Kastelein JJ,Robinson JG,Farnier M,et al. Efficacy and Safety of Alirocumab in Patients with Heterozygous Familial Hypercholesterolemia and LDL-C of 160 mg/dl or Higher[J].Cardiovasc Drugs Ther,2014,28(3):281-9.
[6] Bays H,Gaudet D,Weiss R,et al. Alirocumab as Add-On to Atorvastatin Versus Other Lipid Treatment Strategies: ODYSSEY OPTIONS I Randomized Trial[J]. J Clin Endocrinol Metab,2015,100 (8):3140-8.
[7] Robinson JG,Farnier M,Krempf M,et al. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events[J]. N Engl J Med,2015,372(16):1489-99.
[8] Teramoto T,Kobayashi M,Tasaki H,et al. Efficacy and Safety of Alirocumab in Japanese Patients With Heterozygous Familial Hypercholesterolemia or at High Cardiovascular Risk With Hypercholesterolemia Not Adequately Controlled With Statins-ODYSSEY JAPAN Randomized Controlled Trial[J]. Circ J,2016,25,80(9):1980-7.
[9] Cannon CP,Cariou B,Blom D,et al. Efficacy and safety of alirocumab in high cardiovascular risk patients with inadequately controlled hypercholesterolaemia on maximally tolerated doses of statins: the ODYSSEY COMBO II randomized controlled trial[J]. Eur Heart J,2015,36(19):1186-94.
[10] Kastelein JJ,Robinson JG,Farnier M,et al. Efficacy and Safety of Alirocumab in Patients with Heterozygous Familial Hypercholesterolemia and LDL-C of 160 mg/dl or Higher[J].Cardiovasc Drugs Ther,2014,28(3):281-9.
[11] Kereiakes DJ,Robinson JG,Cannon CP,et al. Efficacy and safety of the proprotein convertase subtilisin/kexin type 9 inhibitor alirocumab among high cardiovascular risk patients on maximally tolerated statin therapy: The ODYSSEY COMBO I study[J]. Am Heart J,2015,169(6):906-15.
[12] Moriarty PM,Thompson PD,Cannon CP,et al. Efficacy and safety of alirocumab vs ezetimibe in statin-intolerant patients, with a statin rechallenge arm: The ODYSSEY ALTERNATIVE randomized trial[J]. J Clin Lipidol,2015,9(6):758-69.
[13] Stroes E,Guyton JR,Lepor N,et al. Efficacy and Safety of Alirocumab 150 mg Every 4 Weeks in Patients With Hypercholesterolemia Not on Statin Therapy: The ODYSSEY CHOICE II Study[J].J Am Heart Assoc,2016, 13;5(9):e003421.
[14] Abifadel M,Varret M,Rabes JP,et al. Mutations in PCSK9 cause autosomal dominant hypercholesterolemia[J]. Nat Genet,2003,34(2):154-6.
[15] Wu NQ,Li JJ. PCSK9 gene mutations and low-density lipoprotein cholesterol[J]. Clin Chim Acta,2014,431(3):148-53.
[16] Cohen JC, Boerwinkle E, Mosley TH Jr,et al. Sequence variations in PCSK9, low LDL, and protection against coronary heart disease[J]. N Engl J Med,2006,354(12):1264-72.
[17] Giugliano RP,Desai NR,Kohli P,et al. Efficacy, safety, and tolerability of a monoclonal antibody to proprotein convertase subtilisin/kexin type 9 in combination with a statin in patients with hypercholesterolaemia (LAPLACE-TIMI 57): a randomised,placebo-controlled, dose-ranging, phase 2 study[J]. Lancet,2012,380(9858):2007-17.
[18] Koren MJ,Scott R,Kim JB,et al. Efficacy, safety, and tolerability of a monoclonal antibody to proprotein convertase subtilisin/kexin type 9 as monotherapy in patients with hypercholesterolaemia (MENDEL):a randomised, double-blind, placebo-controlled, phase 2 study[J].Lancet,2012,380(9858):1995-2006.
[19] Raal FJ,Stein EA,Dufour R,et al. PCSK9 inhibition with evolocumab(AMG 145) in heterozygous familial hypercholesterolaemia(RUTHERFORD-2): a randomised, double-blind, placebocontrolled trial[J]. Lancet,2015,385(9965):331-40.
[20] Sullivan D,Olsson AG,Scott R,et al. Effect of a Monoclonal Antibody to PCSK9 on Low-Density Lipoprotein Cholesterol Levels in Statin-Intolerant Patients. The GAUSS Randomized Trial[J]. JAMA,2012,30 8(23):2497-506.
[21] Kathiresan S. A PCSK9 missense variant associated with a reduced risk of early-onset myocardial infarction[J]. N Engl J Med,2008,358(21):2299-300.
[22] Sabatine MS,Giugliano RP,Wiviott SD,et al. Efficacy and safety of evolocumab in reducing lipids and cardiovascular events[J]. N Engl J Med,2015,372(16):1500-9.
