体素内不相干运动成像评估局部进展期直肠癌新辅助化疗后病理完全缓解
2018-03-22徐俏宇孙宏亮徐妍妍
徐俏宇,孙宏亮,徐妍妍,王 武
(中日友好医院放射科,北京 100029)
结直肠癌是全球发病率较高的肿瘤之一[1],其中1/3位于直肠,而在检出直肠癌时患者多已处于进展期。对于局部进展期直肠癌(locally advanced rectal cancer, LARC),术前新辅助化疗(neoadjuvant chemotherapy, NACT)可降低肿瘤分期和术后复发率,甚至可清除10%~30%患者的所有可见肿瘤细胞,达到病理完全缓解(pathological complete response, pCR)[2]。NACT可避免放射治疗带给患者排便功能、性功能和骨髓储备等的长期影响,且有研究表明单独使用NACT可得到与新辅助放化疗类似的治疗效果[3-4]。对于达到pCR的患者,手术可能无法提高其总生存率,反而可能引起多种手术并发症[5],因此术前准确评估pCR十分重要。体素内不相干运动(intravoxel incoherent motion, IVIM)成像技术可同时定量测量活体组织内的水分子扩散和微循环灌注情况[6-7]。本研究探讨LARC患者NACT后,IVIM在诊断pCR中的价值。
1 资料与方法
1.1 一般资料 回顾性分析2015年3月—2017年6月于本院经纤维结肠镜检查、手术病理证实为直肠腺癌的61例患者,男48例,女13例;年龄35~79岁,平均(59.6±10.2)岁;高位直肠癌4例,中位直肠癌31例,低位直肠癌26例。手术标本病理T分期:14例为ypT0,4例为ypT1,14例为ypT2,29例为ypT3;手术病理N分期:49例为ypN0,10例为ypN1,2例为ypN2。纳入标准:①美国癌症联合会(American Joint Committee on Cancer, AJCC)制定的第7版肿瘤分期为ⅢA期及以上;②行术前NACT;③NACT前后均行MR IVIM检查;④行手术切除。排除标准:①直肠黏液腺癌;②MR图像质量欠佳,无法准确勾画肿瘤边界;③肿瘤有远处转移。
每疗程NACT为2周,根据患者的身体情况和治疗反应行2~4疗程的治疗,方案为奥沙利铂联合氟尿嘧啶,同时使用亚叶酸钙辅助治疗。对患者均未行放射治疗。NACT后进行MR检查的时间平均(23.90±7.10)天。
1.2 仪器与方法 患者于检查当日空腹,检查前10 min肌内注射盐酸山莨菪碱10 mg。采用Philips Ingenia 3.0T MR扫描仪,32通道体部相控阵线圈,梯度场强度45 mT/m,梯度切换率200 mT/m/ms。常规扫描序列包括:矢状位快速自旋回波T2W,TR 4 203 ms,TE 102 ms,NEX 3,FOV 24 cm×24 cm,矩阵336×246,层厚4.0 mm,层间距0.4 mm;冠状位快速自旋回波T2W,TR 4 515 ms,TE 110 ms,NEX 3,FOV 24 cm×24 cm,矩阵336×253,层厚3.0 mm,层间距0.3 mm;轴位快速自旋回波T2W,于矢状位行扫描定位,扫描层面与肿瘤所处肠管的长径垂直,TR 5 191 ms,TE 102 ms,NEX 3,FOV 18 cm×18 cm,矩阵200×296,层厚3.5 mm,层间距0.35 mm。IVIM扫描采用单次激发平面回波序列,行轴位成像,方向与轴位T2W相同,TR 4 000 ms,TE 76 ms,NEX 3,FOV 40 cm×32 cm,矩阵160×104,层厚6.0 mm,层间距0.6 mm,b值分别为0、10、20、30、40、60、80、100、150、200、400、800、1 000、1 200、1 500、2 000 s/mm2,IVIM扫描时间约5 min。
1.3 图像处理与分析 由2名影像诊断经验分别为6年和10年的专业医师独立测量MRI数据。采用MATLAB软件分析IVIM扫描原始图像。将DWI(b=1 000 s/mm2)图像结合T2W图像沿肿瘤轮廓手动勾画ROI(体积约20~141 mm3),避开病变内坏死或囊变区域及肠管内的气体或液体。于肿瘤所有层面进行上述测量,计算每个参数的均值。ADC值采用单指数模型获得,IVIM参数,包括真实扩散系数(slow diffusion coefficient, D),灌注相关假扩散系数(fast diffusion coefficient, D*),灌注分数(perfusion fraction,f),根据LeBihan等[6]的双指数模型计算(图1)。当NACT后图像中无肿瘤残留时,在原肿瘤所在的肠壁勾画ROI(体积约20~40 mm3)。其中影像诊断经验为6年的医师间隔2周后重复上述测量。
所有参数NACT前后变化百分数通过以下公式计算:Δratio=(postθ-preθ)/preθ×100%,其中Δratio为NACT前后参数变化的百分数,θ为ADC、D、D*和f,preθ为NACT前的数值,postθ为NACT后的数值。
1.4 手术切除及病理学检查 对所有患者均在NACT后行全直肠系膜切除术。手术切除标本由病理医师根据AJCC的第7版TNM分期系统[8]进行分期,并根据Dworak等[9]提出的肿瘤退缩分级(tumor regression grade, TRG)系统进行分级,将分级为TRG 4级者归为pCR组,TRG 0~3级者归为非pCR组。
1.5 统计学分析 采用SPSS 20.0和Medcalc统计分析软件。所有ADC和IVIM参数结果均符合正态分布,以±s表示。采用组内相关系数(intraclass correlation coefficient, ICC)对同一医师(前后2次重复测量)及2名医师所测数据进行一致性分析,ICC为0~0.40为一致性较低,0.41~0.59为一致性中等,0.6~0.74为一致性良好,0.75~1.00为一致性好;采用独立样本t检验比较两组NACT前后所测的参数及其变化百分数。采用变异系数(coefficient of variation, CV)比较两组参数的变异程度;绘制ROC曲线,并计算曲线下面积(area under curve, AUC),评估各参数诊断pCR的效能,并采用Z检验分析各参数诊断pCR的AUC。P<0.05为差异有统计学意义。
2 结果
61例患者中,pCR组14例,非pCR组47例,其中TRG为3级5例,2级20例,1级20例,0级2例。
2.1 ADC值及IVIM参数的比较 pCR组的NACT前ADC值和D值显著低于非pCR组(P均<0.05),ΔratioADC值和ΔratioD值显著高于非pCR组(P均<0.05);其他参数两组差异均无统计学意义(P均>0.05),见表1。
表1 局部进展期直肠癌pCR组和非pCR组中ADC值及IVIM参数结果 (±s)
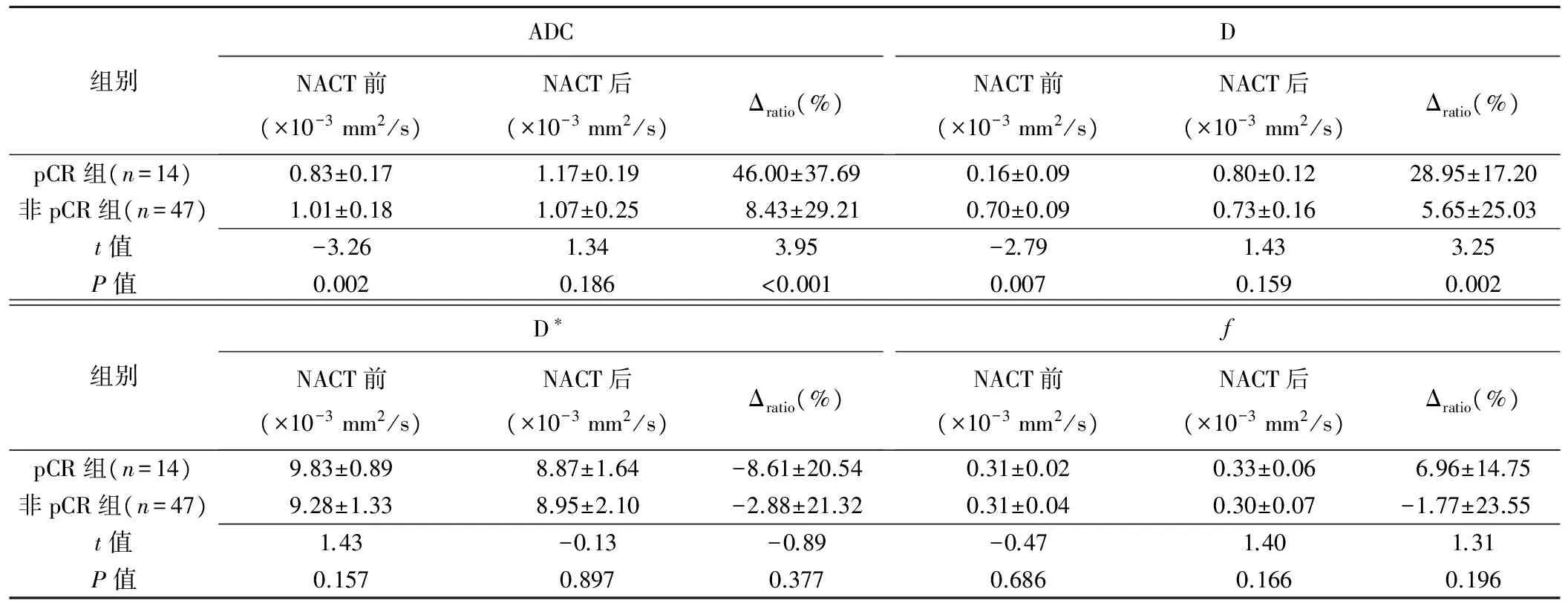
组别ADCNACT前(×10-3mm2/s)NACT后(×10-3mm2/s)Δratio(%)DNACT前(×10-3mm2/s)NACT后(×10-3mm2/s)Δratio(%)pCR组(n=14)0.83±0.171.17±0.1946.00±37.690.16±0.090.80±0.1228.95±17.20非pCR组(n=47)1.01±0.181.07±0.258.43±29.210.70±0.090.73±0.165.65±25.03t值-3.261.343.95-2.791.433.25P值0.0020.186<0.0010.0070.1590.002组别D∗NACT前(×10-3mm2/s)NACT后(×10-3mm2/s)Δratio(%)fNACT前(×10-3mm2/s)NACT后(×10-3mm2/s)Δratio(%)pCR组(n=14)9.83±0.898.87±1.64-8.61±20.540.31±0.020.33±0.066.96±14.75非pCR组(n=47)9.28±1.338.95±2.10-2.88±21.320.31±0.040.30±0.07-1.77±23.55t值1.43-0.13-0.89-0.471.401.31P值0.1570.8970.3770.6860.1660.196
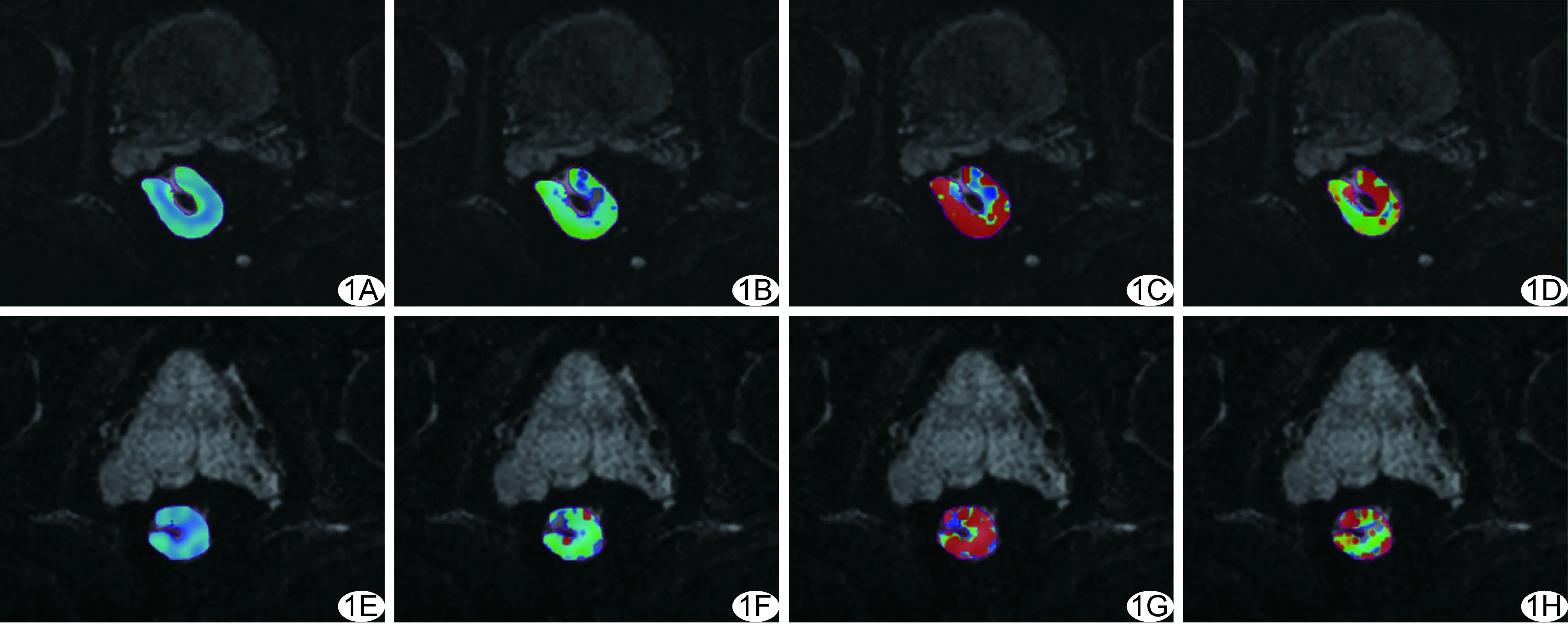
图1 患者男,55岁,局部进展期直肠癌pCR患者 A~D.肿瘤NACT前的轴位ADC、D、D*、f图,其中ADC、D、D*、f值分别为0.87×10-3 mm2/s、0.63×10-3 mm2/s、10.51×10-3 mm2/s、0.27; E~H.肿瘤NACT后的轴位ADC、D、D*、f图,其中ADC、D、D*、f值分别为1.11×10-3 mm2/s、0.83×10-3 mm2/s、6.82×10-3 mm2/s、0.19
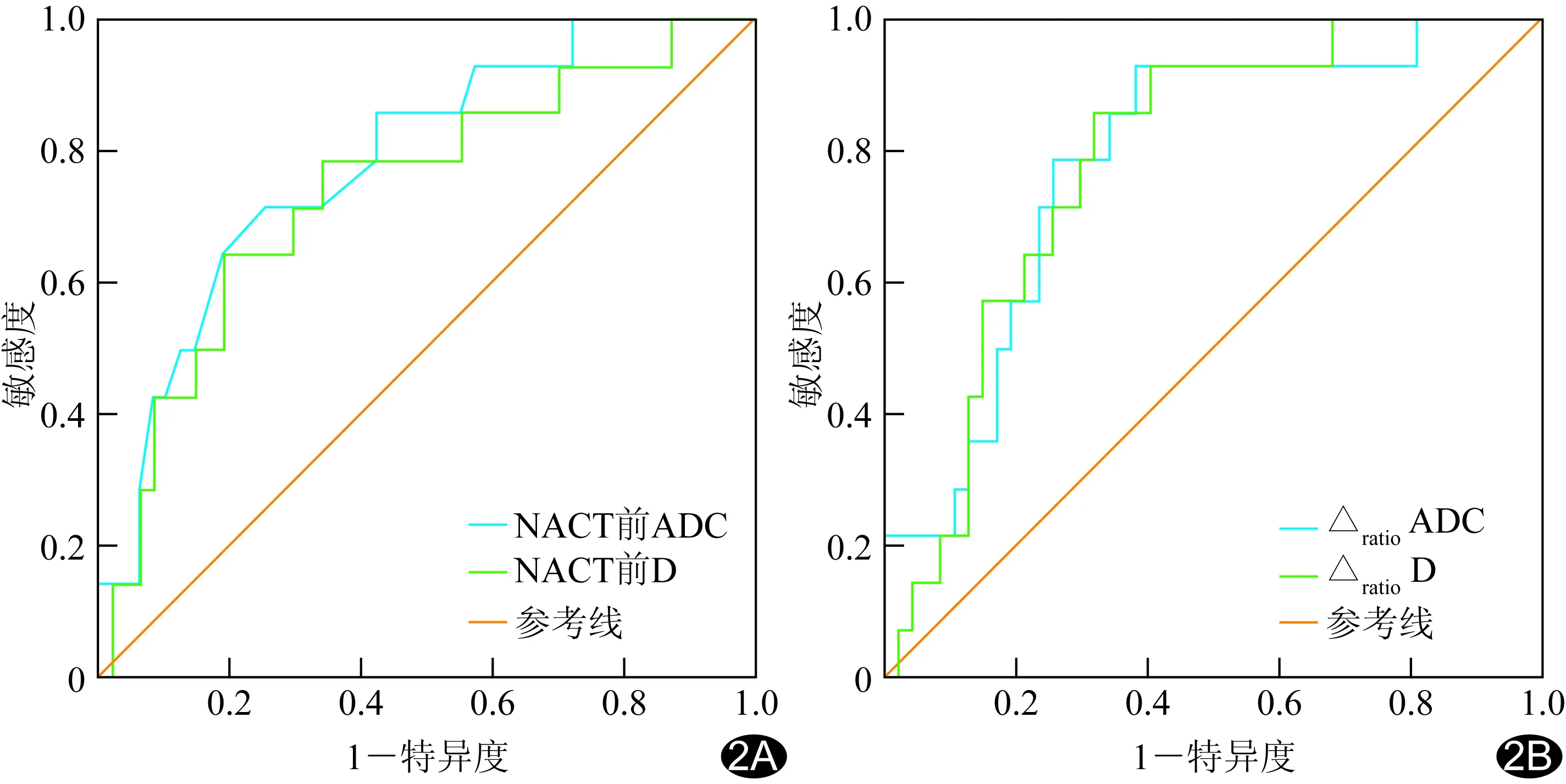
图2 ADC值和D值诊断pCR的ROC曲线 A. NACT前ADC值和D值; B.Δratio ADC值和Δratio D值
2.2 变异程度 NACT前ADC、D、D*、f,NACT后ADC、D、D*、f,ΔratioADC、ΔratioD、ΔratioD*、Δratiof在pCR组中的CV值(%)分别为20.15、13.96、9.05、6.69,16.13、15.81、18.44、17.31,81.93、59.42、238.52、212.01;在非pCR组中分别为18.11、12.61、14.30、13.34,23.48、22.34、23.43、21.55,346.69、443.10、741.28、1 332.27。
2.3 诊断效能 ΔratioD诊断pCR的AUC最高,为0.786(P<0.01),NACT前ADC、D、D*、f,NACT后ADC、D、D*、f及ΔratioADC、ΔratioD*、Δratiof的AUC分别为0.782、0.740、0.609、0.511,0.644、0.653、0.506、0.681及0.784、0.599、0.682;见表2和图2。
2.4 一致性分析 同一医师测量NACT前后ADC、D、D*、f值均有较好的一致性,NACT前ICC分别为0.980、0.953、0.965、0.968,NACT后ICC分别为0.911、0.969、0.962、0.966。2名医师测量NACT前后ADC值及D值、D*值、f值也均有较好的一致性,NACT前ICC分别为0.938、0.948、0.955、0.967,NACT后ICC分别为0.900、0.972、0.833、0.951。
3 讨论
在评估LARC患者新辅助治疗后达pCR时,既往方法多比较治疗前后肿瘤体积和ADC值变化。但治疗后肿瘤表现出的纤维化在T2图像上与残余肿瘤信号相似,导致评估体积的方法并不准确[10]。另外,ADC值采用单一b值的计算模型忽略了组织内微循环灌注的影响,而肿瘤具有不同程度的新生血管,导致各研究[2,11-12]结果不尽相同。
IVIM成像技术采用基于多b值DWI序列的双指数模型计算方法,应用D、D*值、f值对肿瘤组织内水分子扩散和微循环灌注分别进行定量评估[6]。在本研究中,pCR组和非pCR组间有统计学差异的参数中,ΔratioD值诊断pCR的效能最佳,与D值相较于ADC值可更真实地反映NACT前后肿瘤组织的水分子扩散情况有关,其余参数(f、D*)在两组间差异无统计学意义,因此笔者认为其在评价pCR时无诊断价值。
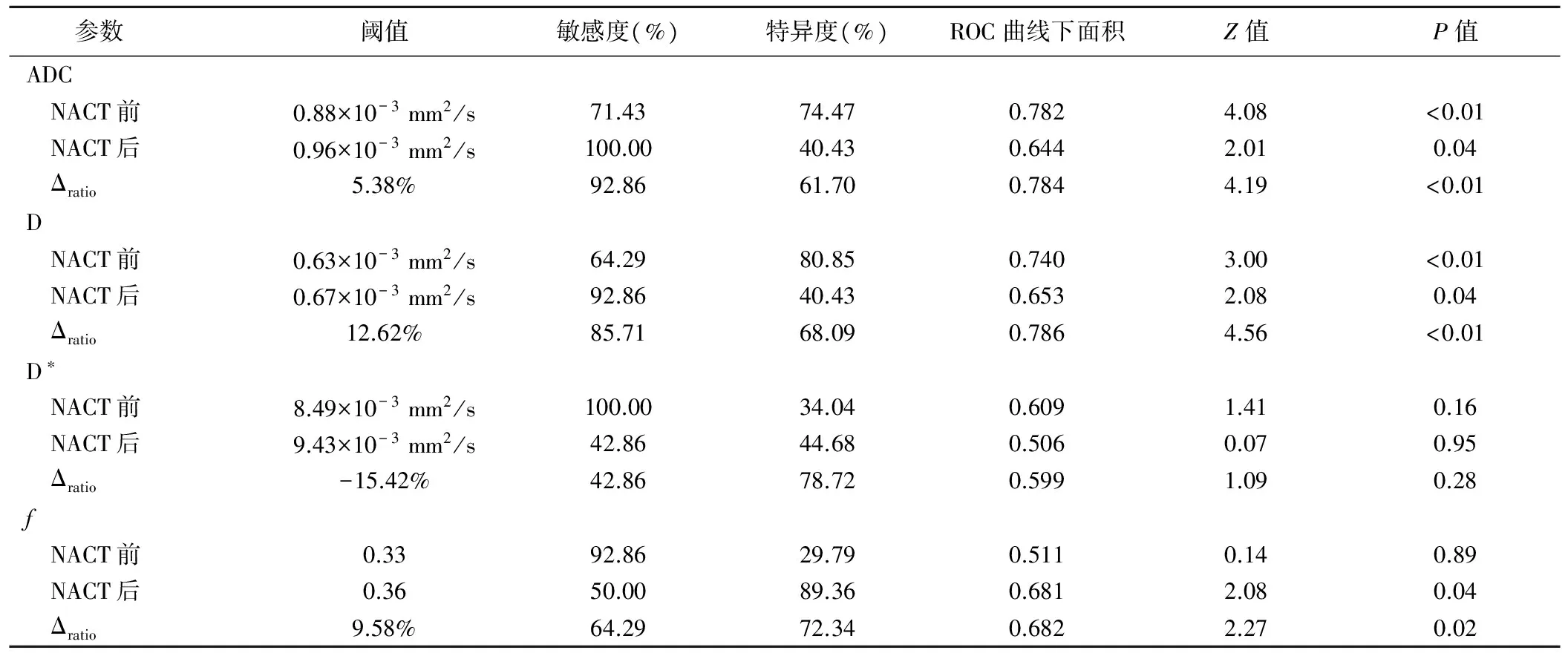
表2 ADC值及IVIM参数对局部进展期直肠癌pCR的诊断效能
本研究对比NACT前后两组参数,发现pCR组的NACT前ADC值和D值显著低于非pCR组,ΔratioADC值和ΔratioD值显著高于非pCR组。推测一方面可能因部分非pCR组的肿瘤存在坏死区,其不仅影响治疗效果,且在图像中反映为水分子扩散受限,出现高ADC值和D值;另一方面,肿瘤内分化程度不同的血管与治疗效果相关,因此pCR组的血管分化程度可能更高,从而疗效更优,肿瘤清除后细胞密度降低表现出更高的ΔratioD值。
本研究在比较各参数的CV时发现,ΔratioD*值和Δratiof值的CV高于其他参数,可能是因为D*值相对其他参数更易受噪声的影响[13],所以其应用受限;f值所代表的毛细血管和肿瘤细胞的信号比受T2的影响,治疗后肿瘤组织T2值的升高导致f值易被低估,且血管损伤受炎症和坏死等多重因素影响,所以即使pCR组可能获得更高的NACT前f值[14],笔者认为f值的应用价值仍有限。
既往认为NACT前ADC[2,11]和NACT前D值[14-15]与pCR无关。推测一方面因采用的MRI技术不同(如b值的选择),另一方面可能由于勾画ROI的方法不同,因肿瘤单个或几个层面勾画肿瘤轮廓的方法并不能很好地反映肿瘤的不均一性,且层面的选择常受观察者主观因素的影响,因此测量偏倚较为明显。Nougaret等[16]在对LARC术前疗效评估时,发现全肿瘤分析法可重复性高于单层面勾画ROI法。为获得更为可靠的数据,本研究采用全肿瘤分析法,在同一医师和不同医师间均获得了较好的一致性。
本研究的局限性:样本量较小易造成选择偏倚:仅对NACT前后的各参数进行分析,未关注NACT过程中不同周期各参数的变化情况;MRI的动态增强参数可直接定量评估肿瘤微循环的变化,未将其与IVIM参数进行比较;IVIM序列的双指数模型需足够的b值,但过多的b值会增加扫描时间,仍需进一步探讨适当的b值数量及其间隔。
综上所述,D值有助于预测及判断LARC患者能否在NACT治疗后达到pCR。
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012.Ca-Cancer J Cin, 2015,65(2):87-108.
[2] Engin G, Sharifov R, Gural Z, et al. Can diffusion-weighted MRI determine complete responders after neoadjuvant chemoradiation for locally advanced rectal cancer? Diagn Interv Radiol, 2012,18(6):574-581.
[3] Schrag D, Weiser MR, Goodman KA, et al. Neoadjuvant chemotherapy without routine use of radiation therapy for patients with locally advanced rectal cancer: A pilot trial. J Clin Oncol, 2014,32(6):513-518.
[4] Bruheim K, Guren MG, Skovlund E, et al. Late side effects and quality of life after radiotherapy for rectal cancer. Int J Radiat Oncol Biol Phys, 2010,76(4):1005-1011.
[5] Pozo ME. Watch and wait approach to rectal cancer: A review. World J Gastrointest Surg, 2015,7(11):306.
[6] LeBihan D, Breton E, Lallemand D, et al. Separation of diffusion and perfusion in intravoxel incoherent motion MR imaging. Radiology, 1988,168(2):497-505.
[7] 江建芹,崔磊,顾晓雯,等.体素内不相干运动模型扩散加权成像在肿瘤疗效评估中的进展.中国医学影像技术,2017,33(6):949-953.
[8] Edge S B, Compton CC. The American Joint Committee on Cancer: The 7th Edition of the AJCC Cancer Staging Manual and the Future of TNM. Ann Surg Oncol, 2010,17(6):1471-1474.
[9] Dworak O, Keilholz L, Hoffmann A. Pathological features of rectal cancer after preoperative radiochemotherapy. Int J Colorectal Dis, 1997,12(1):19-23.
[10] Beets-Tan RG, Beets GL, Vliegen RF, et al. Accuracy of magnetic resonance imaging in prediction of tumour-free resection margin in rectal cancer surgery. Lancet, 2001,357(9255):497-504.
[11] Hu F, Tang W, Sun Y, et al. The value of diffusion kurtosis imaging in assessing pathological complete response to neoadjuvant chemoradiation therapy in rectal cancer: A comparison with conventional diffusion-weighted imaging. Oncotarget, 2017,8(43):75597-75606.
[12] Lambrecht M, Vandecaveye V, De Keyzer F, et al. Value of diffusion-weighted magnetic resonance imaging for prediction and early assessment of response to neoadjuvant radiochemotherapy in rectal cancer: Preliminary results. Int J Radiat Oncol Biol Phys, 2012,82(2):863-870.
[13] Mazaheri Y, Afaq A, Rowe DB, et al. Diffusion-weighted magnetic resonance imaging of the prostate: Improved robustness with stretched exponential modeling. J Comput Assist Tomogr, 2012,36(6):695-703.
[14] Lu W, Jing H, Ju-Mei Z, et al. Intravoxel incoherent motion diffusion-weighted imaging for discriminating the pathological response to neoadjuvant chemoradiotherapy in locally advanced rectal cancer. Sci Rep, 2017,7(1):8496.
[15] Zhu H, Zhang X, Zhou X, et al. Assessment of pathological complete response to preoperative chemoradiotherapy by means of multiple mathematical models of diffusion-weighted MRI in locally advanced rectal cancer: A prospective single-center study. J Magn Reson Imaging, 2017,46(1):175-183.
[16] Nougaret S, Vargas HA, Lakhman Y, et al. Intravoxel incoherent motion-derived histogram metrics for assessment of response after combined chemotherapy and radiation therapy in rectal cancer: Initial experience and comparison between single-section and volumetric analyses. Radiology,2016,280(2):446-454.
