纤维素分解菌与乳酸菌复合发酵条件的响应曲面优化分析
2018-03-21张凡凡王旭哲唐开婷马春晖石河子大学动物科技学院新疆石河子832000
张凡凡,苗 芳,王旭哲,唐开婷,马春晖(石河子大学动物科技学院,新疆 石河子 832000)
响应曲面优化法(response surface methodology,RSM)是一种实验条件优化的方法,适宜解决各类非线性数据处理的相关问题。其主要优势在于可对实验水平进行连续的分析,而不是仅对孤立的实验点进行,所以具有普通正交实验方法无法比拟的优越性[1]。且此方法因研究的关系简单(各因子间、因子与响应值间)、省时准确等,所以常被认为是降低开发成本、优化加工条件、解决生产过程中实际问题的一种最为有效的方法,已被广泛地应用于各个领域[2-3]。当前,采用响应曲面分析法主要是对发酵工艺参数和条件等进行优化,而少见利用此方法优化青贮玉米外源添加菌种量和比例的相关研究。
青贮玉米原料附着多种微生物,其中有益微生物主要为同型或异性发酵乳酸菌,有害微生物多以真菌为主[4]。也有研究表明,某些真菌作为青贮添加剂添加,其不仅不会破坏原有的发酵过程,且可有效降低发酵底物的纤维素含量[5-7]。其中黑曲霉(Aspergillusniger)作为我国农业部和美国FDA认证的安全菌种,可产生活性较高的多种胞外酶,适合饲用复合酶的固体发酵[8]。绿色木霉(Trichodermaviride)作为自然界中普遍存在的真菌,其不但可以产生多种具有生物活性的酶系,且对植物病理生物防治具有重要的作用[9]。此外,某些细菌如枯草芽孢杆菌(Bacillussubtilis)是α-淀粉酶和中性蛋白酶的重要生产菌[10],具有抑制大肠杆菌、沙门氏菌生长,以及对植物病原真菌的溶菌等作用[11-12]。此外,上述菌种产生的酶系(糖化酶、纤维素酶、木聚糖酶等多种胞外酶)可将发酵底物中的多糖降解为寡糖和单糖,一方面可为菌体生长提供丰富的营养底物[5],另一方面对于青贮原料,可显著降低发酵体系内铵态氮和总氮的比值、中/酸性洗涤纤维含量、丁酸与总酸的比值,并大幅抑制了青贮有害微生物的生长[13-15]。以往诸多研究均表明,酶系是否在青贮中发挥作用既要控制青贮发酵的环境[16],也要充分考虑发酵菌种间的协同性。因此控制这些微生物的合理繁殖是调制优质青贮的重要前提之一。鉴于此,本研究拟采用响应曲面法,探究外源添加剂同、异型发酵乳酸菌和纤维素分解菌菌群(黑曲霉、绿色木霉、枯草芽孢杆菌)复合发酵的理论最佳发酵比例和剂量,为青贮玉米发酵提质降耗的理论研究提供基础,并为我国新型青贮添加剂的开发提供依据。
1 试验材料与方法
1.1 主要材料
本研究主要菌种为购自中国农业微生物菌种保藏管理中心(Agricultural Culture Collection of China,ACCC)的植物乳杆菌(Lactobacillusplantarum,ACCC 11016)、戊糖片球菌(Pediococcusacidilactici,ACCC 05481)、枯草芽孢杆菌(Bacillussubtilis,ACCC 19374)、黑曲霉(Aspergillusniger,ACCC 30134)和绿色木霉(Trichodermaviride,ACCC 30595)。购自中国工业微生物菌种保藏管理中心(China Center of Industrial Culture Collection,CICC)的布氏乳杆菌(Lactobacillusbuchneri,CICC 20293)。
1.2 试验设计
通过查阅关于添加同、异型发酵乳酸菌(LAB)发酵青贮玉米的相关文献,初步确定两类LAB的添加量[17]为1×105、3×105和5×105cfu·g-1(即5、5.48、5.70 lg cfu·g-1),其中同型发酵乳酸菌为植物乳杆菌和戊糖片球菌等比例混合(菌种数量比为1∶1)的复合菌,异型发酵LAB为布氏乳杆菌。纤维素分解菌菌群的添加比例为,黑曲霉∶绿色木霉∶枯草芽孢杆菌分别为1∶1∶2、1∶2∶1和2∶1∶1,添加量分别为0.1、0.2和0.3%[5-6]。然后进行响应曲面分析,优化各菌种比例和添加量。
1.3 指标测定及方法
将各个菌种复壮后,接种至选择性培养基中扩繁,其中LAB采用MRS液体培养基[配方:酪蛋白胨10.0 g,牛肉粉8.0 g,酵母粉4.0 g,葡萄糖20.0 g,硫酸镁0.2 g,乙酸钠5.0 g,柠檬酸二铵2.0 g,磷酸氢二钾2.0 g,硫酸锰0.05 g,吐温80 1.0 g,蒸馏水1 L,pH (6.2±0.2)],真菌Aspergillusniger、Trichodermaviride采用PDA液体培养基(配方:马铃薯提取液1 L,葡萄糖20.0 g,自然pH),Bacillussubtilis采用LB培养基(配方:酵母提取物5.0 g,蛋白胨10.0 g,氯化钠10.0 g,蒸馏水1 L,pH 7.0±0.2)。然后进行响应曲面优化,设计方法为BBD(box-behnken design),本研究中响应值为LAB和真菌的数量,自变量分别为同型发酵LAB添加量、异型发酵LAB添加量、纤维素分解菌菌群比例和剂量,分别以A、B、C和D代表,每个自变量的3个试验水平(低、中、高)编码分别为-1、0、1(表1)。然后将各个扩繁后的菌液按照BBD设计的添加比例和量进行混合,厌氧培养3 d后(35 ℃,pH 4.5)测定液体培养基中LAB和真菌的数量,具体采用传统菌种计数法计数[18],每个梯度做3个重复。取菌落数在30~300的平板作为有效计数板,菌落以肉眼可见为准,每克鲜样(FM)中微生物的数量,即菌落形成单位(cfu),计算方法为:
微生物数量=菌落数×稀释倍数×1 000/涂布吸样量。
1.4 数据统计分析
数据的初步整理和统计采用Microsoft Excel 2011软件。采用Design Expert软件进行响应曲面优化,设通过最小二乘法拟合的二次多项式模型为:
式中:Y为预测响应值,即LAB或真菌数量的预测值;xi和xj为自变量的编码值,c0为常数项,ai为线性系数,bij为二次项系数,n为因子数(n=4)。按照BBD试验设计的统计学要求对二次多项式中各试验进行回归拟合,拟合后获得回归方程,运用软件中自带功能,选取两个预测值均为最大(Y1为LAB,Y2为真菌数量),以此得到最佳的各水平编码值,最终计算求得各个变量的最佳组合[1-2]。
2 结果与分析
2.1 模型建立与显著性检验分析
采用BBD设计得到变量代码,按照变量代码进行试验,结果测得LAB最大值为9.96 lg cfu·g-1,其代码为1(A)、1(B)、0(C)、0(D);最小值为7.93 lg cfu·g-1,其代码为-1(A)、0(B)、-1(C)、0(D),总体平均值为8.63 lg cfu·g-1,总体标准差(SD)为0.16,变异系数(CV)为1.89%。真菌测得最大值为5.23 lg cfu·g-1,其代码为0(A)、1(B)、0(C)、1(D);最小值为3.92 lg cfu·g-1,其代码为1(A)、1(B)、0(C)、0(D),总体平均值为4.49 lg cfu·g-1,总体SD为0.27,CV为6.05%(表2)。

表1 试验因素与编码水平Table 1 The test factors and the coding level
纤维素分解菌依次为黑曲霉、绿色木霉和枯草芽孢杆菌。
Cellulose decomposing bacteria areAspergillusniger,TrichodermavirideandBacillussubtilis.
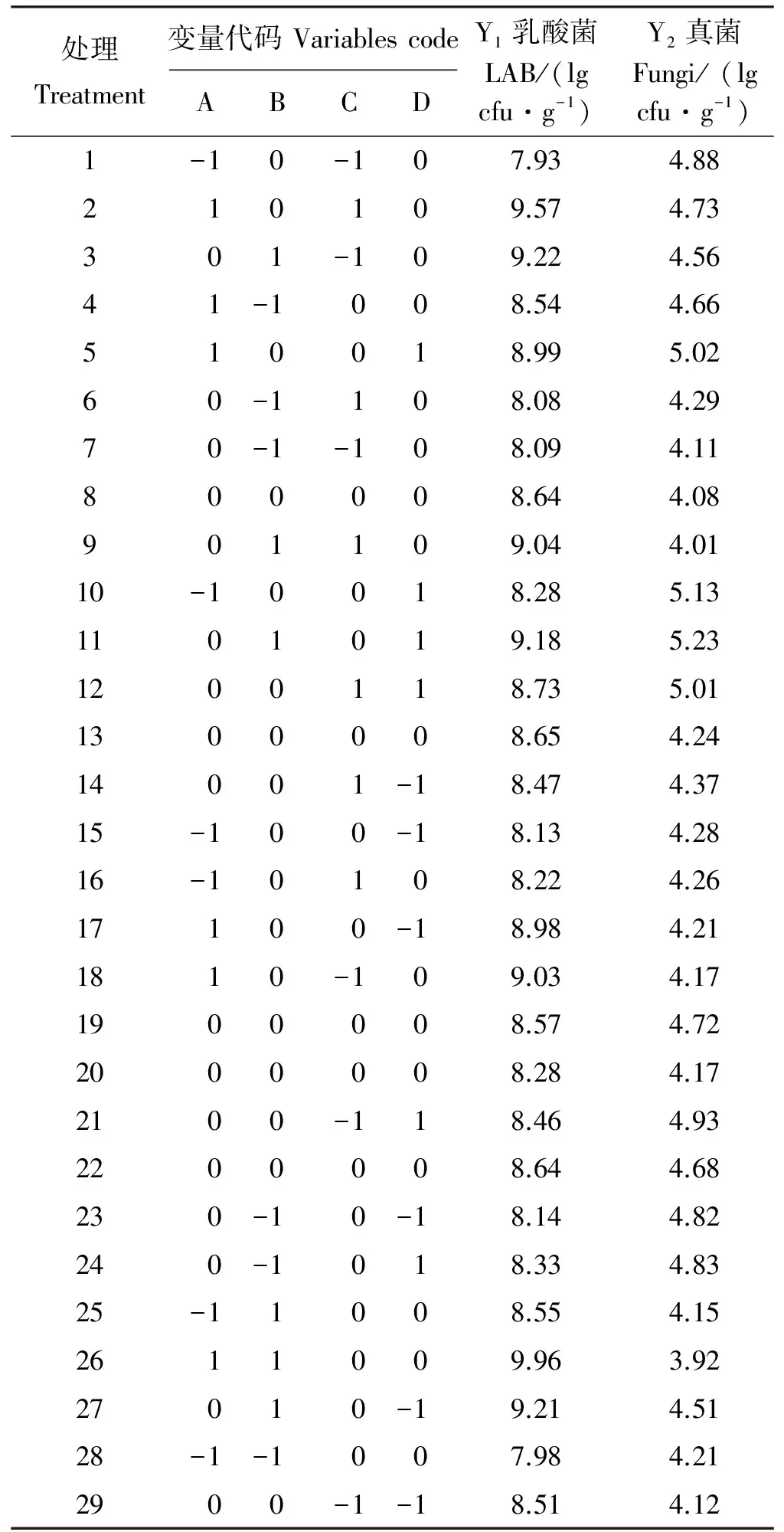
表2 Box-behnken试验设计及乳酸菌和真菌的实际值Table 2 The actual value of lactic acid bacteria and fungi and box-behnken experiment design
利用Design Expert软件,将表2的Y1和Y2数据按二次多项式模型进行多元回归拟合,获得Y1和Y2对编码自变量A、B、C和D的二次多项回归方程(表3):
Y1=8.56+0.50A+0.50B+0.07C+0.04D+0.09A2+0.11B2-0.01C2-2.58×10-3D2+0.21AB+0.06AC-0.04AD-0.04BC-0.06BD+0.08CD;
Y2=4.38-0.02A-0.05B-8.33×10-3C+0.32D-3.58×10-3A2-0.04B2-0.03C2+0.35D2-0.17AB+0.30AC-0.01AD-0.18BC+0.18BD-0.04CD。
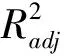

表3 乳酸菌和真菌数量的回归方程系数及其显著性检验Table 3 The regression equation coefficient and significance test of lactic acid bacteria and fungi number
2.2 复合发酵真菌和乳酸菌数量的响应曲面分析
通过对Y1所绘制的响应曲面图及等高线图可知(图1),A和B两个因素的交互对Y1影响最大,当A和B的代码越接近于1,Y1的值越趋于最大值(9.96 lg cfu·g-1)。A和C、D因素的交互作用中,起主要作用的均为因素A。B和C、D因素的交互作用中,起主要作用的均为因素B。C和D两个因素的交互对Y1的值基本无影响(P=0.36)。总体来看,仅A和B因素的交互作用影响显著(P=0.02),其余两因素的交互作用对Y1的值影响均不大(P>0.05)(表3)。通过对Y2所绘制的响应曲面图及等高线图可知(图2),对Y2的值起主要作用的为因素D,且因素D和其他因素的交互作用中因素D也也起到主要作用,但总体来看,除A、B因素交互作用外,其余各因素之间的交互作用对Y2的值影响均不大(P>0.05)(表3)。

图1 4个因素两两交互作用影响乳酸菌数量的曲面图及等高线图Fig. 1 Surfaces charts and contour maps of lactic acid bacteria number on interaction with four factors
Y1表示乳酸菌数量,A为同型发酵乳酸菌添加量代码,B为异型发酵乳酸菌添加量代码,C为纤维素分解菌比例代码,D为纤维素分解菌添加量代码。下同。
Y1is the lactic acid bacteria number. A is the quantity of homofermentative lactic acid bacteria. B is the quantity of heterofermentative lactic acid bacteria. C is the quantity of cellulose decomposing bacteria proportion. D is the quantity of cellulose decomposing bacteria concentration; similarly for the following figures.

图2 4个因素两两交互作用影响真菌数量的曲面图及等高线图Fig. 2 Surfaces charts and contour maps of fungi number on interaction with four factors
Y2表示真菌数量.
Y2is the fungi number.
最终利用软件求出Y1和Y2均为最大值的代码解(最优解)为A=1.000,B=0.853,C=1.000,D=0.996,将代码解换算成实际自变量可得,同型发酵LAB添加量为5×105cfu·g-1(5.70 lg cfu·g-1),异型发酵LAB添加量为4.7×105cfu·g-1(5.67 lg cfu·g-1),纤维素分解菌比例为2∶1∶1,添加量为0.3%。
3 讨论
以往研究很少对多种类菌种的复合发酵进行研究,类似研究多在发酵堆肥中使用[19-20]。本研究对LAB和纤维素分解菌复合发酵的发酵比例剂量进行了优化,而在实际发酵过程中,由于真菌和细菌的生长环境不同(好氧/厌氧)[21],而在复合培养情况下仅能确定一种生长环境,因此本研究模拟青贮发酵初期的好养环境对复合菌种进行了优化,得到的结果能很好地为今后青贮复合发酵添加剂的开发提供理论方法。此外,由于多种菌剂的复合发酵体系比较复杂,本研究仅对其进行了初步的探索,因此还需要继续开展实践研究。
本研究对复合菌种发酵体系内的LAB数量进行优化,而未对传统概念上认识的pH、乳酸或乙酸含量等发酵产物进行优化。其一方面原因为,LAB的代谢产物较多,产生情况较为复杂,且受发酵环境和底物的影响极大,而无论其代谢产物种类如何,其必然受自身数量的影响[22]。另一方面,由于本研究中探究复合发酵体系,单纯以某种LAB的代谢产物进行优化,并和真菌数量进行响应面分析,不能反映整体情况,且指标上不具有统一性。另外,选取多个LAB的多种代谢产物进行优化,其操作性较差,不易进行响应曲面优化。复合体系中将真菌数量作为另一个优化指标,其主要原因为本研究选取的能产生胞外酶的微生物,其产酶含量与数量呈显著正相关关系,以数量为响应值即能很好的反映产酶的含量[5-6]。
众所周知,LAB有抑制真菌生长的特性,而本研究需要真菌在青贮玉米发酵初期发挥其产胞外酶的特性,因此对好氧情况下真菌和LAB均达到最大值的发酵条件进行了优化。研究发现,在确定的4个发酵条件中,同、异型发酵LAB的数量以及其交互作用对总体LAB数量影响最大(表3),且当两类LAB数量最多时,总体LAB数量也最多,这与LAB生物学基础理论相同[23]。在发酵体系内加入的纤维素分解菌菌群的比例和剂量两个因素对LAB数量无显著影响(P>0.05),也进而证明了LAB数量并未受纤维素分解菌的抑制,这与诸多的研究结果相似,他们也都认为在厌氧条件下真菌不会抑制LAB的生长[24-25]。另外,本研究为多种类菌种的复合发酵,因此选用的培养条件不可能达到所有菌种最适的生长环境,且实际生产中青贮玉米的发酵环境也难于控制,所以本研究仅模拟了青贮发酵初期(3 d内)的环境进行研究[26],这可能也是导致LAB生长不受真菌抑制的主要原因。本研究还发现,在确定的4个发酵条件中,影响真菌数量的主要因素为纤维素分解菌的添加剂量,且同、异型发酵LAB添加量的交互作用对真菌也有显著影响(P<0.05),而纤维素分解菌的添加比例对其无显著影响(表3)(P>0.05),由此也进一步证实了LAB对真菌的抑制作用。另外,纤维素分解菌的比例和添加量的交互作用中以添加量为主导,其添加量越高,真菌数量越高(图2)。这也说明了真菌添加剂量对其数量起到了决定性作用[27]。值得注意的是,当纤维素分解菌的添加比例分别与同/异型发酵LAB添加量交互时,其产生了较大变异(图2),这可能是不同种LAB抑制真菌的种类不同所致[28],其具体原因还有待进一步分析研究。除此之外,当纤维素分解菌的添加剂量分别与同/异质型LAB添加量交互时,抑制真菌的效果异性发酵优于同型发酵(图2),这表明异型发酵LAB产抑制真菌生长的乙酸含量高于同型发酵LAB[29-30]。
4 结论
1)LAB数量(Y1)和真菌数量(Y2)对编码自变量A(同型发酵LAB添加量)、B(异型发酵LAB添加量)、C(纤维素分解菌比例)和D(纤维素分解菌添加剂量%)的二次多项回归方程为:
Y1=8.56+0.50A+0.50B+0.07C+0.04D+0.09A2+0.11B2-0.01C2-2.58×10-3D2+0.21AB+0.06AC-0.04AD-0.04BC-0.06BD+0.08CD;
Y2=4.38-0.02A-0.05B-8.33×10-3C+0.32D-3.58×10-3A2-0.04B2-0.03C2+0.35D2-0.17AB+0.30AC-0.01AD-0.18BC+0.18BD-0.04CD。
2)响应曲面分析法优化试验条件结果为,同型发酵LAB添加量为5×105cfu·g-1,异型发酵LAB添加量为4.7×105cfu·g-1,纤维素分解菌比例黑曲霉∶绿色木霉菌∶枯草芽孢菌为2∶1∶1,添加量为0.3%。
References:
[1] 王万中.试验的设计与分析.北京:高等教育出版社,2004.
Wang W Z.The Design of the Test and Analysis.Beijing:Higher Education Press,2004.(in Chinese)
[2] 方俊涛.响应曲面方法中试验设计与模型估计的比较研究.天津:天津大学博士学位论文,2011.
Fang J T.Comparison for experimental designs and modeling in response surface methodology.PhD Thesis.Tianjin:Tianjin University,2011.(in Chinese)
[3] 许晖,孙兰萍,张斌,石亚中.米曲霉固态发酵啤酒糟产α-淀粉酶的优化.农业机械学报,2008,39(1):82-86.
Xu H,Sun L P,Zhang B,Shi Y Z.Optimization of producing α-amylase from spent brewing grains under solid-state fermentation byAspergillusoryzae.Transactions of the Chinese Society of Agricultural Machinery,2008,39(1):82-86.(in Chinese)
[4] 李晓晖.饲用微生物的种类和主要作用.饲料工业,2002,23(2):30-32.
Li X H.Forage microbial species and the main role.Feed Industry,2002,23(2):30-32.(in Chinese)
[5] 任付平.复合微生物菌剂在全株玉米青贮中的应用与研究.西安:西北大学硕士学位论文,2007.
Ren F P.Research and application of compound microbial additives on the whole-crop corn silage.Master Thesis.Xi’an:Northwest University,2007.(in Chinese)
[6] 周丽蓉,冯雷,崔泽周,冯琳之,冯采.降解秸秆的微生物复合菌剂及其降解秸秆的方法:CN 103194392A.2015.
Zhou L R,Feng L,Cui Z Z,Feng L Z,Feng C.The method of straw degradation with bacterial complex:CN 103194392A.2015.(in Chinese)
[7] 美合热阿依·木台力甫.乳酸菌与纤维素分解菌混合添加剂对青贮饲料品质的影响研究.乌鲁木齐:新疆大学硕士学位论文,2014.
Mihray·Mutallip.Effects on mixed additive ofLactobacillusand cellulose decomposition bacteria on the silage quality.Master Thesis.Urumqi:Xinjiang University,2014.(in Chinese)
[8] 刘宇,李阳,史同瑞,朱战波.产纤维素酶黑曲霉菌的研究进展.畜牧与兽医,2015,47(6):157-159.
Liu Y,Li Y,Shi T R,Zhu Z B.The advance of produce celluloseAspergillusnige.Animal Husbandry and Veterinary Medicine,2015,47(6):157-159.(in Chinese)
[9] 葛文中,李楠.绿色木霉应用的研究进展.黑龙江八一农垦大学学报,2005,17(2):75-80.
Ge W Z,Li N.The advance of application ofTrichodermaviride.Heilongjiang August First Land Reclamation University,2005,17(2):75-80.(in Chinese)
[10] 和小黑,张文举,魏晓燕.枯草芽孢杆菌产酶活性改良研究进展.中国饲料,2014,515(15):8-10.
He X H,Zhang W J,Wei X Y.The techniques of increasing activity of the enzyme produced byBacillussubtilis.China Feed,2014,515(15):8-10.(in Chinese)
[11] 秦瑶,王苇,郭秉娇,王熙楚,张文举,周霞,王晓兰.2株枯草芽孢杆菌对大肠杆菌和沙门氏菌的体外抑菌试验研究.中国畜牧兽医,2014,41(1):207-210.
Qin Y,Wang W,Guo B J,Wang X C,Zhang W J,Zhou X,Wang X L.Study onBacillussubtilisstrains Q4 and Q10 inhibiting the growth ofEscherichiacoliandSalmonellain vitro.Chinese Animal Husbandry and Veterinary Medicine,2014,41(1):207-210.(in Chinese)
[12] 林福呈,李德葆.枯草芽孢杆菌(Bacilllussubtilis)S9对植物病原真菌的溶菌作用.植物病理学报,2003,33(2):174-177.
Lin F C,Li D B.Bacteriolysis ofBacillussubtilison plant fungal pathogens.Acta Phytopathologica Sinica,2003,33(2):174-177.(in Chinese)
[13] Sheperd A C,Maslanka M,Quinn D,Kung L J.Additives containing bacteria and enzymes for alfalfa silage.Journal of Dairy Science,1995,78(3):565-572.
[14] 万里强,李向林,何峰.添加乳酸菌和纤维素酶对苜蓿青贮品质的影响.草业科学,2011,28(7):1379-1383.
Wan L Q,Li X L,He F.The effect of adding lactic acid bacteria and cellulase on alfalfa silage quality.Pratacultural Science,2011,28(7):1379-1383.(in Chinese)
[15] 韩立英,玉柱,周禾.乳酸菌和纤维素酶对直穗鹅观草青贮的改善效果.草业科学,2013,30(9):1439-1444.
Han L Y,Yu Z,Zhou H.Effect of lactic acid bacteria inoculants and enzymes onRoegneriaturczaninoviisilages.Pratacultural Science,2013,30(9):1439-1444.(in Chinese)
[16] 张诗,林芝,余豪闯,罗宗志,庄益芬.酶制剂和绿汁发酵液对巨菌草青贮品质的影响.草业科学,2017,34(8):1755-1761.
Zhang S,Lin Z,Yu H C,Luo Z Z,Zhuang Y F.Effect of enzyme and fermented green juice on silage quality ofPennisetumsp. Pratacultural Science,2017,34(8):1755-1761.(in Chinese)
[17] Cho S,Kang J S,Cho K J.Effect of homofermentative and heterofermentative lactic acid bacteria on the quality and aerobic stability of silage:Meta-analysis.Journal of the Korean Society of Grassland and Forage Science,2014,34(4):247-253.
[18] 陈天寿.微生物培养基的制造与应用.北京:中国农业出版社,1995.
Cheng T S.Manufacture and Application of Microbial Culture Medium.Beijing:China Agriculture Press,1995.(in Chinese)
[19] Hmouni A,Mouria A,Douira A.Biological control of tomato grey fungi with compost water extracts,Trichodermaspecies andGliocladiumspecies.Phytopathologia Mediterranea,2006,45(2):110-116.
[20] 宫玉胜,李玉成,吴旺宝,刘珊垚.嗜热纤维素分解菌的筛选及混合发酵研究.江苏农业科学,2010,20(3):394-396.
Gong Y S,Li Y C,Wu W B,Liu S Y.Study on thermophilic cellulose decomposing bacteria screened and mixed fermentation.Jiangsu Agricultural Sciences,2010,20(3):394-396.(in Chinese)
[21] 夏新成.发酵棉籽粕菌种筛选和复合发酵工艺条件及其发酵活性产物研究.南京:南京农业大学硕士学位论文,2009.
Xia X C.Study on the strains screening,optimal parameters of detoxification and active products of mixed culture solid fermentation on cotton seed meal.Master Thesis.Nanjing:Nanjing Agricultural University,2009.(in Chinese)
[22] 王旭哲.全株玉米青贮发酵及有氧稳定期霉菌毒素动态变化研究.石河子:石河子大学硕士学位论文,2016.
Wang X Z.Study on the dynamic variation of mycotoxins during the fermentation and acobic stability of whole plant corn silage.Master Thesis.Shihezi:Shihezi University,2016.(in Chinese)
[23] 杨洁彬.乳酸菌:生物学基础及应用.北京:中国轻工业出版社,1996.
Yang J B.Lactic Acid Bacteria:Biological Basis and Application.Beijing:China Light Industry Press,1996.(in Chinese)
[24] Gourama H,Bullerman L B.Antimycotic and antiaflatoxigenic effect of lactic acid bacteria:A review.Journal of Food Protection,1995,58(11):1275-1280.
[25] 陈大欢,朱忆,盖天欣,张柏林,韩俊华.乳酸菌对酸乳中霉菌的抑制作用研究.中国乳品工业,2014,42(1):21-23.
Chen D H,Zhu Y,Gai T X,Zhang B L,Han J H.Inhibition effect of lactic acid bacteria to mold isolated from yogurt.China Dairy,2014,42(1):21-23.(in Chinese)
[26] 徐春城.现代青贮理论与技术.北京:科学出版社,2013.
Xu C C.Silage Science and Technology.Beijing:Science Press,2013.(in Chinese)
[27] 付春丽.青贮饲料霉变规律及防霉剂筛选研究.郑州:河南农业大学硕士学位论文,2012.
Fu C L.Study on regularity of mildew in the silage and the screening of mould inhibitor.Master Thesis.Zhengzhou:He’nan Agricultural University,2012.(in Chinese)
[28] Gerez C L,Torres M J,Valdez G F D,Rollán G.Control of spoilage fungi by lactic acid bacteria.Biological Control,2013,64(3):231-237.
[29] Filya I,Muck R E,Contreras-Govea F E.Inoculant effects on alfalfa silage:Fermentation products and nutritive value.Journal of Dairy Science,2007,90(11):5108-14.
[30] Lindseyj R,Limin K.Effects of combiningLactobacillusbuchneri40788 with various lactic acid bacteria on the fermentation and aerobic stability of corn silage.Animal Feed Science and Technology,2010,159(3-4):105-109.
