胫腓骨大块骨溶解症一例报告
2018-03-21陈金泉张世权关弘朱智祥李伟谭纪锋
陈金泉 张世权 关弘 朱智祥 李伟 谭纪锋
大块骨溶解症 (massive osteolysis,MO)[1],又称Gorham 病 (Gorham’s disease)[2]、Gorham-Stout 综合征 (Gorham-Stout syndrome)[3]、消失骨病 (disappearing or vanishing bone disease)[4-5]、自发骨溶解症 (idiopathic osteolysis)[6]、幽灵骨病 (phantom bone disease)[7]等,最早于 1838 年由 Jackson 率先报道[8],于 1955 年由 Gorham和 Stout 整理相关个案资料对本病进行了系统描述[9],Johnson 和 Mcclure[10]于 1958 年将本病正式命名为 MO,现多采用此名。MO 具有进行性骨溶解吸收的临床特点,临床上少见,全世界仅 200 余例[11]报道,目前关于其病因、诊断、治疗等方面仍存较大争议,尤其缺乏长期随访结果评估疗效,且药物治疗后病灶骨溶解静止并出现骨化者尚未见报告。我院 (深圳市第二人民医院) 收治 1 例右胫腓骨远端 MO 患者,其病情进展迅速、治疗见效快、药物治疗后病灶静止并骨化、术后 5 年随访无复发,现报告如下。
病例资料
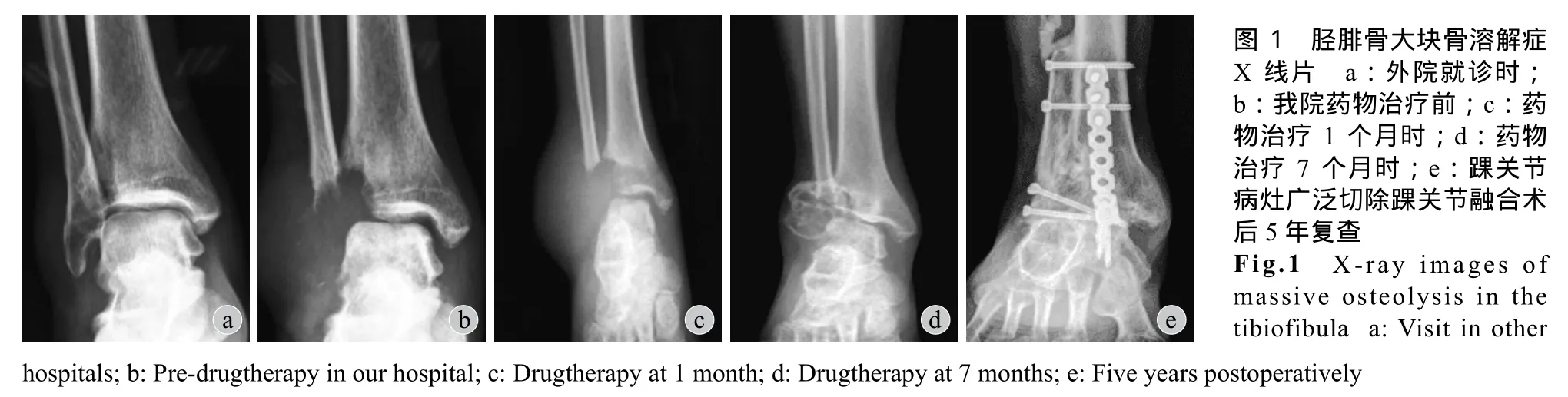
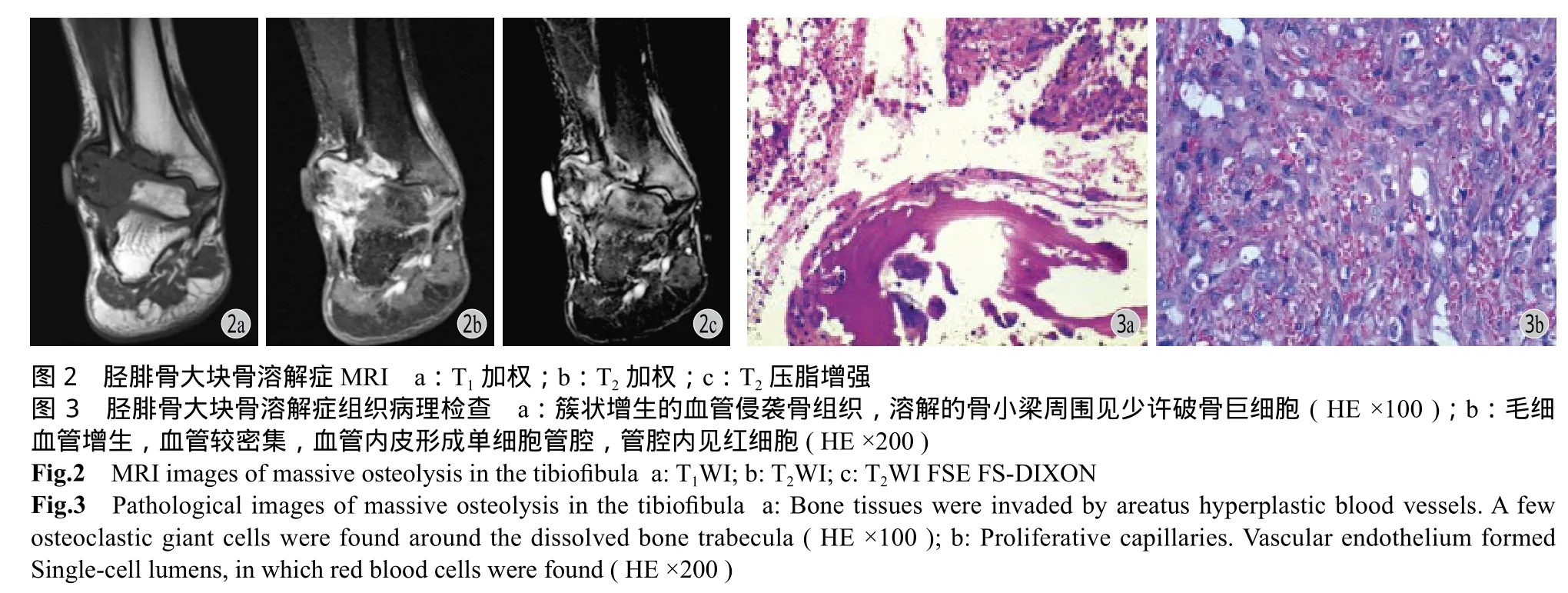
患者,男,36 岁。2011 年 8 月 20 日因扭伤致右踝肿痛,至当地医院就诊,行 X 线片检查 (图1a) 后诊断为“右胫骨撕脱性骨折”,予石膏固定、草药外敷治疗。因右外踝肿胀加重,伴夜间静息痛、右踝关节活动受限,于 2011 年 10 月 28 日转诊至我院。查体:右外踝肿胀明显,局部皮肤呈暗红色,浅表静脉无曲张,皮肤无破溃,皮温增高,右小腿远端广泛肿胀,局部可触及质韧肿物,基底广泛,移动度差,肿物局部有压痛,无放射痛,右踝关节活动受限,右髋、右膝关节活动正常。实验室检查:WBC、ESR、中性粒细胞百分比、碱性磷酸酶、酸性磷酸酶等均正常,PPD 试验阴性。X 线片检查示右侧胫腓骨远端溶骨性病变,病灶范围较前明显扩大 (图1b)。CT、MRI 检查 (图2) 均提示右胫腓骨远端溶骨性破坏及周围软组织病变,右距骨、跟骨部分受累,考虑恶性肿瘤性病变所致。于 2011 年 10 月 31 日行右踝病灶穿刺活检术,术后病理结果:考虑血管外皮瘤可能,与影像学诊断不完全一致,肿瘤组织太少,必要时重新活检。遂于 2011 年11 月 7 日再次行右踝病灶穿刺活检,术后病理示:成簇大小不等增生的血管,血管间可见增生的纤维母细胞及硬化的胶原,部分似毛细血管,血管内皮细胞增生,少许呈乳头状伴有纤维素渗出;免疫组织化学检测示:增生的血管内皮 CD34、CD31、FVIII 阳性,小血管周围见 SMA 阳性的血管周细胞,HMB45 阴性,Ki67<3%,成簇增生的小血管向骨组织内浸润性生长,局部区域见少许破骨细胞 (图3)。综合临床、影像及病理学资料诊断为“右胫腓骨远端 MO”。明确诊断后,患者拒绝截肢,要求保肢治疗。建议患者行唑来膦酸联合钙剂及维生素 D 方案控制病灶,由于缺乏 MO 相关药物治疗剂量及疗程方面的研究,因此,经患者知情同意后予静脉滴注唑来膦酸抑制骨吸收治疗,每次给药 4 mg,给药间隔时间为 28 天,同时每日口服 1 片碳酸钙 D3 片 (含 600 mg 钙、125 单位维生素D3),直至病灶稳定时,共应用唑来膦酸治疗 7 个周期。治疗期间患者病灶局部静息痛症状逐渐缓解,但负重活动仍痛性受限,及时复查血电解质、肾功能等检查,患者未出现发热、钙磷镁水平过低、肾功能损害、眼部炎症、颌骨坏死等不良反应及并发症。定期复查 X 线片,治疗 1 个月时见溶骨性病变静止 (图1c),3 个月时病灶范围开始缩小并出现骨化,7 个月时病灶明显缩小并骨化 (图1d)。病灶稳定后,为降低复发风险及重建患肢功能,于 2012 年 7 月 9 日行右踝关节病灶广泛切除踝关节融合术,术中见:右胫腓骨远端溶骨性病灶已完全硬化,边界清楚,剖面颜色呈暗红、灰白混杂,质硬。术后病理示:局部见纤维软骨化生及骨化,脱钙后见大量纤维组织增生、胶原化,少数小血管增生,考虑 MO 治疗后改变可能;免疫组织化学检测示:β-catenin (+),SMA (+),Ki67 约 1% (+),S100 (-),CD34 血管 (+)。病理诊断为MO 伴骨化。术后定期复查 X 线片,已随访 5 年余,右踝关节完全融合,病变无复发 (图1e)。
讨 论
一、病因
目前关于 MO 的病因主要有以下观点:(1) 血管组织异常增生;(2) 循环中 PDGF-BB 水平上升,通过相关信号通路促进淋巴管内皮细胞增殖;(3) 淋巴管、血管畸形紊乱;(4) 外伤致无症状性错构瘤激活;(5) 局部缺氧和酸中毒引起酶水解;(6) 破骨细胞前体对体液因子的敏感性增加,促进破骨细胞形成及骨吸收,此外单核巨噬细胞也参与骨吸收,其中白细胞介素-6、白细胞介素-1 及肿瘤坏死因子等起重要作用;(7) 局部成骨细胞活动受抑制[5,12-13]。然而,尽管观点众多,但目前为止尚无一种理论能完全解释疾病过程。
二、诊断
虽然目前 MO 病因未明,但包括报告病例在内,不少案例在发病前有外伤史,提示外伤可能与 MO 起病有关联,明确的外伤史对诊断 MO 具有一定的参考价值。
MO 可发生于任何年龄,以青少年为主,好发于骨盆、肩胛骨、脊柱等部位[14],极少发生于胫腓骨远端,部分案例的病程具有自限性,其临床表现视发病部位不同而不同,最常表现为局部疼痛、肿胀及功能损害,或合并病理性骨折[15],但无特异性。实验室检查主要为排除其它疾病,如感染、结核、甲状旁腺机能亢进等。影像学检查方面,X 线为主要检查手段,可见大量骨质溶解、消失,但无骨质增生硬化及骨膜反应,MO 初期的 X 线征象易与骨质疏松所致骨量丢失相混淆,但随着骨皮质的溶解吸收,残端变细,后期呈“笔尖样”改变[16],直至骨完全溶解消失,而本案例的 X 线表现为典型的“笔尖样”改变,且这种溶解可延伸至直接关节以外,累及相邻骨[17]。CT 可见局部骨质破坏及软组织影。MRI 检查中,骨质受累区域T1WI 呈低信号,T2WI 呈中、高信号[17-18]。CT 及 MRI 往往表现为恶性肿瘤征象,与临床表现及病理不一致,易致误诊、漏诊。本病例 CT 及 MRI 征象与文献报道相符,且从本病例 MRI 增强图像中可见病灶区域无明显强化,提示病变局部血供并不丰富,因此 MRI 增强图像可能有助于鉴别 MO 与血供丰富的恶性肿瘤。
MO 误诊率很高,需综合临床、影像及病理学资料作出诊断,其中病理学依据具有确诊意义[19]。Heffez 等于1983 年提出 MO 的 8 条诊断标准:(1) 活检发现血管瘤样组织存在;(2) 无细胞异型性;(3) 无或仅有轻微成骨反应,无不良钙化;(4) 有局部骨质进行性溶解吸收的证据;(5) 非膨胀性、溃疡性病变;(6) 无内脏受累;(7)影像学呈骨溶解征象;(8) 无遗传、代谢、肿瘤、免疫及感染病史[20]。鉴于近年有研究证实病灶内脉管为淋巴管,而非血管[21-24],因此诊断标准应相应作出调整。结合本病例,多次活检及获取足够样本量,有利于作出准确的病理诊断,必要时可考虑 CT 引导下穿刺活检或切开活检。
MO 的鉴别诊断包括遗传性多发骨溶解、肾病相关骨溶解、骨髓炎、类风湿性关节炎、骨内恶性肿瘤所致骨溶解、甲状旁腺机能亢进、嗜酸性肉芽肿以及中枢神经系统疾病所致骨溶解, 如脊髓空洞症和脊髓痨等[12]。
三、治疗
由于病因未明及发病率极低,MO 尚无确切有效的治疗方案,目前对于 MO 的治疗原则是抑制骨吸收、预防和处理并发症,主要的治疗手段包括手术、放疗及药物治疗[15]。手术主要用于病灶切除、功能重建及处理并发症,对于骨溶解进程未得到控制的病例,不宜进行功能重建手术,否则易致内固定失败[17,25]。而放疗多被提倡用于病灶部位无法手术、病灶多发以及术后复发的病例,根治性治疗剂量推荐 40~45 Gy,而低剂量放疗可用于术前辅助控制局部骨溶解[26],尽管有研究对 44 例 MO 患者进行放疗,平均随访 47.5 个月其病灶控制率达到 77.3%[27],但放疗可致骨坏死、肉瘤恶变、发育不良等严重并发症,因而限制了放疗的应用。药物治疗用于抑制骨吸收、稳定病灶,主要药物包括二磷酸盐、降钙素、干扰素以及成骨营养素 (如钙、磷、维生素 D) 等[5]。
目前主张综合治疗 MO,本病例在病灶切除联合功能重建手术前先采用唑来膦酸、钙剂及维生素 D 联合方案抑制骨吸收治疗,经治后患者症状缓解,病灶局部骨溶解静止并明显骨化,提示该药物方案不仅可抑制病灶骨吸收,还具有局部成骨的作用。其中二膦酸盐的作用机制可能包括以下几点:(1) 促进骨保护素的表达、降低巨噬细胞集落刺激因子的水平,从而抑制破骨细胞的生成;(2) 通过抑制甲羟戊酸生物合成途径的关键酶-法呢基焦磷酸合酶 (farnesyl pyrophosphate synthase) 的活性影响破骨作用;(3) 二磷酸盐的 AppCp 类型代谢物与细胞毒性有关,可促进破骨细胞凋亡;(4) 通过诱导糖皮质激素的代谢以及依赖联接蛋白 43 通道的开放发挥抗骨细胞及成骨细胞凋亡作用等[28]。钙剂、维生素 D 则可为成骨活动提供原料。有文献报道单独应用二磷酸盐后临床症状缓解[29],而单独应用钙剂和维生素 D 治疗后病变静止[15],但两者病灶均无骨化。因此,本病例采取的药物治疗方案可能是治疗 MO 较理想的选择,尤其是对于无需功能重建手术的患者。大量的临床研究以明确药物的有效治疗剂量及疗程将是必要的,而开展关于 MO 的多中心临床研究将有助于进一步完善治疗策略。
[1]Seo GS, Dieudonne G, Mooney SA, et al. Unexplained “massive osteolysis of femoral head” (MOFH) after acetabular fracture:occurrence and suggested patho-etiology[J]. Acta Radiol, 2017,58(6):710-718.
[2]Nagashima H, Mizukawa K, Taniguchi M, et al. Cerebrospinal fluid leakage and chiari I malformation with Gorham’s disease of the skull base: A case report[J]. Neurol Neurochir Pol, 2017,51(5):427-431.
[3]Franco-Barrera MJ, Zavala-Cerna MG, Aguilar-Portillo G, et al.Gorham-stout disease: a clinical case report and immunological mechanisms in bone erosion[J]. Clin Rev Allergy Immunol,2017, 52(1):125-132.
[4]Naqvi AA, Joshi SS, Bailey E. An unusual case of disappearing bone disease in the mandible and literature review[J]. J Surg Case Rep, 2017, 2017(2):1-2.
[5]Gulati U, Mohanty S, Dabas J, et al. “Vanishing bone disease”in maxillofacial region: a review and our experience[J].J Maxillofac Oral Surg, 2015, 14(3):548-557.
[6]Garingarao CJ, Sandoval MA. The case of the missing wrist: a probable case of idiopathic osteolysis[J]. BMJ Case Rep, 2013,2013:1-2.
[7]El-Kouba G, De Araujo Santos R, Pilluski PC, et al. Gorhamstout syndrome: phantom bone disease[J]. Rev Bras Ortop,2010, 45(6):618-622.
[8]Jackson J. A boneless arm[J]. Boston Med Surg J, 1938, (18):368-369.
[9]Gorham LW, Stout AP. Massive osteolysis (acute spontaneous absorption of bone, phantom bone, disappearing bone); its relation to hemangiomatosis[J]. J Bone Joint Surg Am, 1955,37-A(5):985-1004.
[10]Johnson PM, Mc CJ. Observations on massive osteolysis; a review of the literature and report of a case[J]. Radiology, 1958,71(1):28-42.
[11]Pn G, Ac D, An P. A rare case of progressive gorham’s disease of right shoulder girdle and cervical spine in a child: 10 year follow-up and a review of literature[J]. J Orthop Case Rep,2015, 5(4):30-33.
[12]Nikolaou VS, Chytas D, Korres D, et al. Vanishing bone disease (gorham-stout syndrome): A review of a rare entity[J].World J Orthop, 2014, 5(5):694-698.
[13]Ruggieri P, Montalti M, Angelini A, et al. Gorham-Stout disease: the experience of the rizzoli institute and review of the literature[J]. Skeletal Radiol, 2011, 40(11):1391-1397.
[14]Kai B, Ryan A, Munk PL, et al. Gorham disease of bone: three cases and review of radiological features[J]. Clin Radiol, 2006,61(12):1058-1064.
[15]Hu P, Yuan XG, Hu XY, et al. Gorham-stout syndrome in mainland China: a case series of 67 patients and review of the literature[J]. J Zhejiang Univ Sci B, 2013, 14(8):729-735.
[16]Okafuji T, Yabuuchi H, Soeda H, et al. Gorham’s disease of the chest wall: CT and MR characteristics[J]. J Thorac Imaging,2005, 20(4):284-287.
[17]Hagendoorn J1, Padera TP, Yock TI, et al. Platelet-derived growth factor receptor-beta in Gorham's disease[J]. Nat Clin Pract Oncol, 2006, 3(12):693-697.
[18]Yoo SY, Hong SH, Chung HW, et al. MRI of gorham’s disease:findings in two cases[J]. Skeletal Radiol, 2002, 31(5):301-306.
[19]Binder H, Weber PC, Siess W. Separation of inositol phosphates and glycerophosphoinositol phosphates by high-performance liquid chromatography[J]. Anal Biochem, 1985, 148(1):220-227.
[20]Heffez L, Doku HC, Carter BL, et al. Perspectives on massive osteolysis. Report of a case and review of the literature[J]. Oral Surg Oral Med Oral Pathol, 1983, 55(4):331-343.
[21]Hagendoorn J, Padera TP, Yock TI, et al. Platelet-derived growth factor receptor-beta in Gorham’s disease[J]. Nat Clin Pract Oncol, 2006, 3(12):693-697.
[22]Brodszki N, Lansberg JK, Dictor M, et al. A novel treatment approach for paediatric Gorham-stout syndrome with chylothorax[J]. Acta Paediatr, 2011, 100(11):1448-1453.
[23]Situma M, Alexander A, Weiselthaler N, et al. An aggressive lymphatic malformation (Gorham’s disease) leading to death of a child[J]. J Pediatr Surg, 2013, 48(1):239-242.
[24]Choi BS, Hong SJ, Chu MA, et al. Gastrointestinal tract involvement of Gorham’s disease with expression of D2-40 in duodenum[J]. Pediatr Gastroenterol Hepatol Nutr, 2014,17(1):52-56.
[25]Browne JA, Shives TC, Trousdale RT. Thirty-year follow-up of patient with Gorham disease (massive osteolysis) treated with hip arthroplasty[J]. J Arthroplasty, 2011, 26(2):7-10.
[26]Fontanesi J. Radiation therapy in the treatment of Gorham disease[J]. J Pediatr Hematol Oncol, 2003, 25(10):816-817.
[27]Seegenschmiedt MH, Micke O, Niewald M, et al. DEGRO guidelines for the radiotherapy of non-malignant disorders: part III: hyperproliferative disorders[J]. Strahlenther Onkol, 2015,191(7):541-548.
[28]王鑫, 徐小龙. 双膦酸盐的分子生物学机制及临床应用进展[J]. 中华关节外科杂志 (电子版), 2015, (1):120-122.
[29]廖锋, 刘巍峰, 牛晓辉. 骨自溶症 210 例文献病例分析[J]. 中国骨与关节杂志, 2016, 5(9):674-689.
