多壁碳纳米管QuEChERS-气相色谱法测定茶叶中23 种有机磷农药残留量
2018-03-20黄田田董晓倩刘松南许雯雯
黄田田,汤 桦,董晓倩,刘松南,*,许雯雯,王 华,宗 琦
(1.北京食品科学研究院,北京市茶叶质量监督检验站,北京 100162;2.中国计量科学研究院,北京 100029)
茶叶生长过程中易受到假眼小绿叶蝉、茶刺蛾、茶橙瘿螨等病虫害的污染,杂草也会吸收肥料和水分影响茶树的正常生长,茶农最常用的方法就是喷洒农药。近年来农药滥用、过量使用的现象却屡见不鲜[1],已经影响到茶叶的品质和安全问题。
我国2017年6月18日起实施的GB 2763—2016《食品中农药最大残留限量》中对茶叶中48 种农药残留制定了限量要求,相比GB 2763—2014版增加了20 种,其中有13 种是有机磷农药。目前国内外对于有机磷的前处理方法主要有固相萃取法[2-3]、液液萃取法[4]、QuEChERS(quick, easy, cheap, effective, rugged, safe)法[5-6]等,检测手段主要有气相色谱法[7-8]、气相色谱-质谱联用法[9-10]、液相色谱-串联质谱[11-12]法。
QuEChERS方法由Anastassisdes等[13]于2003年首次提出。十五年来,由于其快速、简单、经济、高效等优点已经广泛应用于各类食品中有机磷类农药残留的检测。在提取溶剂方面,目前已经发表的QuEChERS方法中绝大多数都采用乙腈作为提取溶剂[5,8,12],在进行气相色谱-质谱检测时还需要进行溶剂换相处理,以满足色谱柱的要求[14],这样不仅增加前处理的工作量和时间,也会引入新的随机误差和系统误差,还可能导致某些农药组分在前处理过程中发生分解[15]。在使用的净化剂方面,主要为石墨化炭黑(graphitized carbon black,GCB)、N-丙基乙二胺(N-propyl ethylenediamine,PSA)、十八烷基硅胶键合相(C18)[16-17],仅有少量文献中用到了多壁碳纳米管(multi walled carbon nanotubes,MWCNTs)等新材料[18-19]。本实验结合新兴的吸附材料MWCNTs,开发出了一种全程只使用丙酮一种溶剂的前处理方法。样品用丙酮提取,提取液经QuEChERS法净化后可直接进行气相色谱-火焰光度检测器检测,全部前处理过程不需要进行溶剂换相和浓缩操作。结果表明,本方法具有简便、快速、准确、成本低等优点,适用于茶叶中多种有机磷残留快速定量检测。
1 材料与方法
1.1 材料与试剂
茶叶 市购。
敌敌畏、甲胺磷、速灭磷、灭线磷、甲拌磷、氧乐果、乙嘧硫磷、巴胺磷、稻瘟净、久效磷、特丁硫磷、皮蝇磷、甲基嘧啶磷、毒死蜱、甲基对硫磷、倍硫磷、杀螟硫磷、对硫磷、喹硫磷、杀扑磷、克线磷、乙硫磷、三唑磷标准物质(100 µg/mL)北京海岸鸿蒙标准物质技术有限责任公司;丙酮(色谱纯) 美国Thermo Fisher公司;氯化钠、无水硫酸镁(均为分析纯) 天津大茂化学试剂厂;PSA净化剂(40~60 µm)、MWCNTs净化剂(10~20 nm)、GCB净化剂(120~400 目)、C18净化剂(50 µm) 天津博纳艾杰尔公司。
1.2 仪器与设备
6890气相色谱仪(配有火焰光度检测器) 美国安捷伦公司;AEL 200分析天平(感量0.1 mg) 日本岛津公司;JJ 500电子天平(感量0.01 g) 常熟双杰测试仪器厂;KDC-140 HR离心机(配有2 mL和8 mL转头) 安徽中科中佳公司;MVS-1涡旋混匀器北京金紫光公司。
1.3 方法
1.3.1 标准溶液的配制
空白基质溶液:称取空白茶叶样品经提取、净化后,取上清液置于4 ℃冰箱保存。
标准储备液:将1.00 mL 100 µg/mL的各标准溶液转移到50 mL的容量瓶中,用丙酮定容,配制成质量浓度均为2.00 µg/mL的标准储备液,置于4 ℃冰箱保存。
基质标准储备液:将0.10 mL 100 µg/mL的各标准溶液转移到10 mL的容量瓶中,用空白基质溶液定容,配制成质量浓度均为1.00 µg/mL的基质标准储备液,置于4 ℃冰箱保存。
标准工作液:将0.10 mL 100 µg/mL的各标准溶液转移到50 mL的容量瓶中,用丙酮定容,配制成质量浓度均为0.20 µg/mL的标准工作液,使用前配制。
基质标准工作液:分别移取0.10、0.25、0.50、1.00、2.50、5.00 mL的基质标准储备液于5 mL的容量瓶中,用空白基质溶液定容,配制成质量浓度分别为0.02、0.05、0.10、0.20、0.50、1.00 µg/mL的系列基质标准工作液,使用前配制。
1.3.2 提取
称取混匀后的茶叶样品200 g,经粉碎机粉碎,过80 目筛,装袋避光冷冻保存,备用。
称取上述茶叶粉末2.50 g于50 mL离心管中,0.50 g氯化钠、10.0 mL丙酮充分混匀,涡旋振荡1 min,浸提10 min,再次涡旋振荡1 min,于2 000 r/min离心5 min,收集上清液,待净化。
1.3.3 净化
取1.3.2节中上清液1.50 mL于2 mL净化管(60 mg PSA、80 mg GCB、230 mg无水硫酸镁或60 mg PSA、70 mg MWCNTs、230 mg无水硫酸镁)中,涡旋振荡1 min,10 000 r/min离心5 min。取净化液经0.45 µm有机微孔滤膜过滤,上机测定。
1.3.4 色谱条件
色谱柱:DB-1701石英毛细管柱(30 m×0.32 mm,0.25 µm);火焰光度检测器温度245 ℃;升温程序:100 ℃保持2 min,以15 ℃/min升至240 ℃,保持10 min;载气(N2)流速30.0 mL/min;氢气(H2)流速75.0 mL/min;空气流速95.0 mL/min;进样体积1 µL,不分流进样。
2 结果与分析
2.1 提取溶剂的选择
农药残留量检测中常用的提取溶剂为乙腈、乙酸乙酯、正己烷、丙酮等。用乙腈提取时,茶叶提取液中的干扰组分最少[20],因此QuEChERS方法普遍采用乙腈作为提取溶剂。乙腈极性较强,不能很好地与DB-1701石英毛细管柱固定相润湿,从而导致农药组分发生分裂,造成定量结果不准确[21]。同时乙腈提取后直接进样对色谱柱的损害较大,多次进样后,色谱峰发生不可逆拖尾,因此用乙腈提取时往往需要借助旋转蒸发仪换相,氮吹浓缩后才能上机检测。有机磷类农药大多稳定性差、易在前处理过程中分解。因此,本实验选择丙酮作为提取溶剂,不仅避免了农药组分在浓缩、换相中的损失,更简化了实验步骤,也避免了浓缩、换相过程中由于实验人员的操作而引起的损失。
2.2 基质效应
采用QuEChERS方法前处理,气相色谱法分析样品中的农药残留存在基质效应[22-25],对质量浓度均为0.20 µg/mL的标准工作液和基质标准工作液进行对比,结果见图1。
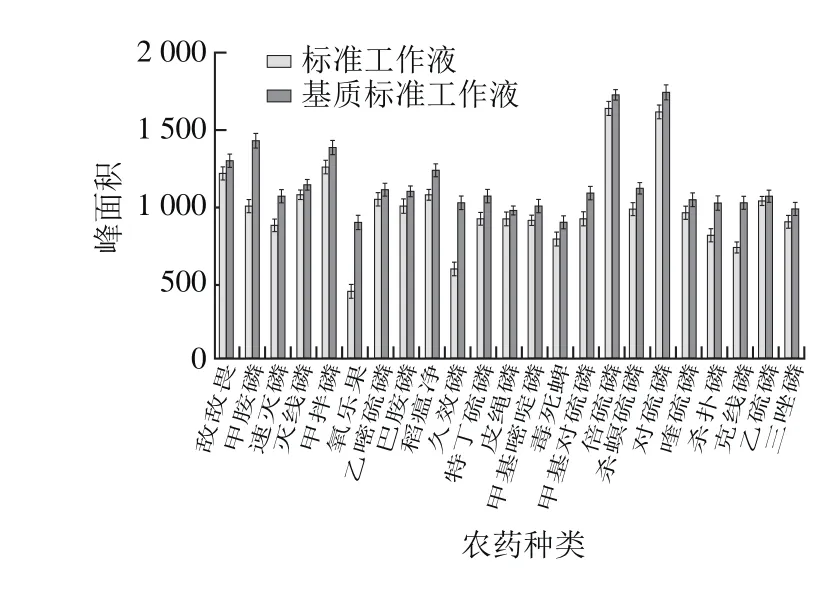
图1 23 种有机磷农药在茶叶中的基质效应Fig. 1 Matrix effects of 23 organophosphorus pesticides in tea
由图1可知,23 种有机磷农药均存在基质增强效应,氧乐果和久效磷的基质标准工作液的峰面积均明显高于标准工作液的峰面积。因此,在使用外标法定量时,应采用空白样品的净化液稀释标样,以消除基质的干扰,减少误差。
2.3 净化剂种类及用量的选择
茶叶中含有大量的色素、生物碱、甾醇、多酚类、水分等干扰物质。其中水分会影响检测器的正常检测并会对色谱柱的固定相造成化学损伤;茶多酚类物质是茶叶中的最主要干扰成分;叶绿素是茶叶中最直接可见的色素类干扰成分。参考美国官方分析方法AOAC 2007.1[14],每毫升提取液中加入0.15 g的无水硫酸镁,用于去除提取液中的水分,因此本研究在净化剂中加入了230 mg无水硫酸镁。本实验以茶多酚和色素含量最高的绿茶作为样品,对比了PSA、C18、GCB、MWCNTs 4 种净化剂对提取液中茶多酚和叶绿素的净化能力,从而确定了净化剂种类及用量;采用单因素试验,通过分析23 种农药的回收率确定净化剂的最佳用量。
2.3.1 PSA、C18、GCB、MWCNTs对茶多酚、色素的净化能力
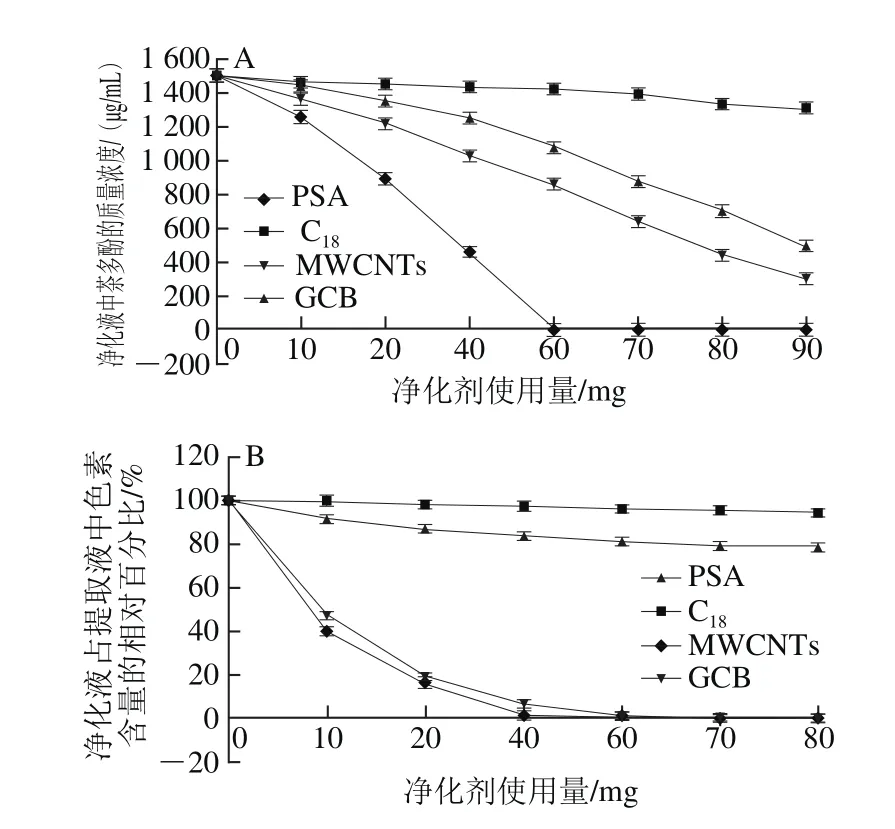
图2 不同净化剂对茶多酚(A)和色素(B)净化能力的比较Fig. 2 Comparison of purification efficiencies of tea polyphenols (A)and pigment (B) with different adsorbents
茶多酚含量的检测方法参照GB/T 8313—2008《茶叶中茶多酚和儿茶素类含量的检测方法》中方法二。经过检测和计算,按照1.3.2节方法提取所得提取液中茶多酚质量浓度为1 500 µg/mL,各取1.50 mL提取液,分别加入0、10、20、40、60、70、80 mg和90 mg的PSA、C18、GCB、MWCNTs进行净化,并测定净化液中的茶多酚质量浓度,结果见图2A。同一用量条件下,对茶多酚类物质的净化能力为PSA>MWCNTs>GCB>C18。其中PSA使用量为60 mg时,净化液中茶多酚类物质含量降到最低。PSA是弱阴离子交换净化剂,可强烈的吸附提取液中带有氢键的基质共萃物,保留提取液中的酸性基团[26-28],对多酚类物质的去除能力较强。因此实验选择PSA来除去茶叶中的茶多酚类物质,使用量至少为60 mg/1.50 mL。
色素含量的检测方法参照GB/T 22182—2008《油菜籽叶绿素含量测定 分光光度计法》。按照1.3.2节方法对样品进行提取,各取1.50 mL提取液分别加入0、10、20、40、60、70、80 mg的PSA、C18、GCB、MWCNTs 4 种不同的净化剂进行净化,结果见图2B。对色素的净化能力MWCNTs>GCB>PSA>C18。其中MWCNTs用量为70 mg时,茶叶中色素被完全除去;GCB用量为80 mg时,茶叶中色素含量降到最低。GCB是具有多环平面结构的大分子物质,MWCNTs是一种由单层或多层石墨片层卷曲而成的空心柱状碳纳米材料,MWCNTs与GCB相比有更大的比表面积,因此吸附色素能力更强[29-31]。可选择MWCNTs或GCB来除去茶叶中的色素,MWCNTs用量至少为70 mg/1.50 mL,GCB用量至少为80 mg/1.50 mL。
2.3.2 GCB和MWCNTs对回收率的影响

图3 GCB和MWCNTs对回收率的影响Fig. 3 Effects of GCB and MWCNTs on recovery
净化剂在去除杂质的同时,也会对农药产生一定吸附,不同的净化剂吸附农药的能力不同。称取2.50 g空白茶叶样品,加入1.00 mL的标准储备液,按照1.3.2节方法提取。各取1.50 mL提取液,分别使用含GCB的净化剂(60 mg PSA、80 mg GCB、230 mg无水硫酸镁)和含MWCNTs的净化剂(60 mg PSA、70 mg MWCNTs、230 mg无水硫酸镁)净化,结果见图3。GCB作为净化剂时23 种有机磷的回收率均低于MWCNTs,且使用GCB作为净化剂时,皮蝇磷、毒死蜱、喹硫磷、杀扑磷、克线磷5 种农药的回收率均低于80%。其原因可能是GCB的多环平面结构对平面结构的农药有一定的吸附作用,导致平面结构农药的回收率偏低[32],MWCNTs的空心柱状结构对农药的吸附作用很小[33],MWCNTs的回收率较好。因此,本实验选择MWCNTs作为净化剂。
2.3.3 PSA、MWCNTs使用量的优化
依据2.3.1、2.3.2节所得结论,本实验选择PSA、MWCNTs 2 种净化剂净化提取液。PSA主要用于去除茶多酚类物质、MWCNTs主要用于去除色素类物质,采用单因素试验分析23 种农药的回收率。
2.3.3.1 不同PSA用量对回收率的影响
样品按1.3.2节方法提取,分别用60、130、200 mg PSA净化提取液,MWCNTs用量均为70 mg,无水硫酸镁用量均为230 mg,回收率结果见图4。当PSA用量从60 mg增加到200 mg时,23 种有机磷农药的回收率均大于80%,且随着PSA用量增大,回收率逐渐降低,但降幅较小。PSA的适宜用量为60~200 mg之间,当PSA用量为60 mg时回收率最高。因此,本实验选择PSA的用量为60 mg/1.50 mL。

图4 不同PSA用量对回收率的影响Fig. 4 Effect of different amounts of PSA on recovery
2.3.3.2 不同MWCNTs用量对回收率的影响
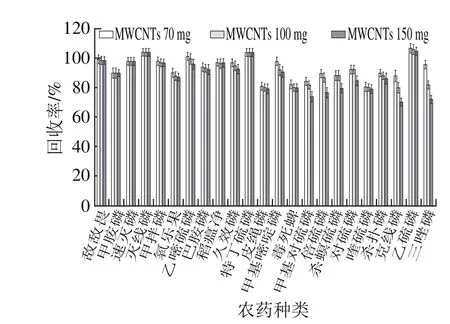
图5 不同用量MWCNTs对回收率的影响Fig. 5 Effect of different amounts of MWCNTs on recovery
样品按1.3.2节方法提取,分别用70、100、150 mg MWCNTs净化提取液,PSA用量均为60 mg,无水硫酸镁用量均为230 mg,回收率结果见图5。MWCNTs用量从70 mg增加到100 mg时,23 种有机磷农药的回收率均大于80%,MWCNTs的用量增加到150 mg时,甲基对硫磷、倍硫磷、喹硫磷、克线磷、三唑磷的回收率小于80%。MWCNTs的适宜选择用量为70~100 mg之间。MWCNTs用量为70 mg时回收率最高。因此,本实验选择MWCNTs的用量为70 mg/1.50 mL。
由上可知,优化得出最佳净化剂配比为:PSA 60 mg/1.50 mL、MWCNTs 70 mg/1.50 mL,无水硫酸镁230 mg/1.50 mL。
2.4 线性范围、检出限、定量限、回收率和精密度结果
以1.3.1节的方法,配制质量浓度为0.02、0.05、0.10、0.20、0.50、1.00 µg/mL的系列基质标准工作液,以质量浓度为横坐标,峰面积为纵坐标,绘制标准曲线,同时以3 倍噪音为检出限,10 倍噪音为定量限。
称取空白的茶叶样品,分别添加0.05、0.50、1.00 mg/kg的有机磷农药,经1.3.2节方法提取,净化剂(PSA 60 mg、MWCNTs 70 mg、230 mg无水硫酸镁)净化,气相色谱-火焰光度检测器检测,每个添加量做5 个平行,测定本方法的回收率,结果见表1。本方法的空白样品、定量限质量浓度加标样品及标准溶液的色谱图见图6。
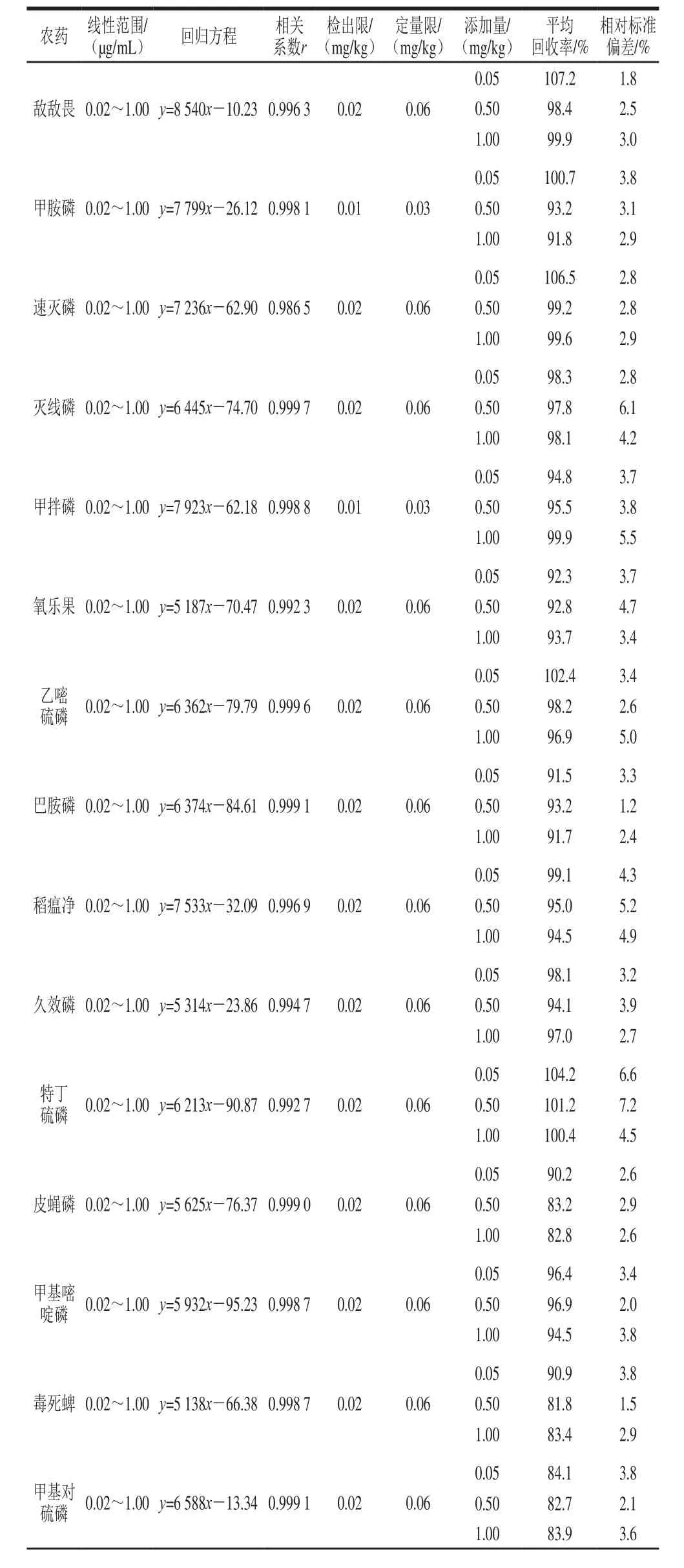
表1 23 种有机磷农药的标准曲线、线性范围、相关系数、检出限、定量限、回收率和精密度Table 1 Linear equations, linear ranges, correlation coefficients, LODs,LOQs, recoveries and precisions for 23 organophosphorus pesticides
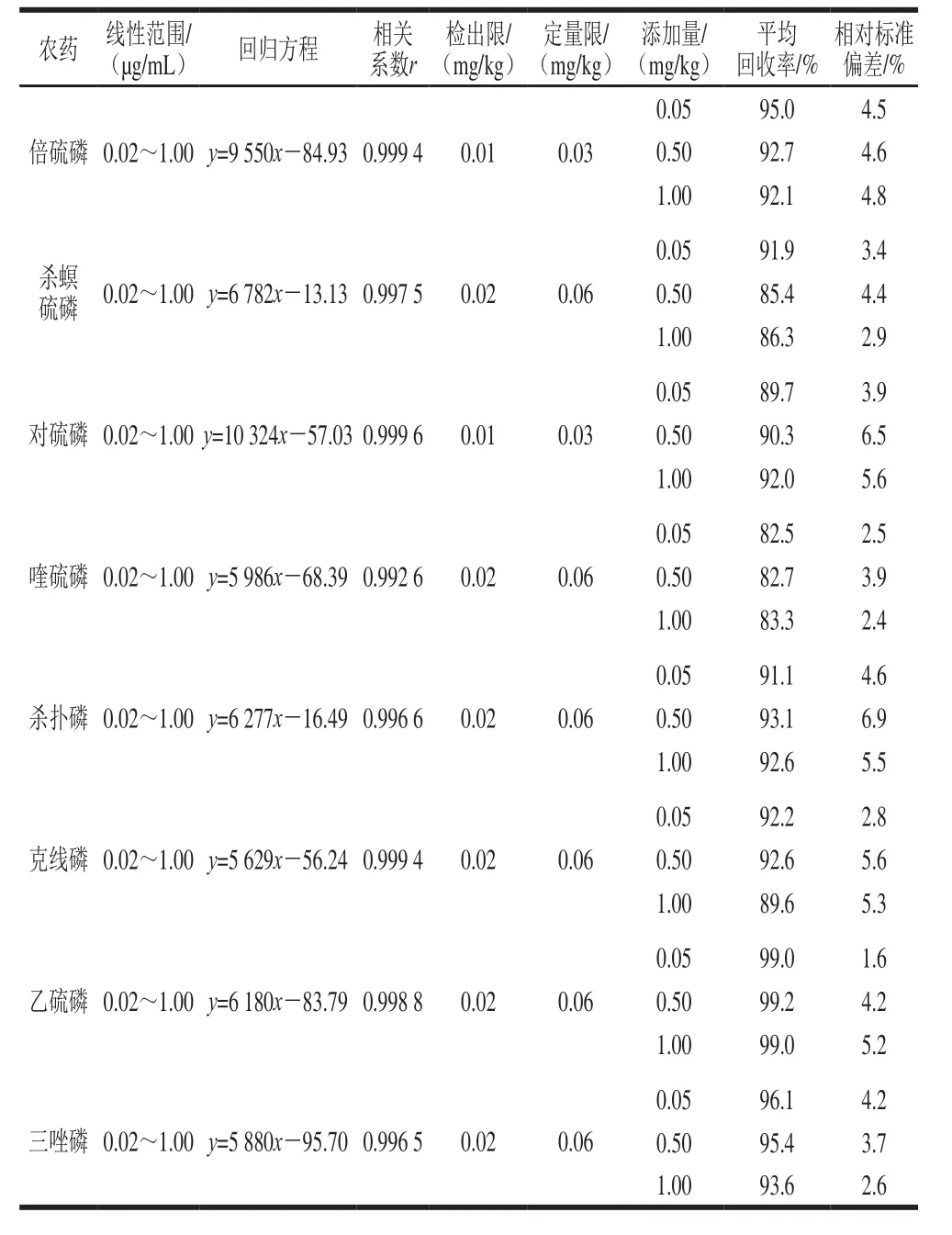
续表1
如表1所示,23 种有机磷农药在0.02~1.00 µg/mL范围内线性良好,r均大于0.986 5,甲胺磷、甲拌磷、倍硫磷、对硫磷的检出限为0.01 mg/kg,其他农药检出限均为0.02 mg/kg;甲胺磷、甲拌磷、倍硫磷、对硫磷的定量限为0.03 mg/kg,其他农药定量限均为0.06 mg/kg;平均加标回收率在81.8%~107.2%之间;相对标准偏差在1.2%~7.2%之间,加标回收和精密度均符合GB/T 27404—2008《实验室质量控制规范 食品理化检测》的要求[34]。
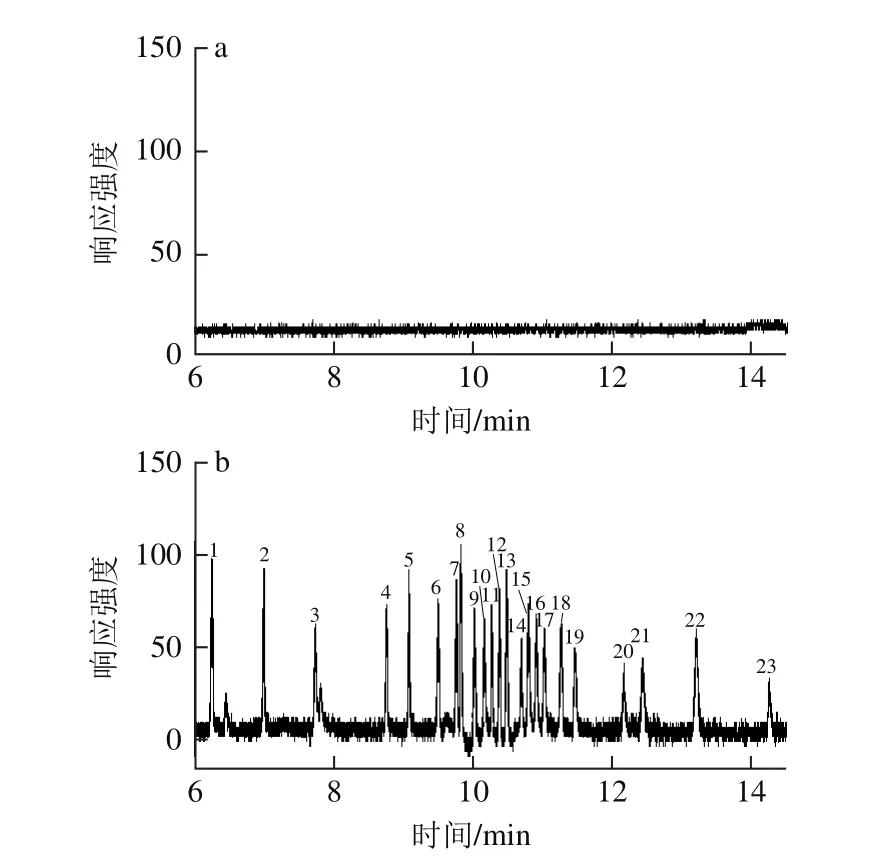

图6 空白样品、定量限质量浓度加标样品、标准溶液色谱图Fig. 6 Chromatograms of blank sample, sample spiked at LOQ level and standard solution
2.5 与国家标准方法的结果比较
选择了一款不含有上述23 种农药的茶叶进行单水平加标,加标量均为0.50 mg/kg。分别采用本方法、NY/T 761—2008第1部分方法二、GB/T 5009.20—2003第一法3 种方法进行检测,检测结果见表2,本实验方法与2 个国家标准方法的结果相对偏差在0.0%~9.6%之间,小于大多数农药残留标准中相对标准偏差(<15%)的精密度要求。
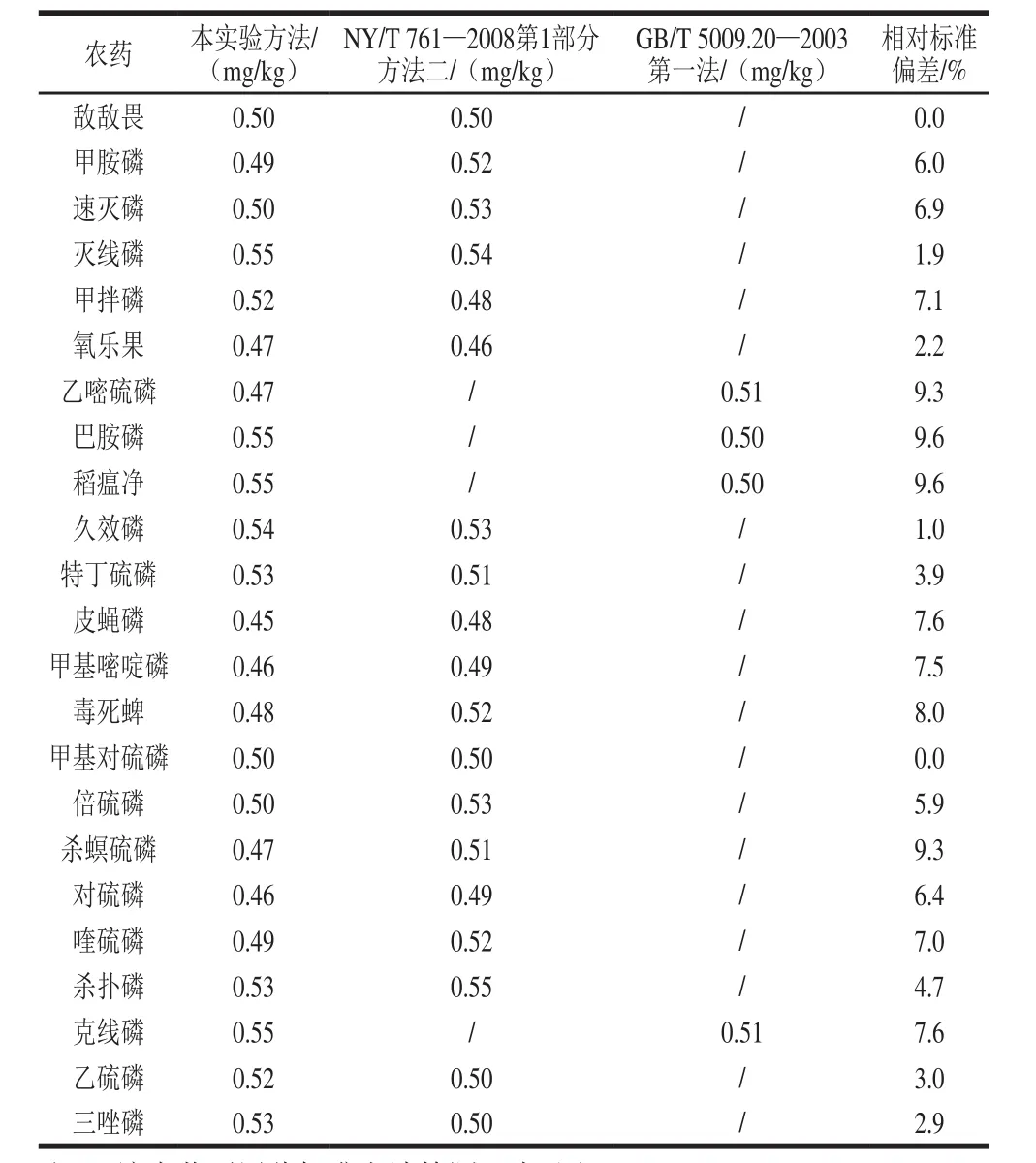
表2 3 种方法加标回收实验的比较Table 2 Comparison of three methods in terms of recovery
同时含有23 种农药的茶叶样品较少,本实验挑选出1 个含有敌敌畏、克线磷的茶叶样品对3 种方法进行对比分析。分别采用本方法、NY/T 761—2008第1部分方法二、GB/T 5009.20—2003第一法3 种方法进行检测,采用F检验的方法考察本方法和另外2 种国家标准方法的差异性。检测结果见表3、4。

表3 3 种方法的检测结果Table 3 Comparative detection of dichlorvos and phenamiphos by the developed method and national and industrial standards mg/kg

表4 敌敌畏和克线磷的方差分析Table 4 Analysis of variance (ANOVA) of dichlorvos and fenamiphos
对2 组数据分别做F检验,表4中F值小于F0.05(1,5),方差结果表明F值在0.05的水平上不显著。即对于含有敌敌畏和克线磷的样品,本实验方法与其他2 个国家标准方法检测结果无显著性差异。
2.6 实际样品的检测
采用本方法对11 个样品中的23 种农药进行检测,样品包括绿茶2 个、红茶1 个、乌龙茶1 个、白茶2 个、黑茶1 个、黄茶2 个和茉莉花茶2 个。有3 个样品中检出农药残留,检出的农药为红茶中杀螟硫磷含量为0.081 mg/kg、乌龙茶中敌敌畏含量为0.11 mg/kg、黑茶中毒死蜱含量为0.17 mg/kg。
3 结 论
本实验采用丙酮作为提取溶剂,经PSA、MWCNTs、无水硫酸镁混合净化剂净化,气相色谱-火焰光度检测器检测,建立了测定茶叶中23 种有机磷农药的分析方法,方法的检出限在0.01~0.02 mg/kg之间,定量限在0.03~0.06 mg/kg之间。方法的回收率、精密度满足GB/T 27404—2008《实验室质量控制规范 食品理化检测》的要求。本方法与传统的QuEChERS法相比,采用MWCNTs替换了GCB,提高了回收率,同时直接使用丙酮为提取溶剂,避免了前处理过程中的溶剂换相操作,进一步简化了实验过程。本方法操作简便、快速、准确可靠,可以用做茶叶中多种有机磷农药残留量的检测方法。
[1] 新华社. 福建抽检发现28 批次食品不合格[J]. 标准生活, 2017(4):12. DOI:10.3969/j.issn.1674-5701.2017.04.009.
[2] SAITO-SHIDA S, NEMOTO S, TESHIMA R. Multiresidue determination of pesticides in tea by gas chromatography-tandem mass spectrometry[J]. Journal of Environmental Science & Health Part B,2015, 50(11): 760-776. DOI:10.1080/03601234.2015.1058092.
[3] HAYWARD D G, WONG J W, PARK H Y. Determinations for pesticides on Black, Green, Oolong, and White teas by gas chromatography triple-quadrupole mass spectrometry[J]. Journal of Agricultural & Food Chemistry, 2015, 63(37): 8116-8124.DOI:10.1021/acs.jafc.5b02860.
[4] 蒋露, 梅文泉, 绍金良, 等. 液液萃取-固相萃取气相色谱法测定火腿中有机磷农药残留量[J]. 安徽农业科学, 2017, 45(13): 92-95.DOI:10.3969/j.issn.0517-6611.2017.13.028.
[5] 张媛媛, 张卓, 陈忠正, 等. QuEChERS方法在茶叶农药残留检测中的应用研究进展[J]. 食品安全质量检测学报, 2014(9): 2711-2716.
[6] 宋碧君, 魏荣. 应用QuEChERS快速前处理检测茶叶中农药残留方法的研究[J]. 现代食品, 2017, 2(4): 95-99. DOI:10.16736/j.cnki.cn41-1434/ts.2017.04.037.
[7] 杜艳, 马萍, 张建玲. 气质联用法同时测定青稞中11 种有机磷农药[J]. 粮油食品科技, 2017, 25(1): 48-50. DOI:10.16210/j.cnki.1007-7561.2017.01.011.
[8] 黄芬, 夏文斌, 李雄伟, 等. 蔬菜中多种有机磷农药残留的固相萃取-气相色谱测定方法研究[J]. 实用预防医学, 2017, 24(5): 627-629.DOI:10.3969/j.issn.1006-3110.2017.05.034.
[9] SURMA M K, SADOWSKA-ROCIEK A B, CIESLIK E J.Evaluation of the QuEChERS method with GC-MS detection for the determination of organochlorine pesticides in food of animal origin[J].Food Analytical Methods, 2014, 7(2): 366-376. DOI:10.1007/s12161-013-9635-3.
[10] DENG X, GUO Q, CHEN X, et al. Rapid and effective sample clean-up based on magnetic multiwalled carbon nanotubes for the determination of pesticide residues in tea by gas chromatographymass spectrometry[J]. Food Chemistry, 2014, 145(7): 853-858.DOI:10.1016/j.foodchem.2013.08.137.
[11] SHARAFI K, FATTAHI N, MAHVI A H, et al. Trace analysis of some organophosphorus pesticides in rice samples using ultrasoundassisted dispersive liquid-liquid microextraction and high-performance liquid chromatography[J]. Journal of Separation Science, 2015, 38(6):1010-1016. DOI:10.1002/jssc.201401209.
[12] 粟有志, 冯峰, 刘翠平, 等. QuEChERS-液相色谱-串联质谱法测定植物源食品中氟噻草胺和乙酰甲草胺残留[J]. 分析实验室, 2017,36(1): 81-86.
[13] ANASTASSIADES M, LEHOTAY S J, STAJNBAHER D, et al.Fast and easy multiresidue method employing acetonitrile extraction/partitioning and “dispersive solid-phase extraction” for the determination of pesticide residues in produce[J]. Journal of AOAC International, 2003, 86(2): 412-432.
[14] LEHOTAY S J. Determination of pesticide residues in foods by acetonitrile extraction and partitioning with magnesium sulfate[J].Journal of AOAC International, 2007, 90(2): 485-520.
[15] 董晓倩, 刘松南, 刘蕊, 等. QuEChERS-液相色谱-串联质谱法测定茶叶中的丁醚脲[J]. 食品科学, 2017, 38(8): 244-250. DOI:10.7506/spkx1002-6630-201708038.
[16] 王建华, 葛敏敏, 张慧丽, 等. QuEChERS法-液相色谱-串联质谱法测定蔬菜中7 种农药及其代谢物的残留量[J]. 食品科学, 2017,38(20): 235-241. DOI:10.7506/spkx1002-6630-201720034.
[17] 郭保宝, 石志格, 刘胜男, 等. QuEChERS/HPLC-MS/MS法同时测定果蔬中17 种农药残留[J]. 安徽农业科学, 2017, 45(26): 87-92.DOI:10.3969/j.issn.0517-6611.2017.26.027.
[18] 帖金鑫, 余斐, 廖付, 等. 多壁碳纳米管在农药残留检测中的应用进展[J]. 农产品加工, 2017(4): 61-65. DOI:10.16693/j.cnki.1671-9646(X).2017.04.045.
[19] 张帆, 李忠海, 黄媛媛, 等. 改良QuEChERS-气相色谱法测定茶油中有机磷类农药残留[J]. 食品与机械, 2013, 29(5): 87-90.DOI:10.3969/j.issn.1003-5788.2013.05.024.
[20] XIE Y L, ZHAO Z D, ZHANG L L, et al. Simultaneous analysis of herbicide metribuzin and its transformation products in tomato using QuEChERS-based gas chromatography coupled to a triple quadrupole mass analyzer[J]. Microchemical Journal, 2017, 133: 468-473.DOI:10.1016/j.microc.2017.04.025.
[21] 潘守奇, 孙军, 董静, 等. QuEChERS/GC测定蔬菜中24 种有机磷农药残留[J]. 中国测试, 2010, 36(3): 53-56.
[22] 黄宝勇, 欧阳喜辉, 潘灿平. 色谱法测定农产品中农药残留时的基质效应[J]. 农药学学报, 2005, 7(4): 299-305. DOI:10.3321/j.issn:1008-7303.2005.04.002.
[23] 李红艳. 基质效应对气相色谱仪在农残检测中的影响[J]. 现代农业科技, 2016(16): 113. DOI:10.3969/j.issn.1007-5739.2016.16.066.
[24] 段俊彦. 茶叶中有机磷类农药多残留测定时的基质效应研究[D].北京: 中国农业科学院, 2009: 13-15.
[25] 陈丽. 气相色谱法测定茶叶中有机磷农药残留基质效应的研究及其控制[D]. 杭州: 浙江工业大学, 2015: 16-35.
[26] LEHOTAY S J, DE K A, HIEMSTRA M. Validation of a fast and easy method for the determination of residues from 229 pesticides in fruits and vegetables using gas and liquid chromatography and mass spectrometric detection[J]. Journal of AOAC International, 2005,88(2): 595-614.
[27] 陈磊, 上官良敏, 付凤富. QuEChERS预处理结合HPLC-MS/MS同时检测茶叶中7 种农药残留[J]. 中国科学: 化学, 2016, 46(3): 302-308.
[28] 吕爱娟, 沈小明, 时磊, 等. 优化QuEChERS结合HPLC测定沉积物中14 种多环芳烃[J]. 中国环境监测, 2017, 33(1): 115-120.DOI:10.19316/j.issn.1002-6002.2017.01.17.
[29] 余斐, 陈黎, 艾丹, 等. 多壁碳纳米管分散固相萃取-LC-MS/MS法分析烟草中114 种农药残留[J]. 烟草科技, 2015, 48(5): 47-56.DOI:10.16135/j.issn1002-0861.20150509.
[30] ZHAO P Y, WANG L, ZHANG F Z, et al. Multi-walled carbon nanotubes as alternative reversed-dispersive solid phase extraction materials in pesticide multi-residue analysis with QuEChERS method[J]. Journal of Chromatography A, 2012, 1225: 17-25.DOI:10.1007/s10337-013-2583-7.
[31] 帖金鑫, 余斐, 廖付, 等. 多壁碳纳米管在农药残留检测中的应用进展[J]. 农产品加工, 2017(8): 61-65. DOI:10.16693/j.cnki.1671-9646(X).2017.04.045.
[32] 万建春, 郭平, 祝建新, 等. 液相色谱-串联质谱法快速测定蔬菜中19种农药残留[J]. 分析科学学报, 2017, 33(1): 116-120. DOI:10.13526/j.issn.1006-6144.2017.01.024.
[33] 张帆, 白珊, 王美玲, 等. MWCNT-分散固相萃取-气相色谱-串联质谱法检测茶油中11 种有机磷农药残留[J]. 湖南师范大学自然科学学报, 2017, 40(2): 49-55. DOI:10.7612/j.issn.1000-2537.2017.02.008.
[34] 国家质量监督检验检疫总局, 国家标准化管理委员会. 实验室质量控制规范 食品理化检测: GB/T 27404—2008[S]. 北京: 中国标准出版社, 2008.
