无症状人群大肠肿瘤发生风险评分系统的构建及验证
2018-03-20崔梅花马文彬
张 琴,崔梅花,马文彬,杨 成
航天中心医院 北京大学航天临床医学院消化科,北京 100049
大肠癌是一种常见的恶性肿瘤,近年来其发病率呈快速增长趋势[1]。大肠肿瘤主要包括大肠癌和大肠腺瘤。大肠腺瘤是结直肠癌最主要的癌前疾病,大部分大肠癌由腺瘤性息肉发展而来,多年来临床研究的间接证据提示,<10 mm的腺瘤倍增时间近10年,1 cm的腺瘤发展为腺癌的时间约为7年,早期癌发展为进展期癌大约需3年[2],这为大肠癌的早期诊断提供了时间保证。而腺瘤性息肉和早期恶性肿瘤常常无症状,早期检出率非常低。大肠癌的发病与生活方式等多种因素密切相关,如果能够利用一些容易获得的信息,如年龄、性别、生活方式、伴随疾病等,对无症状人群的发病风险进行准确预测,然后针对其中发病风险较高的人群再进行结肠镜筛查,这将大大提高筛查的效能,降低人群筛查费用,节约有限的卫生资源。本研究试图构建并验证一种临床评分系统来预测大肠肿瘤发生的风险,指导受试者选择有效的检查方法,从而为大肠肿瘤的预防及早期诊断提供有效的筛查工具。
1 资料与方法
1.1一般资料选取在航天中心医院体检中心行结肠镜健康体检的无症状人群(本研究中仍称其为患者),将其分为无症状人群大肠肿瘤发生风险评分系统的构建组和验证组。构建组为回顾性研究,纳入2011年1月至2015年12月行结肠镜体检的无症状患者;验证组为前瞻性研究,纳入2016年1月至2017年2月行结肠镜体检的无症状患者。纳入标准:(1)年龄40~74岁;(2)无症状体检人群;(3)自愿行结肠镜检查;(4)临床病历完整。排除标准:(1)既往有以下疾病史者:结直肠癌、结直肠息肉、克罗恩病、溃疡性结肠炎、其他部位肿瘤;(2)检查前6个月有缺铁性贫血;(3)检查前6个月粪便潜血阳性;(4)检查前1年内有下消化道出血;(5)6个月内不明原因的体质量减轻5 kg以上;(6)近期排便习惯有显著变化;(7)近期排便有里急后重;(8)近5年内行过钡灌肠检查、乙状结肠镜或全结肠镜检查;(9)有结肠、直肠手术史;(10)其他可以增加结肠镜检查相关风险的疾病(如急性心肌梗死、脑卒中、充血性心力衰竭、房颤);(11)妊娠期妇女。对于预纳入验证组的体检患者,研究之前要确保其符合本课题的入选及排除标准,并签署知情同意书。
1.2研究方法
1.2.1 研究项目:构建组收集每例结肠镜检查结果(病变由活检病理确诊)、调查问卷所有项目的内容,包括:性别、年龄、身高、体质量、大肠癌家族史、吸烟史、饮酒史、既往病史[包括高血压、冠心病、糖尿病、高脂血症、脂肪肝、胆囊切除史、幽门螺杆菌(Helicobacter pylori,H.pylori)感染史、长期阿司匹林用药史、其他肿瘤家族史]。验证组对结肠镜体检者进行详细的风险评分系统项目的问卷调查,并记录电子结肠镜检查及病变活检病理检查结果。
1.2.2 问卷调查的记录标准:(1)人口学特征中,身高、体质量按公式计算出体质量指数(BMI),并按照中国成人的肥胖标准(BMI≥24 kg/m2为超重,BMI≥28 kg/m2为肥胖)将患者分为正常组、超重组及肥胖组。(2)将患者的一级亲属中有一个或多个患有大肠癌者定义为有大肠癌家族史。一级亲属中患有其他肿瘤的患者,定义为存在其他肿瘤家族史。一级亲属包括父母、同胞及子女。(3)将发现一个或多个腺瘤的患者,均定义为有腺瘤患者。肠镜检查未见异常、未检出息肉和病理诊断为增生性息肉及炎性息肉的患者均定义为无腺瘤患者。
1.3统计学处理采用SPSS 24.0统计分析软件进行分析。根据数据性质,在构建组内,连续变量的单因素分析用t检验,二分类变量的单因素分析用χ2检验。单因素分析时筛选变量中P<0.05的危险因素进入下一步多因素分析,多因素分析用Logistic回归分析筛选出预测大肠肿瘤的独立危险因素(P<0.05为选入标准),根据各变量中回归系数β的值四舍五入取整数,转换为相应的得分,总得分等于各变量得分之和。在构建组,依据每例体检者患大肠肿瘤的危险分值,绘制受试者工作特征曲线(receiver operating characteristic curve,ROC),并计算曲线下面积(area under curve,AUC)和95%可信区间(CI)。模型拟合优度采用Hosmer-lemeshow方法检验。根据ROC曲线把参加者患大肠肿瘤的风险划分为平均风险(AR)组和高风险(HR)组。按照患大肠肿瘤的危险分值从小到大排序和分层,确定患大肠肿瘤AR组和HR组的分界值。然后计算大肠肿瘤发生风险评分系统的敏感性及特异性、阳性预测值和阴性预测值,并在验证组中进行验证。所有P值都取双侧,P<0.05为差异有统计学意义。
2 结果
2.1一般情况共有1 200例患者纳入本研究,其中构建组900例,验证组300例。构建组中,男616例(68.4%),女284例(31.6%),年龄40~74岁。肠镜检查发现息肉223例,部分患者为多发息肉,病理类型多样,包括增生性息肉、炎性息肉、高级别上皮内瘤变、不典型增生、腺瘤,其中病理诊断包含腺瘤者147例(16.3%)。构建组中未检出大肠癌,仅有1例为高级别上皮内瘤变(计入腺瘤组)。
2.2单因素分析患者的性别、年龄、吸烟史、BMI、高血压史、糖尿病史、阿司匹林用药史是大肠肿瘤的潜在预测因子(P<0.05,见表1)。
2.3多因素分析多因素Logistic回归分析结果提示,性别、年龄、BMI、吸烟史、糖尿病史是大肠肿瘤的独立危险因子(P<0.05,见表2)。
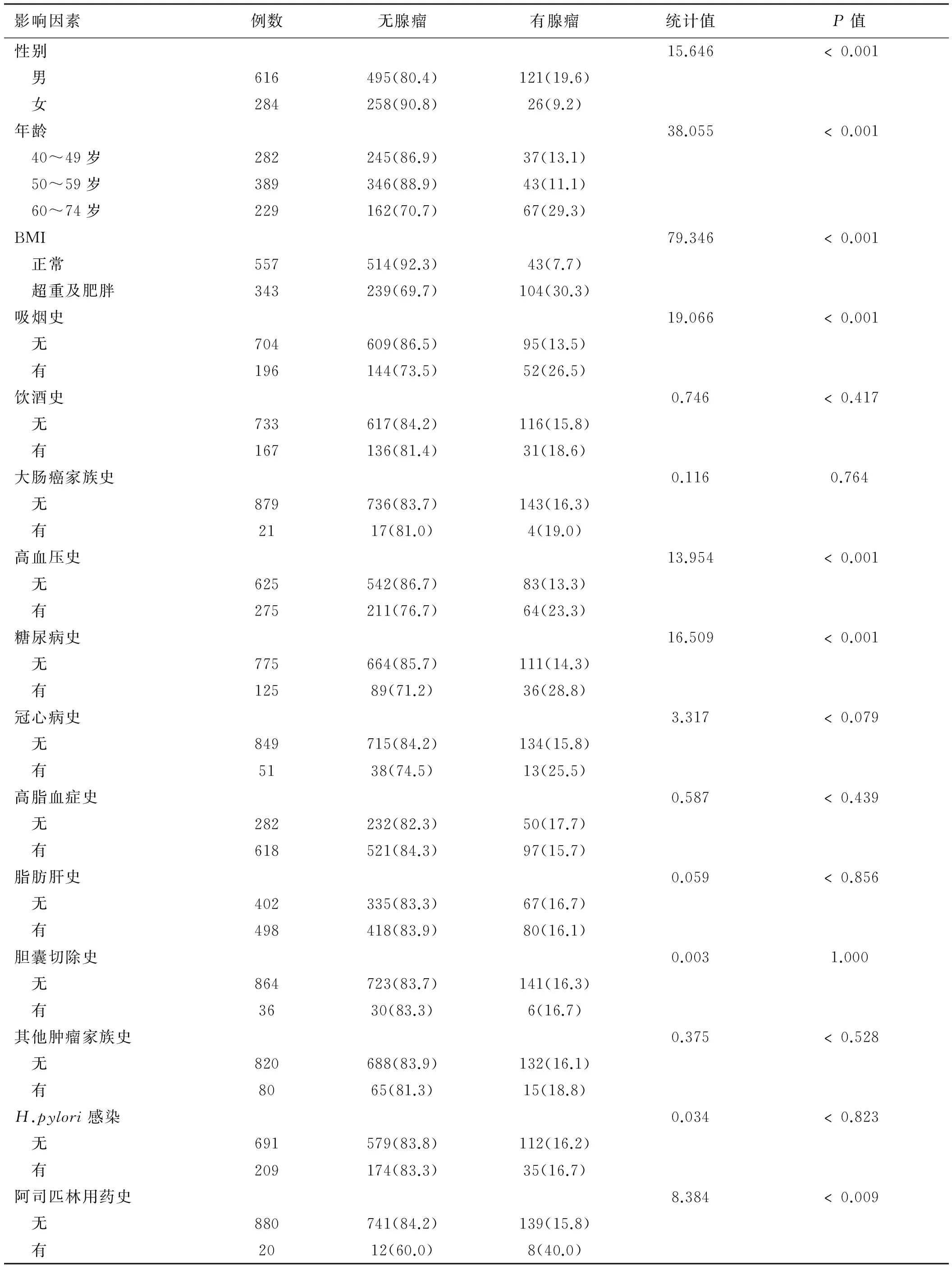
表1 单因素分析结果Tab 1 The results of univariate analysis 比例/%
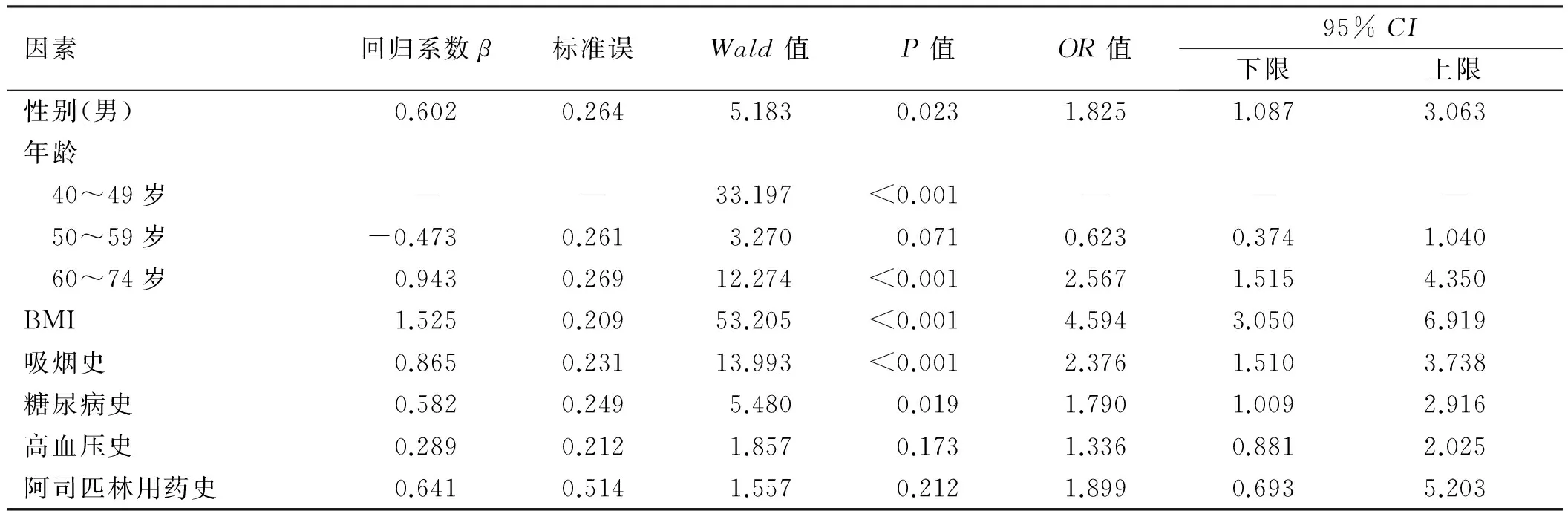
表2 多因素Logistic回归分析结果Tab 2 The results of multivariate Logistic regression analysis
2.4建立评分系统根据各变量中回归系数β的值四舍五入取整数,转换为相应的得分。例如男性的β系数为0.602,四舍五入后,则将其定义为1分。依据各变量的β值建立的评分系统如表3所示。分值范围0~6分。

表3 评分系统Tab 3 The scoring system
依据上述评分系统计算构建组中每个研究对象总得分。构建组人群危险分值的一般情况如表4所示。在构建组中检出腺瘤147例,总的腺瘤检出率为16.3%。从表4可看出,评分结果为2分的腺瘤检出率为11.7%,评分为3分的腺瘤检出率为23.5%,总的检出率在2分及3分的检出率水平之间。因此本研究将0~2分定义为平均风险(AR),≥3分定义为高风险(HR)。
表4构建组人群危险分值的一般情况
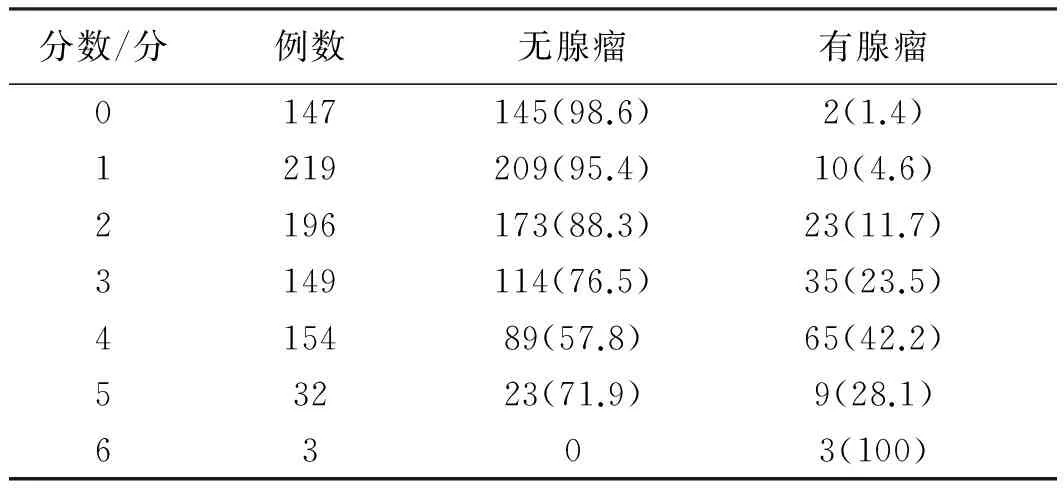
Tab 4 The risk score in the derivation cohort 比例/%
2.5评分系统模型效能评价根据每例体检者患大肠肿瘤的危险分值,绘制大肠肿瘤发生风险评分系统的ROC曲线。曲线下面积为0.783(95%CI:0.746~0.820,P<0.001),说明此评分系统区分度良好。Hosmer-lemeshow拟合优度检验结果显示,Logistic回归模型的拟合优度良好(P=0.647)。当以2分为不同风险的分界值(即分值≥3分被判断为腺瘤患者)时,按照评分系统的判定方法进一步分析试验结果,并计算出相应的敏感度、特异度、阳性预测值、阴性预测值分别为76.1%、69.9%、33.1%、93.7%。
2.6评分系统效能的验证根据构建组建立的评分系统,计算验证组每例患者的相应得分。依据以上划分风险分组的标准,AR组152例,检出腺瘤24例(15.8%);HR组148例,检出腺瘤31例(20.9%)。计算该评分系统的敏感度为56.3%、特异度为52.2%、阳性预测值为20.9%、阴性预测值为84.2%。
3 讨论
大肠肿瘤的发病与多种因素密切相关,遗传因素、环境因素、生活方式、个体差异、疾病状态等都可能参与大肠肿瘤的发生。本研究提示,性别、年龄、吸烟史、BMI、糖尿病史为大肠肿瘤的独立危险因素。
首先,大量的研究显示,性别、年龄与结直肠癌发病有显著相关性。本研究构建组中腺瘤患者男性(616例)远多于女性(284例),腺瘤组的平均年龄也明显高于无腺瘤组。经分析显示,男性及年龄增加均为大肠肿瘤的独立危险因素。另外,在本研究中将年龄分层后分析发现,60~74岁年龄组比40~49岁年龄组大肠肿瘤的风险高(OR=2.567),而50~59岁年龄组与40~49岁年龄组相比,差异无统计学意义,提示老年人仍是大肠肿瘤高危人群。有调查显示,我国年龄≥50岁人群的大肠肿瘤发病率呈逐年上升趋势,75~80岁人群的发病率最高,然后呈缓慢下降趋势,考虑到对于高龄人群的筛查无明显生存获益,结合国情,我国建议将人群筛查年龄定位在50~74岁,对于高风险人群于40岁开始也可考虑行大肠癌筛查[3]。其次,国内外研究[4-5]均显示,肥胖是发生大肠肿瘤的高危因素。一项随访6年的前瞻性研究(n=368 277)显示,与BMI正常者相比,超重者发生结肠癌的危险度达1.2倍,肥胖患者发生结肠癌的危险度高达1.64倍,提示BMI值越高,发生结肠癌的风险越大[6]。本研究构建组中,BMI正常者腺瘤检出率7.7%,超重及肥胖组腺瘤检出率明显升高,达30.3%,同时经多因素分析显示,BMI为大肠肿瘤发生的独立危险因素,与上述国内外的研究结果一致。再次,不良生活方式或与大肠癌发生也有密切关系,许多观察研究显示,吸烟可增加大肠癌发病风险。一项荟萃分析结果表明,男性吸烟与大肠癌发生风险存在显著相关性,而发生直肠癌的风险则更高,且大肠癌发生风险随吸烟指数的增加而增大[7]。而饮酒是否为大肠肿瘤的高危因素研究结果不尽一致[8]。本研究显示,吸烟为大肠肿瘤的独立危险因素,而饮酒未显示出与大肠肿瘤明显相关。最后,患者的伴发疾病可能与大肠癌发生风险有关。有研究[9]发现,将年龄、性别、教育程度、BMI、吸烟、饮酒情况、体力活动、大肠肿瘤家族史等因素调整后,2型糖尿病大肠癌发病风险为非2型糖尿病的1.5倍。本研究患糖尿病者腺瘤检出率(28.8%)较非糖尿病者(14.3%)显著增高,且显示糖尿病是大肠肿瘤的独立危险因素,这与YANG等[10]的研究结果一致。
值得关注的是,大量研究[11-12]结果显示,有大肠癌家族史者大肠癌发生风险明显增高。而在本研究中尚未显示此趋势,可能与我们纳入的研究对象存在一定的选择偏倚有关,本研究中纳入的是无症状体检人群,未检出大肠癌,且具有大肠癌家族史的受检者很少,仅有21例(其中4例检出腺瘤),而无大肠癌家族史者879例,两者相差悬殊,造成统计分析结果可能脱离真实情况。因此,均衡各组研究对象的纳入基线,提高其匹配度,将增加研究结论的可靠性及真实性。部分研究提示,代谢综合征、胆囊切除、H.pylori感染与大肠肿瘤的发生风险相关[13-17],而长期规律服用阿司匹林则是大肠肿瘤发生的保护性因素[18],我们的研究并未得到上述结论。
目前已有许多关于无症状人群大肠肿瘤筛查评分系统的研究,WONG等[19]以中国香港地区的无症状人群为研究对象,构建了由性别、年龄、BMI、吸烟史、糖尿病史、大肠癌家族史的大肠癌发病风险评分系统,但该研究缺乏验证组,仅用预测结果去评估模型的预测能力,可能会扩大该评分系统的预测效能,需通过验证组进一步评估。陈国昌等[20]对苏南地区无症状人群进行研究,多因素分析发现,年龄、性别、冠心病、蛋类摄入、排便频率为进展期大肠肿瘤的独立危险因素,建立相应评分系统后结果显示,随着分值增高,大肠进展期肿瘤患者的比例呈增高趋势。KAMINSKI等[21]将波兰73个中心行肠镜检查的35 918例患者进行回顾分析,建立了由性别、年龄、BMI、吸烟史、大肠癌家族史5项危险因素构成的进展期大肠腺瘤的危险评分系统,但其ROC曲线下面积仅为0.62,说明其区分病例的能力欠佳。本课题分析了15项潜在危险因素,结果显示,性别、年龄、BMI、吸烟史、糖尿病史为大肠肿瘤的独立危险因素,依据以上5项因素构建的评分系统ROC曲线下面积为0.783(95%CI:0.746~0.820),说明该系统的评判效能较高。 在构建组中该评分系统的敏感度较高(76.1%),符合大肠肿瘤初步筛查要求。通过验证组进一步验证,结果显示,低风险组中腺瘤的检出率为15.8%,而高风险组中腺瘤检出率为20.9%;且其敏感度为56.3%,特异度为52.2%,说明本研究中基于无症状人群所建立的大肠肿瘤(主要针对大肠癌的癌前病变—大肠腺瘤)发生风险评分系统具有一定的预测及诊断效能。
综上所述,该评分系统对于无症状人群大肠肿瘤发生风险的预测准确度较高,对大肠肿瘤的发生风险有一定的诊断价值。根据评分系统区分无症状人群的危险程度,选择高危人群进一步行肠镜检查,将提高大肠肿瘤筛查效能,节约卫生资源,对探索与中国国情相符的大肠肿瘤筛查策略具有一定的实践意义。此评分系统有项目简洁、信息获得容易、评分简单的特点,易被医务人员熟悉和掌握,也易在人群自我筛查中推广,可以提高对大肠肿瘤的早期诊断及早期医疗干预,从而使广大患者受益。
[1] 陈万青, 郑荣寿, 曾红梅, 等. 2011年中国恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2015, 24(1): 1-10.DOI: 10.11735/j. issn. 1004-0242. 2015.01.A001.
CHEN W Q, ZHENG R S, ZENG H M, et al. Report of Cancer Incidence and Mortality in China, 2011 [J]. China Cancer, 2015, 24(1): 1-10. DOI: 10.11735/j. issn. 1004-0242. 2015.01.A001.
[2] 韩英, 武子涛, 李世荣. 应倡导大肠肿瘤的“伺机性筛查”[J]. 中华内科杂志, 2008, 47(9): 725-726. DOI: 10.3321/j.issn:0578-1426.2008.09.009.
[3] 中华医学会消化病学分会. 中国大肠肿瘤筛查、早诊早治和综合预防共识意见(2011年10月·上海)[J]. 胃肠病学和肝病学杂志, 2011, 20(11): 979-995.
[4] SEDJO R L, BYERS T, LEVIN T R, et al. Change in body size and the risk of colorectal adenomas [J]. Cancer Epidemiol Biomarkers Prev, 2007, 16(3): 526-531. DOI:10.1158/1055-9655.EPI-06-0229.
[5] 王娜, 黄志刚, 陈锡美, 等. 肥胖与大肠腺瘤相关性的研究[J]. 中华消化内镜杂志, 2008, 25(9): 453-484. DOI: 10.3760/cma.j.issn.1007-5232.2008.09.002.
WANG N, HUANG Z G, CHEN X M, et al. Case control study of the correlation between obesity and colorectal adenoma [J]. Chin J Dig Endosc, 2008, 25(9): 453-484. DOI: 10.3760/cma.j.issn.1007-5232.2008.09.002.
[6] PISCHON T, LAHMANN P H, BOEING H, et al. Body size and risk of colon and rectal cancer in the European Prospective Investigation Into Cancer and Nutrition (EPIC) [J]. J Natl Cancer Inst, 2006, 98(13): 920-31. DOI: 101093/jnci/djj246.
[7] TSOI K K, PAU C Y, WU W K, et al. Cigarette smoking and the risk of colorectal cancer:a meta-analysis of prospective cohort studies [J]. Clin Gastroenterol Hepatol, 2009, 7(6): 682-688. DOI: 10.1016/j.cgh.2009.02.016.
[8] COMBS G F, CLARKL C, TURNBULL B W. Reduction of cancer, mortality and incidence by Selenium Supplementation [J]. Med Klin (Munich), 1997, 92(3): 42-45. DOI: 10.1007/BF03041964.
[9] WONG S L. Diabetes mellitus and risk of colorectal cancer in the Singapore Chinese Health Study [J]. J Natl Cancer Inst, 2006, 98(14): 1019-1020. DOI: 10.1093/jnci/djj277.
[10] YANG Y X, HENNESSY S, LEVIS I D. Type 2 diabetes mellitus and the risk of colorectal cancer [J]. Clin Gastroenterol Hepatol, 2005, 3(6): 587-594. DOI: 10.1016/S1542-3565(05)00152-7.
[11] LICHTENSTEIN P, HOLM N V, VERKASALO P K, et al. Environmental and beritable actors in thecausation of cancer analyses of cohorts of twins from Sweden, Denmark and Finland [J]. N Engl J Med, 2000, 343(2): 78-85. DOI: 10.1056/nejm200007133430201.
[12] 杨工, 郑树, 余海, 等. 大肠癌发病的环境因素和遗传因素[J]. 中华流行病学杂志, 1992, 13(1): 30-33.
[13] SHEN Z, WANG S, YE Y, et al. Clinical study on the correlation between metabolic syndrome and colorectal carcinoma [J]. ANZ J Surg, 2010, 80(5): 331-336. DOI:10.1111/J.1445-2197.2009.05084.x.
[14] AHMED R L, SCHMITZ K H, ANDERSON K E, et al. The metabolic syndrome risk of incident colorectal cancer [J]. Cancer, 2006, 107(1): 28-36. DOI: 10.1002/cncr.21950.
[15] XU Y K, ZHANG F L, FENG T, et al. Meta-analysis on the correlation of cholecystectomyor cholecystolithiasis to risk of colorectal cancer in Chinese population [J]. Ai Zheng, 2009, 28(7): 749-755. DOI: 10.3321/j.issn:1000-467X.2009.07.015.
[16] 董红霞, 梁浩. 不同国家人群幽门螺杆菌感染与结直肠癌相关性的Meta分析[J]. 解放军医学杂志, 2015, 40(3): 236-241. DOI: 10.11855/j.issn.0577-7402.2015.03.13
DONG H X, LIANG H. Correlation between colorectal cancer and Helicobacter pylori inf ection in different countries:a meta-analysis [J]. Med J Chin PLA, 2015, 40(3): 236-241. DOI: 10.11855/j.issn.0577-7402.2015.03.13.
[17] 秦静, 惠起源. 结直肠腺瘤性息肉、结直肠癌患者幽门螺旋杆菌感染与血清G-17的相关性研究[J]. 胃肠病学和肝病学杂志, 2017, 26(8): 845-848. DOI:10.3969/j.issn.1006-5709.2017.08.002
QIN J, HUI Q Y. Relationship between Helicobacter pylori infection and serum G-17 in colorectal adenomatous polyps and colorectal cancer patients [J]. Chin J Gastroenterol Hepatol, 2017, 26(8): 845-848. DOI: 10.3969/j.issn.1006-5709.2017.08.002
[18] CHAN A T, GIOVARMUCCI E L, MEYERHARDT J A, et al. Aspirin dose and duration of use and risk of colorectal cancer in men [J]. Gastroenterology, 2008, 134(1): 21-28. DOI: 10.1053/j.gastro.2007.09.035.
[19] WONG M C, LAM T Y, TSOI K K, et al. A validated tool to predict colorectal neoplasms and screening choice for asymptomatic subjects [J]. Gut, 2014, 63(7): 1130-1136. DOI: 10.1136/gutjnl-2013-305639.
[20] 陈国昌, 毛伯能, 潘琦, 等. 苏南地区大肠癌平均风险人群大肠进展期肿瘤发生风险评分系统的建立及验证[J]. 第二军医大学学报, 2014, 35(1): 30-36. DOI:10.3724/SP.J.1008.2014.00030
CHEN G C, MAO B N, PAN Q, et al. Establishment and validation of scoring system for estimating advanced colorectal neoplasms risk in average risk population in southern Jiangsu province [J]. Academic Journal of Second Military University, 2014, 35(1): 30-36. DOI:10.3724/SP.J.1008.2014.00030
[21] KAMINSKI M F, POLKOWSKI M, KRASZEWSKA E, et al. A score to estimate the likelihood of detecting advanced colorectal neoplasia at colonoscopy [J]. Gut, 2014, 63 (7): 1112-1119. DOI: 10.1136/gutjnl-2013-304965.
