黄连解毒汤对脓毒症模型小鼠肺损伤的保护作用及其机制研究
2018-03-20翁书和梁莉萍吴思慧
李 翀 翁书和 梁莉萍 宋 斐 吴思慧
(1.三亚市人民医院,海南三亚572000; 2.广州中医药大学第一附属医院,广东广州510405;3.广东药学院第一附属医院,广东广州510304)
脓毒症(sepsis)表现为因感染引起宿主反应失调而导致危及生命的器官功能障碍,全球每年有数百万人罹患脓毒症,其中1/4甚至更多的患者死亡[1]。本病发病机制尚不能完全阐明,TLR4是其发病机制中可能的启动因子,并通过NF-κB等一系列信号转导通路级联放大效应,导致炎症因子“瀑布样爆发”[2]。中医认为感染属于毒热证范畴,病机属“热毒炽盛”,而脓毒症各个时期都可存在严重感染,使用清热解毒法解决“毒邪”这一主要矛盾,必可取得良好疗效[3]。本课题组前期采用黄连解毒汤作为基本方,发现加味黄连解毒汤能降低实热证多器官功能障碍综合征(MODS)患者器官衰竭的发生率和病死率[4],但黄连解毒汤治疗MODS的机理尚不明确。本研究观察了黄连解毒汤对脓毒症模型小鼠血清及肺组织炎症因子表达、TLR4转导通路的影响,探究其对脓毒症小鼠肺损伤保护作用的机制。
1 实验材料
1.1 动物 SPF级ICR小鼠100只,雌雄各半,体重(20±1.2)g,由广州中医药大学实验动物中心提供,动物许可证号:SCXK(粤)2011-0092。
1.2 药物与试剂 黄连解毒汤水煎剂由广州中医药大学第一附属医院制剂中心制备,药物组成:黄连10g、黄芩10g、黄柏10g、栀子10g(成人日服剂量),将药物浓缩成50%、100%、200%药液(相当于生药量0.13、0.27、0.53g/mL)各150mL并灭菌保存。酵母多糖A(Zymosan A)冻干粉,Sigma公司;白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)测试盒,上海酶联生物科技;RT-PCR引物、实时荧光定量qRT-PCR引物,上海英俊生物技术有限公司;RT-PCR、实时荧光定量qRT-PCR试剂盒及相关溶液,Roche公司。
1.3 仪器 2400型PCR仪,Perkin Elmer公司;7300型实时定量PCR仪,ABI公司;5810R型超低温高速离心机,Eppendorf公司;酶联分析仪,Tecan Genio公司;BH-2显微镜,日本奥林巴斯公司。
2 实验方法
2.1 动物分组、造模与给药 将100只小鼠按分层随机抽样法分为正常组、模型组和黄连解毒汤高、中、低剂量组,每组20只,每组又分为造模后24h和48h两个时间点检测组,每个时间点检测10只。按照胡森等[5-6]方法制作小鼠脓毒症模型:把4g酵母多糖A与50mL灭菌石蜡油混合,高频振荡30min,超声振荡6h,制成造模用混悬液,无菌条件下,模型组每只动物予腹腔注射1mg/kg剂量酵母多糖-石蜡混悬液,建立脓毒症小鼠模型。造模后动物出现呼吸急促、寒战、活动减少、反应迟钝、进食进水减少、排尿减少等脓毒症表现,提示造模成功。造模同日开始灌胃给药。给药剂量采用体表面积换算,中剂量组给药剂量等效于成人(70kg计),即每日给予小鼠0.2mL/10g灌胃,低、中、高剂量组分别给予50%、100%、200%药液,正常组和模型组给予等体积生理盐水,1次/d,持续至实验终点。
2.2 动物行为学观察 造模后分别于24h、48h观察各组动物一般状况,如动物毛发色泽、活动能力、进食及饮水情况、排便情况。
2.3 血清炎症因子检测 造模后24h、48h动物眼眶采血留取血清样本备检,采用ELISA法检测TNF-α、IL-6水平。
2.4 荧光定量PCR法检测肺组织NF-κBp65、TLR4 mRNA表达 按Takara公司试剂盒说明书提取总RNA后,按Fermentas公司试剂盒说明书进行RT-PCR,RT条件:42℃×60min,70℃×5min。转录后的cDNA按Takara公司试剂盒说明书进行real-time PCR(25μL体系)。TLR4引物序列:Forward Primer 5’-ttggggaggaa gaaaggtctaac-3’,Reverse Primer 5’-tgctgactgaaataaggtgaaagc-3’;NF-κBp65引物序列:Forward Primer 5’-gaatctccctggtcaccaaagac-3’,Reverse Primer 5’-cagcctcatagaagccatccc-3’。real-time PCR反应条件(两步法):Stage 1,预变性,Repeat 1,95℃30s;Stage 2,PCR反应,Repeat 40,95℃5s,60℃31s;Dissociation Stage,反应结束后确认Real Time PCR的扩增曲线和溶解曲线。
2.5 肺组织病理观察 造模后24h、48h取血后颈椎脱臼法处死小鼠,剪取肺组织置于4%甲醛溶液中固定,经脱水、石蜡包埋、切片、脱蜡等处理,采用HE染色后于光镜下观察病理改变,由广州中医药大学第一附属医院病理科完成。
2.6 统计学方法 实验数据采用SPSS 19.0进行统计分析。计量资料以(±s)表示,符合正态分布者采用 t 检验,不符合正态分布者采用非参数检验。以P<0.05为差异有统计学意义。
表1 各组小鼠不同时点血清炎症因子水平比较(±s)

表1 各组小鼠不同时点血清炎症因子水平比较(±s)
注: 与正常组比较,**P<0.01;与同时点模型组比较,##P<0.01;与同时点低剂量组比较,△△P<0.01;与本组24h比较,◆◆P<0.01。
正常组24h1042.50±9.1041.08±9.13 48h1040.67±7.9639.81±8.83模型组24h10612.23±38.28**267.32±28.01**48h10757.11±38.47**◆◆321.60±37.76**◆◆黄连解毒汤低剂量组24h10550.25±51.92**##196.06±13.66**##48h10486.85±42.53**##◆◆146.79±16.40**##◆◆黄连解毒汤中剂量组24h10466.00±49.42**##△△161.24±23.92**##△△48h10205.33±54.09**##△△◆◆125.61±23.42**##△△◆◆黄连解毒汤高剂量组24h10441.74±56.40**##△△155.33±17.67**##△△48h10189.41±39.43**##△△◆◆116.88±19.90**##△△◆◆
3 实验结果
3.1 小鼠行为学观察 正常组小鼠呼吸均匀,毛色光亮,活动灵敏,进食饮水正常,大小便颜色和频次正常。模型组小鼠在造模24h后普遍出现鼠毛脏湿、肤温凉、眼睑充血水肿、呼吸促、肢体颤抖、活动减少、反应迟钝、进食进水减少、排便排尿减少的表现,48h时上述症状明显加重。黄连解毒汤各剂量组小鼠在造模后也普遍出现鼠毛脏湿、活动减少、进食进水减少的表现,但呼吸、活动、进食水及排便情况均明显优于模型组,尤其以中、高剂量组情况更佳,48h时上述症状明显减轻。
3.2 各组小鼠血清炎症因子水平比较 结果见表1。造模后,与正常组比较,模型组小鼠血清IL-6、TNF-α均明显升高(P<0.01),48h组较24h组有明显增加(P<0.01)。黄连解毒汤各剂量组小鼠血清IL-6、TNF-α水平虽仍显著高于正常组(P<0.01),但各时点均显著低于模型组(P<0.01),48h显著低于24h(P<0.01),以中、高剂量组效果更为明显,中、高剂量组组间比较差异无统计学意义(P>0.05)。
3.3 各组小鼠肺组织NF-κBp65、TLR4 mRNA转录水平比较 见表2。NF-κBp65、TLR4 mRNA在小鼠肺组织中均有表达。模型组各时点NF-κBp65、TLR4 mRNA转录水平明显高于正常组(P<0.01),其中48h时点表达量更高(P<0.01);黄连解毒汤中、高剂量组TLR4 mRNA转录水平明显低于模型组(P<0.01),黄连解毒汤各剂量组NF-κBp65 mRNA转录水平明显低于模型组(P<0.01)。黄连解毒汤中、高剂量组水平明显低于低剂量组(P<0.01),中、高剂量组组间比较差异无统计学意义(P>0.05)。中、高剂量组48h水平明显低于24h(P<0.05,P<0.01)。
3.4 各组小鼠肺组织病理变化 光镜下观察各组小鼠的肺组织病理变化见图1。正常组小鼠肺组织未见损害。模型组肺泡隔明显增宽,大部分肺泡萎陷,部分肺泡内见较多红细胞浸润,细胞质疏松、染色变浅,细胞核增大、染色变浅,48h时上述病理改变加重。黄连解毒汤各剂量组肺损害较模型组明显减轻,仅见部分肺泡隔增宽和肺泡萎陷,肺泡内见少量红细胞,细胞质疏松、染色正常,细胞核增大、染色正常,但48h时上述病理改变较24h仍有加重。
表2 各组小鼠不同时点肺组织NF-κBp65、TLR4 mRNA转录水平比较(±s)
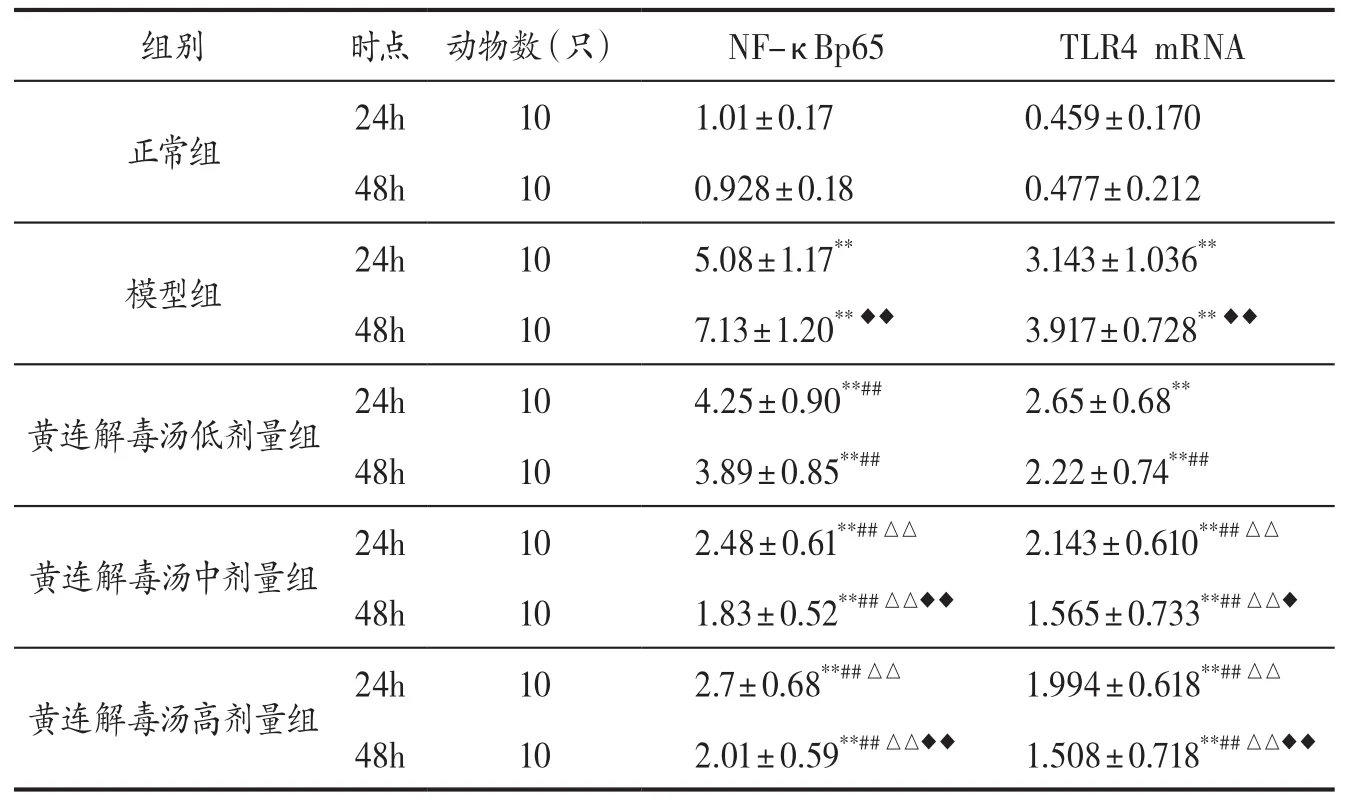
表2 各组小鼠不同时点肺组织NF-κBp65、TLR4 mRNA转录水平比较(±s)
注: 与正常组比较,**P<0.01;与同时点模型组比较,##P<0.01;与同时点低剂量组比较,△△P<0.01;与本组24h比较,◆P<0.05,◆◆P<0.01。
正常组24h101.01±0.170.459±0.170 48h100.928±0.180.477±0.212模型组24h105.08±1.17**3.143±1.036**48h107.13±1.20**◆◆3.917±0.728**◆◆黄连解毒汤低剂量组24h104.25±0.90**##2.65±0.68**48h103.89±0.85**##2.22±0.74**##黄连解毒汤中剂量组24h102.48±0.61**##△△2.143±0.610**##△△48h101.83±0.52**##△△◆◆1.565±0.733**##△△◆黄连解毒汤高剂量组24h102.7±0.68**##△△1.994±0.618**##△△48h102.01±0.59**##△△◆◆1.508±0.718**##△△◆◆
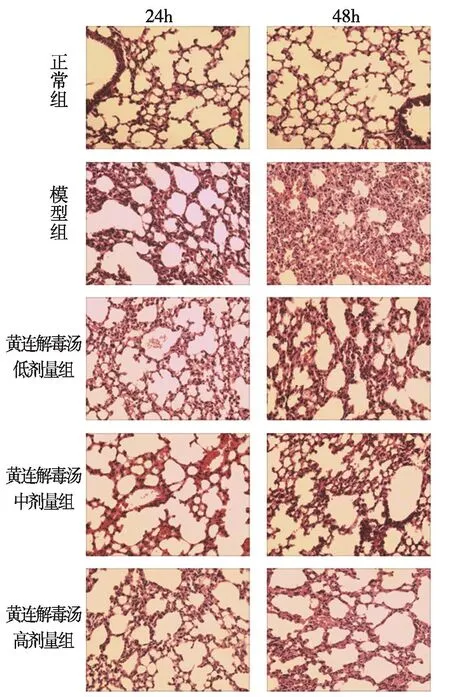
图1 各组小鼠肺组织病理变化(HE染色,×100)
4 讨论
TLR样受体(Toll-like receptors,TLRs)被认为是生物体最重要的模式识别受体,其在天然免疫细胞的表达使机体能够及时感知感染等危险信号[7]。其中,TLR4可以识别不同的细菌或病毒产物,它识别革兰阴性菌内毒素脂多糖(lipopolysaccharide,LPS),通过MyD88依赖和非MyD88依赖两种信号转导通路途径诱导NF-κβ,使之移位进入细胞核,启动炎症因子如TNF-α和IL-6等的大量表达,最终导致肺等器官的损伤甚至多器官功能障碍综合征[2,7-8]。
中医理论认为,“毒邪”是脓毒症发生发展中必要的病理因素,热毒煎熬血分,最后导致正虚邪实,气滞血瘀,阴阳逆乱,衰而竭之[3,9],因此清热解毒法在脓毒症治疗中有着重要的地位。研究表明,清热解毒代表方黄连解毒汤对铜绿假单胞菌、大肠埃希菌、金黄色葡萄球菌和沙门菌等多种细菌均有高效抑制作用,能对抗细菌毒素,调节免疫反应[10-12];能阻断LPS所诱导的TLR4高表达,从而抑制相关基因表达产物TNF-α、IFN-β过度分泌[13];还可以延长脓毒症大鼠的生存时间,减轻炎症因子对器官的损伤,降低死亡率[14-15]。
本研究结果显示,经酵母多糖腹腔注射造模后,各组小鼠血清IL-6、TNF-α含量明显升高,造模后48h更高于24h,这与人体发生脓毒症后炎症因子在体内进行性升高相符合。黄连解毒汤各剂量组较模型组同时间点血清IL-6、TNF-α水平均有明显下降,以中、高剂量组作用尤其显著。进一步研究发现,与模型组各时段相比较,黄连解毒汤各剂量组肺组织NF-κBp65、TLR4 mRNA基因表达水平均有显著降低,这一趋势与血清炎症因子的降低基本吻合。同时,病理结果显示,黄连解毒汤能显著保护小鼠肺组织结构的完整性,减轻肺泡塌陷和细胞水肿。提示黄连解毒汤可能是通过调控TLR4、NF-κB的表达进而抑制脓毒症小鼠的炎症反应,减少炎症因子的表达,以降低肺损伤的程度。中、高剂量效果更为显著,但组间并无显著性差异,证实了黄连解毒汤中剂量即可达到较好的疗效,因此治疗最佳剂量确定为中剂量即临床常用剂量。下一步课题组拟探讨黄连解毒汤对脓毒症小鼠TLR4/NF-κβ信号转导通路上其他级联反应产物的影响。
[1] SINGER M,DEUTSCHMAN C S,SEYMOUR C W,et al.The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3)[J].JAMA,2016,315(8):801.
[2] GE X Y,FANG S P,ZHOU M,et al.TLR4-dependent internalization of CX3CR1 aggravates sepsis-induced immunoparalysis[J].Am J Transl Res,2016,8(12):5696.
[3] 王今达,李志军,李银平.从“三证三法”辨证论治脓毒症[J].中国危重病急救医学,2006(11):643.
[4] 黄海燕,翁书和,牛明华.通腑清热法治疗多器官功能障碍综合征的临床研究[J].新中医,2009,41(3):39.
[5] 胡森,盛志勇,周宝桐.MODS动物模型研究进展[J].中国危重病急救医学,1999,11(8):57.
[6] 陆麒羽,周裕洋,王俊波,等.酵母多糖致全身炎症反应综合征大鼠模型的制备[J].浙江大学学报(医学版),2011,40(6):641.
[7] KHAKPOUR S,WILHELMSEN K,HELLMAN J.Vascular endothelial cell Toll-like receptor pathways in sepsis[J].Innate Immun,2015,21(8):827.
[8] LEE Y S,PARK J S,JUNG S M,et al.Inhibition of lethal inflammatory responses through the targeting of membraneassociated Toll-like receptor 4 signaling complexes with a Smad6-derived peptide[J].EMBO Mol Med,2015,7(5):577.
[9] 赵国桢,郭玉红,李博,等.中医药防治脓毒症的研究进展[J].中国中药杂志,2017,42(8):1423.
[10] 朱小明,杨家卿,张昌峰,等.黄连解毒汤抗铜绿假单胞菌生物被膜及与阿奇霉素协同抗菌作用[J].中国实验方剂学杂志,2012,18(11):155.
[11] 王维,李丹,刘洋,等.黄连解毒汤的体外抑菌试验及拆方研究[J].动物医学进展,2016,37(11):65.
[12] 李永伟,王春霞,毕勇毅.黄连解毒汤对耐药性大肠杆菌的逆转作用[J].中国实验方剂学杂志,2013,19(9):264.
[13] 赵保胜,刘洪斌,马悦颖,等.黄连解毒汤含药血清对Toll样受体3、4型及其下游信号转导通路的影响[J].中国实验方剂学杂志,2007,13(5):15.
[14] 黄鑫,郭力恒,马世玉,等.黄连解毒汤对脓毒症大鼠的心脏保护作用[J].中西医结合心脑血管病杂志,2012,10(6):710.
[15] 任建华,陈宁,林正佳,等.黄连解毒汤对多器官功能障碍大鼠脏器的保护作用[J].中国实验方剂学杂志,2008,14(4):63.
