慢性阻塞性肺病大鼠血浆白三烯C4水平、细胞免疫及支气管上皮多药耐药相关蛋白1 mRNA和蛋白水平的变化
2018-03-20黄燕玲罗光伟毛莉娜
黄燕玲 罗光伟 毛莉娜
(武汉市第一医院呼吸内科,湖北 武汉 430022)
慢性阻塞性肺疾病(COPD)是中老年人的常见病和多发病,许多患者最终因呼吸衰竭或慢性肺源性心脏病而死亡〔1~3〕。白三烯(LT)C4是和谷胱甘肽共轭的炎症产物,与COPD 患者的支气管黏膜炎症、支气管平滑肌收缩和气道重构的关联仍未清晰阐明〔4〕;另外多药耐药相关蛋白(MRP)1与LTC4有较高亲和力〔5〕。本研究探讨COPD大鼠血浆LTC4、T淋巴细胞亚群和支气管上皮MRP1 mRNA表达与COPD的相关性。
1 材料与方法
1.1材料 SPF级健康Wistar大鼠20只,雌雄各半,体重180~220 g,购于武汉大学医学动物实验中心,动物合格证号:SCXK(鄂)2003-0004。随机分为模型组和正常对照组各10只。
1.2COPD模型制备 于大鼠气管内注入脂多糖(LPS)加熏香烟方法制备COPD模型。在第1天和第14天,将大鼠全麻,于气道注入溶于生理盐水的LPS 200 μl(1 mg/ml),正常对照组注入生理盐水。第2~28天(第14天除外)将COPD组置入自制被动熏吸箱内(50 cm×50 cm×50 cm),注入香烟烟雾(牡丹牌香烟,上海卷烟厂生产,焦油、尼古丁和一氧化碳(CO)的含量分别为11.0 mg/支、0.9 mg/支和12 mg/支),浓度5%,1 h/次,2次/d。正常对照组不进行熏吸。
1.3指标检测 ①呼吸功能测定:采用动物肺功能测定系统检测肺功能,即1 s用力呼气容积占用力肺活量的比值(FEV1/FVC)、呼气峰流速(PEF)和肺顺应性(Cydn)。采用10%水合氯醛(3 ml/kg)腹腔注射麻醉大鼠,仰卧位固定于操作台,测定肺功能。②酶免疫法检测血浆LTC4:大鼠处死前经颈总动脉采血3 ml,立即注入预冷的含乙二胺四乙酸钠(EDTA-Na2)(1 mg/ml)试管中抗凝,4℃,2 000 r/min离心10 min,分离血浆,-70℃保存,备用。采用LTC4 酶免疫检测试剂盒(美国Cayman Chemical公司)测定大鼠血浆中LTC4水平,具体操作按说明书进行。③T细胞亚群检测:收集造模前后大鼠的尾巴血1 ml,采用流式细胞仪检测血T细胞及亚群。④反转录-聚合酶链反应(RT-PCR)技术分析MRP1 mRNA表达:用Trizol法提取肺组织中总RNA。MMLV逆转录酶和多聚体(Oligo)(dT)37℃下逆转录5 min,42℃ 1 h逆转录为单链cDNA。PCR扩增:采用Taq DNA多聚酶和正反引物(MRP1 上游:5′-CATTGACCCTATCTAACTT-3′,下游:5′-AGGAGAACCATAACCC-3′,208 bp;β-actin上游:5′-GAAATCGTGCGTGACATTAAGG-3′,5′-CACGTCACACTTCATGATGGAG-3′,224 bp)。存在下进行PCR,用β-actin和Marker D512为参照物,按以下步骤行PCR扩增:94℃变性,30 s,52℃退火30 s,72℃延伸30 s,30个周期。目标基因检测:采用琼脂糖凝胶电泳,用凝胶成像系统观察结果并进行拍照。采用Quantityone4.6.2分析结果。⑤肺组织标本病理:夹闭左主支气管,将硅胶管固定于右主支气,检测之前将血浆标本用SepPack C18(美国Cayman Chemical公司)分离柱抽提,洗出液用N2吹干,置入试管内,右肺内注射10%甲醛至右肺膨胀边缘变锐,结扎右主支气管,置于10%甲醛中固定、脱水、包埋、苏木素-伊红(HE)染色并行病理检查。
1.4统计学处理 采用SPSS16.0软件进行One Way ANOVA分析。
2 结 果
2.1两组体重比较 实验期间,模型组精神反应、活动和毛发较正常对照组差,入组前两组体重差异无统计学意义(P>0.05),模型组体重增重缓慢,较正常对照组明显降低(P<0.05),见表1。
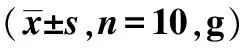
表1 两组造模前后体重比较
2.2两组造模后肺功能比较 两组肺功能差异有统计学意义(P<0.01),见表2。
2.3两组造模后血浆LTC4水平比较 与正常对照组〔(1 102.5±188.2)pg/ml〕比较,模型组血浆LTC4水平〔(2 285.4±183.1)pg/ml〕明显增高(P<0.01)。
2.4两组造模前后外周血T细胞亚群比较 造模前,两组CD3+、CD4+和CD8+差异无统计学意义(P>0.05);造模后,与正常对照组比,模型组CD3+有降低趋势,但差异无统计学意义,CD4+明显降低(P<0.001),CD8+明显增高(P<0.05),见表2。
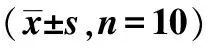
表2 两组造模前后外周血T细胞亚群及造模后肺功能比较
2.5两组肺组织中MRP1 mRNA表达 各扩增条带曲线下的光密度值Aa与β-actin扩增条带的光密度值Ab,结果以Aa/Ab×100%表示,与正常对照组〔(3.875±0.658)%〕比较,模型组光密度比值明显较低〔(1.790±0.410)%,P<0.05〕,RT-PCR产物凝胶电泳也可看见模型组MRP1 mRNA表达较弱,见图1。
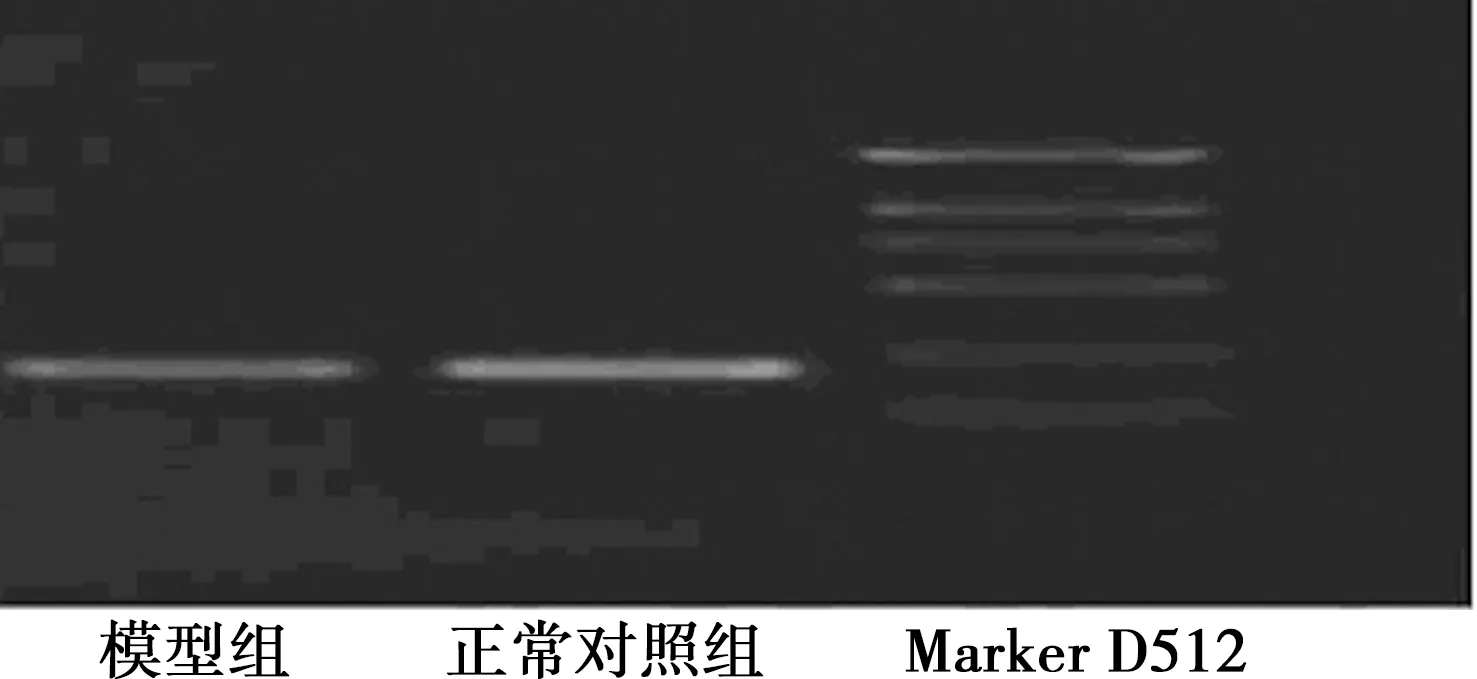
图1 MRP1 mRNART-PCR产物凝胶电泳图
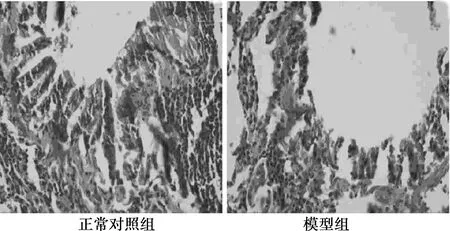
图2 两组肺支气管病理学变化(HE,×400)
2.6两组肺组织形态学病理的变化 由图2所示,正常对照组支气管黏膜纤毛柱状上皮呈整齐排列,黏膜与固有层的细胞数较少,可见少数杯状细胞,各级支气管壁黏膜上皮未见大量炎症细胞浸润,肺泡完整正常;模型组气管、支气管黏膜上皮纤毛大量倒伏和脱落,杯状细胞明显增多,各级支气管管壁周围大量炎症细胞浸润,肺泡断裂,肺泡壁变薄,腔体扩大。与正常对照组比,模型组肺组织存在明显的损伤。
3 讨 论
COPD发生时,肺不同部位的肺泡巨噬细胞、T 淋巴细胞和中性粒细胞表达增加,炎症细胞被激活释放大量炎症介质,如LTC4、肿瘤坏死因子和白细胞介素等,其中LTC4是和谷胱甘肽共轭的产物,通过增加毛细静脉的通透性,收缩血管和诱导氧化应激收缩支气管平滑肌,促进气道平滑肌增殖,增加液体渗出,进而破坏肺实体结构,导致气道重构〔6~8〕。本研究结果印证了LTC4参与了COPD的发生发展过程,也显示COPD患者的血浆的LTC4表达与COPD严重程度呈正相关关系〔8~10〕,可见临床可以LTC4水平为COPD患者提供个体化治疗方案或治疗COPD的新药可将LTC4作为药效靶点。
COPD的发病机制不仅在于肺部出现炎症反应,还在于全身免疫系统的变化。T淋巴细胞除了参与COPD的炎症过程,还参与调整COPD的免疫功能,从COPD肺泡关系液可检测到CD4+和CD8+存在明显的变化,本研究结果提示肺部感染的COPD患者细胞免疫显著降低,对外来异物的免疫监控功能降低,导致病毒、细菌等具有抗原性的异物极容易侵入机体进而加重COPD的病情,致使病情延绵不断甚至死亡,免疫调节指数降低程度与COPD的严重程度呈负相关〔11~13〕。
肺支气管细胞可表达三磷酸腺苷结合盒(ABC)类转运体,ABC类转运体可吸入体外的化学异物或有毒物质,通过外排功能达到肺减毒的效应,作为肺的天然屏障,其家族中的重要一员MRP1在健康人肺支气管上皮有较强的表达。因为MRP1具有较广泛的跨膜转运功能和较多的结合底物,使得MRP1通过作用于内源性代谢物,调节细胞内药物、毒物和药物代谢产物水平达到调节肺组织氧化应激,减少毒物或异物对人体的损害,是机体天然的防御解毒的重要组成部分。MRP1 对LTC4具有较高的亲和力,LTC4与MRP1结合并与MRP1一起排出到细胞外,因此COPD患者支气管上皮细胞的MRP1表达降低,重度COPD较中等COPD的支气管上皮细胞的MRP1表达更少,随着病程的加重,MRPI表达随之降低。MRP1在COPD的发生发展过程起保护作用〔14~18〕。
综上,采用气管注脂多糖加熏香烟方法复制COPD大鼠模型与临床COPD具有明显的病理相似性,LTC4很可能参与了COPD支气管黏膜炎症、支气管平滑肌收缩和气道重构过程;T淋巴细胞失衡提示COPD的细胞免疫功能降低,造成COPD病情延绵难治;MRP1在COPD过程中起保护作用,临床治疗时可根据LTC4、T淋巴细胞和MRP1的表达为COPD患者制定治疗方案,用于治疗COPD的新药可将降低LTC4、平衡T淋巴细胞或增加MRP1水平作为疗效靶点。
1郭子强,王心旺.慢性阻塞性肺疾病住院患者的疾病经济负担研究〔J〕.中国卫生统计,2010;27(4):345-7,350.
2刘 蕾,李宇航.慢性阻塞性肺疾病(COPD)相关生物学标志物研究进展〔J〕.中华中医药学刊,2010;29(9):1857-61.
3龚 益,时国朝,万欢英,等.上海城区60岁以上人群5年内COPD患病率变化及原因分析〔J〕.上海交通大学学报(医学版),2011;54(2):216-20.
4李 丽,李 敏.白三烯受体拮抗剂对哮喘气道重塑及Th17细胞/CD4+CD25+调节性T细胞表达的影响〔J〕.临床儿科杂志,2014;32(8):789-92.
5陶秀华.COPD进程中肺支气管上皮MRP1功能的改变及化痰降气方的逆转作用〔D〕.合肥:安徽中医药大学,2013.
6严能兵,罗 鸿.白三烯的研究进展与临床意义〔J〕.国际检验医学杂志,2014;35(6):721-3.
7邝少松,严家荣,钟志勇,等.克咳片对老年大鼠慢性阻塞性肺疾病的治疗作用〔J〕.中国药理学与毒理学杂志,2014;28(1):29-34.
8汪电雷,张 弦,陶秀华,等.化痰降气胶囊对COPD模型大鼠支气管上皮细胞中多药耐药相关蛋白1功能和表达的影响〔J〕.中国中西医结合杂志,2012;22(7):955-9.
9Houssen ME,Ragab A,Mesbah A,etal.Natural anti-inflammatory products and leukotriene inhibitors as complementary therapy for bronchial asthma〔J〕.Clin Biochem,2010;43(10-11):887-90.
10邝少松,严家荣,钟志勇,等.克咳片对慢性阻塞性肺病老年模型大鼠影响〔J〕.中国药理学与毒理学杂志,2013;27(3):477-8.
11郑 燚.淋巴细胞趋化因子(XCL1)在COPD小鼠模型肺组织中的表达及其与CD4+、CD8+T淋巴细胞、IL-2的相关性分析〔D〕.遵义:遵义医学院,2014.
12刘琛琛.COPD患者诱导痰T细胞巨噬细胞移动抑制因子的表达研究〔D〕.广州:南方医科大学,2014.
13王成阳.六味补气胶囊对慢性阻塞性肺病肺气虚证大鼠的防治及作用机理〔D〕.武汉:湖北中医药大学,2014.
14曹 银.基于药代动力学及对MRP1功能的影响探讨异硫氰酸烯丙酯治疗COPD的机制〔D〕.合肥:安徽中医药大学,2013.
15汪辰吟,陶秀华,张 弦,等.慢性阻塞性肺疾病进程与肺支气管上皮细胞MRP1功能改变的相关性研究〔J〕.中国临床药理学与治疗学,2014;19(1):8-14.
16汪辰吟,汪电雷,陶秀华,等.化痰降气方对人支气管上皮细胞多药耐药相关蛋白1的影响〔J〕.中药材,2014;37(2):280-3.
17汪珊珊,汪电雷,陶秀华,等.脂多糖诱导的慢性阻塞性肺病模型大鼠肺支气管上皮MRP1功能分析〔J〕.中国实验动物学报,2014;22(3):30-4,5.
18张 弦,汪电雷,陶秀华,等.慢性阻塞性肺疾病与多药耐药相关蛋白1的相关性研究进展〔J〕.安徽医药,2012;16(5):573-5.
