阿替普酶对脑出血大鼠血脑屏障损伤的保护作用及机制
2018-03-20凌雪辉周一心陆红梅
凌雪辉 周一心 詹 青 韩 瑛 陆红梅 秦 勇
(上海中医药大学附属第七人民医院神经内科-神经康复科,上海 200137)
脑出血是发生于脑血管的最具破坏性的疾病,具有发病率高、死亡率高和致残率高等特点〔1〕。常规微创开颅清除血肿手术能降低死亡率,但其手术创伤较大,可能对脑部正常组织造成伤害,且不能完全消除血肿,所以临床上常采用微创手术联合内科药物进行治疗〔2〕。既往研究认为,血脑屏障的破坏导致脑出血患者脑组织发生严重损害,诱导脑水肿的产生〔3〕。脑出血后脑水肿的病理变化程度与患者预后密切相关〔4〕。阿替普酶是脑出血常用的血肿腔内纤溶药物,但其相关实验研究较少。本文主要研究阿替普酶对脑出血大鼠血脑屏障损伤影响及作用机制。
1 材料与方法
1.1材料及仪器 阿替普酶购自上海勃林格殷格翰药业有限公司,胎牛血清购自美国Gibco公司,磷酸盐缓冲液(PBS)、蛋白质浓度测定试剂盒(BCA)购自上海碧云天生物技术公司,甘油醛-3-磷酸脱氢酶(GAPDH)兔抗鼠单克隆抗体购自武汉博士得有限公司,基质金属蛋白酶(MMP)-12兔抗鼠单克隆抗体、MMP-9兔抗鼠单克隆抗体购自美国CST公司,紧密连接蛋白(ZO)-1羊抗鼠单克隆抗体购自美国Abcam公司。立体定向仪购自美国Stoelting公司,电泳仪及转膜仪购自美国Bio-Rad公司。
1.2实验动物 SD雄性大鼠购自武汉华联科生物技术有限公司,体重250~290 g,每6只一笼饲养于室温20℃~22℃、相对湿度60%、清洁的环境中,自由饮食和饮水。
1.3脑出血大鼠模型构建 造模过程根据参考文献〔5〕进行并适量改进。将大鼠麻醉后固定于鼠板夹上,呈仰卧位,1 ml注射器插入右侧股动脉取血,供后续实验使用。取血后,将大鼠置于立体定位仪上,取俯卧位,使颅顶处于平面水平状态。切开颅顶中线皮肤,清除皮下组织并标记前卤,钻开大鼠颅骨,通过注射器在前卤右侧3.5 mm位置进针,以10 μl/min的速度将100 μl自体动脉血注射入颅内,静置5 min,防止自体动脉血返流,封孔,缝合。将大鼠置于37℃恒温箱中复苏。
1.4实验分组及药物干预 大鼠随机将分为对照组、脑出血组、阿替普酶组,每组10只。阿替普酶组大鼠在造模30 min后,将2 μl阿替普酶(10 μg/μl)注入血肿处;对照组大鼠在处理时只进针不注血;脑出血组为脑出血大鼠并给予等量生理盐水。
1.5行为学实验 手术第3天,所有大鼠进行转角和前肢放置实验。转角实验:放置一块与墙面成30°夹角的木板,观察小鼠向右侧转身的百分比,每只小鼠重复测试10次。前肢放置实验:握住实验动物躯干,确保小鼠前肢能自由活动。将大鼠胡须接触桌边,引起同侧前肢伸展即为触须阳性,每只小鼠每侧重复测试10次,分析小鼠触须阳性百分比。
1.6测定大鼠脑水含量 大鼠麻醉处理后,断头处死,取出脑组织,迅速称量湿重,放入100℃恒温箱中烘干处理,称量干重。脑水含量=(湿重/干重-1)×100%。
1.7检测脑组织中相关蛋白的表达水平 Western印迹检测脑出血组及可替普酶组脑组织中血脑屏障相关蛋白ZO-1、MMP-2、MMP-9蛋白水平。小鼠采用生理盐水灌注,冰上收集血肿周围脑组织标本100 mg,取10 mg加入100 μl预冷的蛋白裂解液,加入4℃组织匀浆液进行匀浆,15 000 r/min离心5 min,收集上清。根据试剂盒说明书检测所提取蛋白浓度。根据目的蛋白分子大小,配置相应浓度十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶,加样,将电压调整为80 V,恒压电泳2 h,直至蛋白条带到达凝胶底部。在转膜装置中加入转膜液,将携带目的蛋白的凝胶转移至三明治滤纸上,聚偏氟乙烯(PVDF)膜提前在无水甲醇中激活,覆盖在三明治上,避免产生气泡,调整电压至100 V,转膜2 h。将PVDF膜置于5%胎牛血清液封闭2 h,加入稀释一抗,4℃孵育过夜,TBST洗膜3次×10 min,加入稀释二抗,室温孵育90 min,TBST洗膜3次×10 min,加入显色液,曝光,显影,定影,凝胶成像系统记录蛋白条带,Image J软件分析蛋白质的相对表达量。
1.8统计学分析 采用SPSS22.0软件进行t检验、单因素方差分析、LSD-T检验。
2 结 果
2.1行为学实验 脑出血组及阿替普酶组右侧转角百分比较对照组显著增加,触须阳性百分比较对照组显著降低(P<0.05);与脑出血组相比,阿替普酶组右侧转角百分比有降低趋势,触须阳性百分比有升高趋势,但差异无统计学意义(均P>0.05)。见表1。
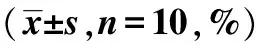
表1 各组行为学实验评分
与对照组相比:1)P<0.05
2.2各组脑水含量比较 脑出血组脑水含量〔(84.145±5.217)%〕及阿替普酶组脑水含量〔(73.321±6.285)%〕均较对照组〔(62.314±3.264)%〕显著增加,差异具有统计学意义(均P<0.05);阿替普酶组较脑出血组脑水含量有降低趋势,但差异无统计学意义(P>0.05)。
2.3各组血脑屏障相关蛋白ZO-1水平比较 阿替普酶组ZO-1蛋白水平(0.457±0.069)显著高于脑出血组(0.224±0.023,P<0.05)。见图1。

图1 各组血脑屏障相关蛋白ZO-1水平的变化
2.4各组MMP-9、MMP-12水平比较 与脑出血组比较,阿替普酶组MMP-9蛋白水平显著升高,MMP-12蛋白水平明显降低(均P<0.05)。见图2,表2。

图2 各组MMP-9、MMP-12蛋白水平变化
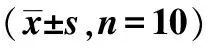
表2 各组MMP-12、MMP-9水平变化
与脑出血组相比:1)P<0.05
3 讨 论
近年来,在实行微创血肿清除术的基础上,联合药物治疗逐渐得到临床认可〔6〕。本研究表明脑出血组大鼠具有神经功能损伤和脑水肿现象,提示造模成功;阿替普酶可一定程度缓解脑出血大鼠脑水肿及神经功能损伤。本实验仅对脑出血大鼠进行血肿纤溶药物注射,并没有清除血块及血块裂解物;且通过向颅内注射自体动脉血构建模型的方法并不能模拟临床血管破裂出血的病理变化,因此对于评价阿替普酶治疗脑出血的疗效具有一定局限性,需要进一步实验验证。
血脑屏障是中枢神经系统特化的防御结构,维持脑内正常生理活动。ZO-1广泛表达于血脑屏障内皮细胞,交联于肌动蛋白细胞骨架,并紧密连接相邻的内皮细胞,形成血脑屏障相对封闭的结构,限制水和物质运输,发挥保护作用〔7~9〕。脑出血发生后,引起脑内缺血缺氧,直接破坏血脑屏障结构,且血肿裂解物通过活化小胶质细胞,诱导活性氧、MMP等因子的分泌,破坏血脑屏障连接蛋白,进一步加剧脑出血的病理症状〔10,11〕。本研究表明阿替普酶有助于维护脑出血小鼠血脑屏障的完整性。
MMP是锌钙依赖性的内切酶,可水解细胞外基质,参与内皮细胞的生理过程。机体在正常条件下,MMP无活性,表达量极少,但当机体发生异常,促进MMP表达量增加,裂解为有活性的酶〔12〕。在脑出血等疾病中,MMP可水解血管外基质和血脑屏障ZO-1,破坏血脑屏障完整性,导致脑组织的二次伤害〔13〕。MMP-12和MMP-9与脑血管疾病关系密切〔14〕。研究表明,MMP不仅在脑出血初期水解细胞外基质、破坏血脑屏障的完整性,而且在脑损伤修复过程中参与血管生成、内皮细胞增生等,具有双刃剑作用〔15~17〕。在本研究中,阿替普酶可促进MMP-9的表达,同时抑制MMP-12的水平,合理调节MMP的表达对于脑出康复具有重要意义。
综上,阿替普酶对脑出血大鼠脑水肿、神经功能损伤具有一定治疗作用,且有助于维护血脑屏障完整性,可能通过调节MMP不同表达量发挥作用,具体机制有待进一步研究。
1王 婧.血清 IL-6,hs-CRP 和 MMP-9 水平在高血压脑出血患者中的检测价值〔J〕.航空航天医学杂志,2015;26(7):800-1.
2胡尚统,周格知,潘利飞.比较微创手术联合尿激酶和开颅血肿清除术在高血压性基底节出血患者中的临床疗效〔J〕.中华全科医学,2017;15(6):937-9.
3Geng Y,Li E,Mu Q,etal.Hydrogen sulfide inhalation decreases early blood-brain barrier permeability and brain edema induced by cardiac arrest and resuscitation〔J〕.J Cereb Blood Flow Metab,2015;35(3):494-500.
4Barretto T,Park E,Liu E,etal.Blood brain barrier integrity and edema formation after moderate traumatic brain injury is improved with human umbilical cord perivascular cell therapy〔J〕.Cytotherapy,2017;19(5):S199.
5韩伟一,陈涛利,陶英群.大鼠自体动脉血脑出血模型的改良〔J〕.中国老年学杂志,2015;35(19):5407-8.
6王志刚,李春永,刘浩然,等.微创血肿清除术联合醒脑静注射液治疗高血压脑出血 60 例〔J〕.中国药业,2015;24(2):86-7.
7Podjaski C,Alvarez JI,Bourbonniere L,etal.Netrin 1 regulates blood-brain barrier function and neuroinflammation〔J〕.Brain,2015;138(6):1598-612.
8Lucke-Wold BP,Logsdon AF,Smith KE,etal.Bryostatin-1 restores blood brain barrier integrity following blast-induced traumatic brain injury〔J〕.Mol Neurobiol,2015;52(3):1119-34.
9Banks WA,Gray AM,Erickson MA,etal.Lipopolysaccharide-induced blood-brain barrier disruption:roles of cyclooxygenase,oxidative stress,neuroinflammation,and elements of the neurovascular unit〔J〕.J Neuroinflammation,2015;12(1):223.
10Ying G,Jing C,Li J,etal.Neuroprotective effects of valproic acid on blood-brain barrier disruption and apoptosis-related early brain injury in rats subjected to subarachnoid hemorrhage are modulated by heat shock protein 70/matrix metalloproteinases and heat shock protein 70/AKT pathways〔J〕.Neurosurgery,2016;79(2):286-95.
11Wu G,Wu J,Jiao Y,etal.Rosiglitazone infusion therapy following minimally invasive surgery for intracerebral hemorrhage evacuation decreases matrix metalloproteinase-9 and blood-brain barrier disruption in rabbits〔J〕.BMC Neurol,2015;15(1):37.
12Li L,Tao Y,Tang J,etal.A Cannabinoid receptor 2 agonist prevents thrombin-induced blood-brain barrier damage via the inhibition of microglial activation and matrix metalloproteinase expression in rats〔J〕.Transl Stroke Res,2015;6(6):467-77.
13Feng S,Cen J,Huang Y,etal.Matrix metalloproteinase-2 and-9 secreted by leukemic cells increase the oermeability of blood-brain barrier by disrupting tight junction proteins〔J〕.PLoS One,2011;6(8):e20599.
14Song J,Wu C,Korpos E,etal.Focal MMP-2 and MMP-9 activity at the blood-brain barrier promotes chemokine-induced leukocyte migration〔J〕.Cell Rep,2015;10(7):1040-54.
15Reuter B,Rodemer C,Grudzenski S,etal.Effect of simvastatin on MMPs and TIMPs in human brain endothelial cells and experimental stroke〔J〕.Transl Stroke Res,2015;6(2):156-9.
16Won S,Sayeed I,Peterson BL,etal.Vitamin D prevents hypoxia/reoxygenation-induced blood-brain barrier disruption via vitamin D receptor-mediated NF-kB signaling pathways〔J〕.PLoS One,2015;10(3):e0122821.
17Zhao Z,Nelson AR,Betsholtz C,etal.Establishment and dysfunction of the blood-brain barrier〔J〕.Cell,2015;163(5):1064-78.
