siRNA下调S100A4基因表达对人胶质瘤U251细胞增殖和凋亡的影响
2018-03-20汤晓琳
沈 薇 隋 璐 汤晓琳 吕 鑫
(沈阳医学院病理生理教研室,辽宁 沈阳 110034)
胶质瘤约占大脑及神经系统恶性肿瘤的45%,且大多数呈恶性发展,预后不理想〔1〕。研究证实,胶质瘤具有细胞异常增殖、细胞凋亡减慢等生物学特性,使胶质瘤的治疗面临巨大困难〔2〕。S100A4蛋白通过调节细胞存活,运动和侵袭在多种肿瘤发生发展中发挥生物学功能。有报道S100A4对胶质瘤细胞的侵袭、迁移起促进作用〔3〕,但对胶质瘤细胞生长及凋亡特性的影响目前尚不清楚。本研究利用RNA干扰(RNAi)技术抑制S100A4表达,观察下调S100A4表达对人胶质瘤细胞U251增殖及凋亡的影响。
1 材料与方法
1.1一般材料 人胶质瘤U251细胞株购自中科院上海生命科学研究院生物化学与细胞生物学研究所细胞库。siRNA-S100A4序列5'-CGAGGUGGACUUCCAAGAGTT-3',阴性对照(siRNA-NC)序列5'-UUCUCCGAACGUGUCACGUTT-3'购自上海吉玛公司。RPMI1640培养基购自Gibco公司,总RNA提取试剂盒,RT-PCR试剂盒,GoTaq Master Mix购自美国Promega公司,细胞增殖与活性检测试剂盒(CCK-8),AnnexinⅤ-FITC凋亡检测试剂盒购自东仁化学科技公司。含半胱氨酸的天冬氨酸蛋白水解酶(caspase)-3检测试剂盒购自凯基生物公司。转染试剂lipofectamineTM2000,电化学发光(ECL)试剂盒分别购自美国Invitrogen 公司和Pierce公司。兔抗人S100A4抗体购自美国Lab Vision公司。鼠抗人β-actin抗体购自美国Santa Cruz公司。
1.2细胞培养和siRNA瞬时转染 U251细胞在含10%胎牛血清的DMEM培养基,37℃、5%CO2饱和湿度条件下常规培养。将处于对数生长期的U251细胞接种到6孔板中,次日进行转染。实验分正常对照组(细胞未经任何处理)、阴性对照组(转染siRNA-NC)和siRNA-S100A4转染组。按照lipofectamineTM2000说明书进行细胞转染。
1.3RT-PCR 检测S100A4 mRNA表达水平 提取转染48 h后3组细胞的总RNA,RNA逆转录成cDNA和RT-PCR扩增。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参照。S100A4上游引物:5'-CCCTGGATGTGATGGTGTC-3',下游引物:5'-CTCGTTGTCCCTGTTGCTG-3';GAPDH上游引物:5'-CCCTTCATTGACCTCAACTA-3',下游引物:5'-CCAAAGTTGTCATGGATGAC-3'。扩增体系20 μl。扩增条件:95℃预变性5 min;95℃ 30 s,60℃ 30 s和72℃ 30 s,共40个循环。应用2-△△CT法计算CT值。各组均设3个复孔,重复实验3次。
1.4Western印迹检测S100A4 蛋白表达 收集转染48 h后3组细胞,磷酸盐缓冲液(PBS)洗3次,用RIPA裂解液裂解细胞,提取细胞总蛋白,聚氰基丙烯酸正丁酯(BCA)法测定蛋白含量。行十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)电泳分离蛋白质,湿转至聚偏氟乙烯(PVDF)膜上。5%脱脂奶粉37℃封闭1 h,分别加入S100A4抗体(1∶1 000)、β-actin抗 体(1∶2 000)4℃孵育过夜,Tris盐酸缓冲液(TBST)漂洗10 min,共3次;加入相应二抗(1∶2 000)37℃孵育2 h。TBST溶液漂洗10 min,共3次。ECL化学发光剂孵育,Bio-Rad凝胶成像系统采集图片并进行灰度值分析。
1.5CCK-8检测细胞增殖变化 将各组细胞按1 500/孔接种96孔板,每组设3个复孔,每孔加入10 μl CCK-8溶液,在细胞培养箱内孵育4 h,测定A450 nm波长OD值,连测3 d,以时间为横坐标,OD值为纵坐标绘制细胞增殖曲线。以上实验重复3次。
1.6流式细胞术检测细胞凋亡率变化 转染48 h后,用胰酶消化各组细胞,制成单细胞悬液,再用PBS离心洗涤,调整待测细胞密度为1×106个/ml。1 000 r/min,4℃离心10 min,收集细胞,弃上清液,PBS重悬,再次1 000 r/min,4℃离心10 min。100 μl结合缓冲液重悬细胞,加入5 μl AnnexinⅤ-FITC和10 μl PI混匀,避光孵育15 min后,加入400 μl结合缓冲液,流式细胞仪检测分析。
1.7细胞内caspase-3活性检测 转染48 h后,收集3组细胞,按试剂盒说明操作,加入裂解缓冲液,10 000 r/min,4℃离心1 min,取上清加入反应缓冲液和caspase-3基底,37℃ 避光孵育4 h后,用酶标仪在405 nm波长下读取吸光值(A值)。caspase-3活性单位(U)=A实验组/A对照组×100% 。实验重复3次。
1.8统计学方法 应用SPSS23.0软件进行单因素方差分析。
2 结 果
2.1转染siRNA后S100A4 mRNA和蛋白表达 转染48 h后,RT-PCR结果显示,设正常对照组为1,siRNA-S100A4组S100A4 mRNA表达(0.23±0.06)显著低于正常对照组和阴性对照组(0.93±0.04,P<0.01)。Western印迹检测显示,正常对照组、阴性对照组、siRNA-S100A4组灰度比值分别为1.05 ± 0.11、1.02±0.09、0.46±0.10。siRNA-S100A4组S100A4蛋白表达显著低于正常对照组和阴性对照组(P<0.01)。见图1。
2.2S100A4 siRNA对U251细胞增殖的影响 在转染后第1~3天分别收集细胞,CCK-8检测发现转染48、72 h后,与正常对照组和阴性对照组比较,siRNA-S100A4组细胞生长明显受到抑制,差异有统计学意义(P<0.05),见图2。
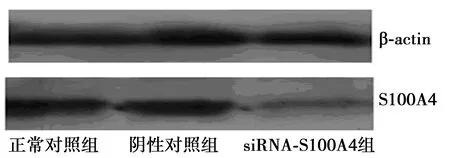
图1 Western印迹检测S100A4蛋白表达

图2 S100A4表达下调对U251细胞增殖的影响
2.3S100A4 siRNA对U251细胞凋亡的影响 流式细胞仪检测结果表明,转染48 h后,siRNA-S100A4组细胞凋亡率(27.48%±1.96%)显著高于正常对照组(8.54%±2.68%)和阴性对照组(11.95%±2.28%,P<0.05)。
2.4S100A4 siRNA对U251细胞caspase-3活性的影响 U251细胞转染48 h后,设正常对照组为100%,siRNA-S100A4组caspase-3酶活性(357.40%±48.42%)显著高于正常对照组和阴性对照组(138.73%±17.11%,P<0.01)。
3 讨 论
S100A4是S100蛋白家族成员之一,一般以同源二聚体或异二聚体形式存在于细胞内,具有调节血管生成、细胞存活、细胞运动和侵袭等广泛的生物学功能。研究表明,S100A4的表达与胃癌、乳腺癌、喉癌等多种肿瘤的预后有密切联系〔4~6〕。2008年Harris等〔7〕首次发现S100A4 在大鼠脑胶质瘤干细胞中有丰富的表达。研究报道证实,S100A4通过促进胶质瘤细胞的侵袭、转移参与神经胶质瘤的发生发展〔3〕。除了侵袭转移,胶质瘤细胞同时具有无限复制潜能,逃避凋亡等恶性生物学特性,分子靶向抑制其增殖,促进凋亡的特性。
肿瘤细胞过度增殖促使肿瘤生长迅速,成为肿瘤发生最突出的特征之一。本研究结果提示,采用siRNA下调S100A4表达可以抑制胶质瘤细胞的增殖。S100A4在肿瘤的增殖过程中起重要促进作用。有报道S100A4 siRNA转染喉癌细胞能有效抑制细胞增殖,降低裸鼠体内成瘤能力〔6〕。本研究结果与之一致,提示沉默S100A4表达能够抑制胶质癌细胞的生长、增殖。细胞凋亡在肿瘤发生发展中起重要作用。本实验结果提示,siRNA下调S100A4表达可明显增加胶质瘤细胞的凋亡。与S100A4 siRNA在其他肿瘤中促凋亡的作用类似,Hua等〔4〕报道RNAi沉默S100A4基因促进胃癌BGC823细胞凋亡。Mahon等〔8〕证实S100A4 siRNA诱导胰腺癌细胞凋亡。caspase家族在调控细胞凋亡中发挥重要作用。其中caspase-3是关键激酶之一。Mahon等〔8〕报道敲除S100A4可通过激活caspase-3,多聚ADP-核糖聚合酶诱导细胞凋亡。本研究结果提示,S100A4 siRNA通过活化caspase-3促进胶质瘤细胞的凋亡。S100A4可能是胶质瘤发生发展中的重要癌基因,在转录后水平特异性抑制S100A4基因的表达,可能成为胶质瘤治疗的新靶点。
1Stupp R,Mason WP,van den Bent MJ,etal.Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma〔J〕.N Engl J Med,2005;52(10):987-96.
2Tahara S,Nojima S,Ohshima K,etal.S100A4 accelerates the proliferation and invasion of endometrioid carcinoma and is associated with the "MELF" pattern〔J〕.Cancer Sci,2016;107(9):1345-52.
3赵鹏飞,杨学军,张 辰,等.敲低S100A4表达对胶质瘤细胞系SNB19侵袭和迁移的影响〔J〕.中国神经精神疾病杂志,2014;40(12):746-51.
4Hua J,Chen D,Fu H,etal.Short hairpin RNA-mediated inhibition of S100A4 promotes apoptosis and suppresses proliferation of BGC823 gastric cancer cells in vitro and in vivo〔J〕.Cancer Lett,2010;292(1):41-7.
5Egeland EV,Boye K,Park D,etal.Prognostic significance of S100A4-expression and subcellular localization in early-stage breast cancer〔J〕.Breast Cancer Res Treat,2017;162(1):127-37.
6Liu J,Fu S,Xu Y,etal.RNA interference targeting inhibition of S100A4 suppresses cell growth and promotes apoptosis in human laryngeal carcinoma Hep 2 cells〔J〕.Mol Med Rep,2014;10(3):1389-94.
7Harris MA,Yang H,Low BE,etal.Cancer stem cells are enriched in the side population cells in a mouse model of glioma〔J〕.Cancer Res,2008;68(24):10051-9.
8Mahon PC,Baril P,Bhakta V,etal.S100A4 contributes to the suppression of BNIP3 expression,chemoresistance,and inhibition of apoptosis in pancreatic cancer〔J〕.Cancer Res,2007;67(14):6786-95.
