雄激素受体基因对前列腺癌移植瘤生长及PI3K/AKT信号通路的影响
2018-03-20刘佳杰王海光刘宝豪虢中强姜华茂
徐 猛 刘佳杰 王海光 刘宝豪 虢中强 姜华茂
(锦州医科大学附属第一医院泌尿外科,辽宁 锦州 121000)
前列腺癌的发展和恶化与雄激素和雄激素受体(AR)信号调控密切相关〔1〕。雄激素在体内激活具有转录因子活性的AR,使其调控下游各基因表达,从而影响前列腺癌的发展。通过手术或化学药物实行雄激素剥夺疗法是目前治疗晚期前列腺癌的标准治疗方法,虽然该方法初始阶段具有明显抑制前列腺癌的效果,但经过1~2年的治疗后几乎所有患者对雄激素剥夺疗法不再敏感,这可能与AR基因突变、AR基因扩增和超表达等有关〔2〕。磷脂酰肌醇-3-羟激酶(PI3K)/丝氨酸-苏氨酸蛋白激酶(AKT)/雷帕霉素靶蛋白(mTOR)分子信号转导通路参与调节机体细胞生长、增殖、凋亡、血管生成、炎症反应和趋化等多种病理生理学过程,是细胞内重要的信号转导通路之一〔3〕。目前关于前列腺癌生长侵袭和转移中PI3K/AKT信号通路是否发挥重要作用及机制鲜有报道。本研究以小片段发夹 RNA(shRNA)介导的RNA干扰技术下调AR的表达,以探讨AR基因表达对BALB/C裸鼠移植瘤生长及PI3K/AKT信号通路相关蛋白表达的影响。
1 资料与方法
1.1实验动物及肿瘤细胞株 健康清洁级BALB/C雄性裸鼠35只,体重18~22 g,4~5周龄,购于上海动物实验中心。动物购置后在正式实验前适应性饲养1 w,饲养环境温度为(23±2)℃,12 h/12 h 昼夜灯光干预,自由饮水、进食。人前列腺癌细胞株DU-145,购于中国科学院上海细胞库。
1.2主要试剂和仪器 pRNA.U6.1/Neo质粒、RPMI-1640培养基、Trizol试剂(美国Invitrogen公司);质粒提取试剂盒(美国Sigma公司);胰蛋白酶、胎牛血清(美国Invitrogen Gibco公司);Bam HI内切酶、HindⅢ内切酶及T4 DNA连接酶、iMark酶标仪(美国Bio-Rad);逆转录试剂盒、实时荧光定量PCR试剂盒(大连TaKaRa 公司);PCR试剂盒、ABI 7500 RT-PCR 仪(美国ABI公司);Amersham ECL Prime 蛋白印迹试剂(美国GE Healthcare公司);BCA蛋白定量试剂盒(购自美国Pierce公司);AKT、p-AKT、GSK3β、p-GSK3β、mTOR和p-mTOR抗体(美国Cell Signaling Technology);细胞裂解液、β-actin抗体、辣根过氧化物酶(HRP)-羊抗大鼠IgG(上海碧云天生物技术有限公司);Western印迹电泳仪、凝胶成像分析系统(美国BIO-RAD公司),Fluor Chem Q蛋白印迹成像和定量分析系统(美国Nature Gene Corp公司)。AR mRNA引物(上游:5'-AAG CCT ATG AAT GTC AGC CCA -3',下游:5'-CAT TGA GGC TAG AGA GCA AG CC-3'),内参基因GAPDH引物(上游:5'-AGG TCC ACC ACT GAC ACG TT-3',下游:5'-GCC TCA AGA TCA TCA GCA AT-3'),购自上海生工。
1.3构建AR shRNA及制备重组质粒 根据Gen-Bank公布的人AR基因序列合成寡核苷酸链:①5'-GAT CCT ATC CCA GTC CCA CTF GAT CGA GCA AGT GGG ACT GGG ATA GGG CTT TTT-3';②5'-AGC TAA AAA GCC CTA TCC CAG TCC CAC TTG CTC GAT CAA GTG GGA CTG GGA TAG-3'。将此2条互补单链加入超纯水稀释至100 pmol/L,等量混合后加热至100℃煮沸10 min,自然冷却后即形成双链DNA片段,酶切pRNA-U6.1/Neo质粒形成线性质粒,用T4 DNA连接酶将线性质粒和双链DNA片段连接成重组质粒,并转化感受态大肠杆菌,培养24 h,经质粒提取试剂盒提取AR shRNA质粒。
1.4移植瘤裸鼠模型制备 培养前列腺癌细胞株DU-145至细胞长满90%培养皿时消化后按1∶3传代。制备2×107/ml细胞悬液,5只BALB/C裸鼠后肢腹侧分别注入0.5 ml/只,2 w后处死已形成皮下肿瘤的BALB/C裸鼠,无菌取出皮下肿瘤组织,用生理盐水研磨并调制细胞悬液浓度为2×107/ml。将30只BALB/C裸鼠后下肢皮下接种0.2 ml细胞悬液制造前列腺癌裸鼠模型。
1.5分组和给药 将30只前列腺癌裸鼠模型随机分为3组,每组10只,分别为模型对照组、阳性对照组和实验组。阳性对照组裸鼠每天尾静脉注射氟尿嘧啶20 mg/kg,实验组和模型对照组裸鼠分别尾静脉注射AR shRNA质粒2 mg/kg或同体积生理盐水,各组裸鼠于造模后当天开始连续给药10 d,实验4 w后结束。
1.6前列腺癌移植瘤体积测量 用游标卡尺测量各组裸鼠给药后第3 日、第1周、第2周、第3周和第4周时移植瘤的长径和短径,计算肿瘤体积(V=0.52×长径×短径2),比较各组BALB/C裸鼠肿瘤生长情况。
1.7前列腺癌移植瘤AR mRNA表达水平测定 实验结束时处死裸鼠后剥离种植瘤后置液氮保存。取各组裸鼠瘤组织用Trizol液常规提取各组细胞RNA,使用iMark酶标仪测定260 nm和280 nm的吸光度(A)值,以RNA电泳检测其完整性。取总RNA进行cDNA合成,然后用引物按照PCR试剂盒说明书进行扩增。PCR扩增条件如下:95℃预变性30 s,95℃变性10 s,60℃复性30 s,循环40次。AR mRNA表达量以内参物GAPDH的相对定量表示。
1.8前列腺癌移植癌PI3K/AKT信号通路相关蛋白表达水平测定 各组裸鼠瘤组织匀浆后采用RIPA裂解液进行裂解,离心,取上清液测定蛋白浓度,以Western印迹测定瘤组织中AKT、p-AKT、GSK3β、p-GSK3β、mTOR和p-mTOR蛋白表达。制备十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)后加样后电泳,电转至聚偏氟乙烯(PVDF)膜上,脱脂奶粉室温封闭2 h,加入AKT、p-AKT、GSK3β、p-GSK3β、mTOR和p-mTOR抗体,4℃过夜,TBST缓冲液洗膜,加入HRP-羊抗裸鼠IgG,25℃孵育1 h,洗膜,显色,显影。AKT、p-AKT、GSK3β、p-GSK3β、mTOR和p-mTOR的表达量以各自吸光度值与β-actin吸光度值的比值表示。
1.9统计学方法 采用SPSS20.0软件进行单因素方差分析。
2 结 果
2.1各组裸鼠移植瘤生长比较 给药3 d时实验组和模型对照组裸鼠移植瘤体积差异无统计学意义(P>0.05),实验组裸鼠在给药后1 w、2 w、3 w和4 w时肿瘤体积较模型对照组显著降低(P<0.05)。阳性对照组裸鼠移植瘤生长情况与实验组相似,见表1。
2.2各组裸鼠移植瘤组织AR mRNA表达水平比较 实验组裸鼠移植瘤AR mRNA表达水平(0.527±0.009)较模型组显著降低(0.724±0.115,P<0.05),而模型对照组(0.736±0.112)和阳性对照组裸鼠移植瘤AR mRNA表达水平差异无统计学意义(P>0.05)。见图1。
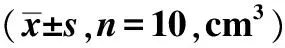
表1 各组裸鼠给药后移植瘤体积比较
与模型对照组比较:1)P<0.05,下表同
2.3各组裸鼠给药4 w时移植瘤PI3K/AKT信号通路相关蛋白表达水平比较 实验组裸鼠移植瘤中p-AKT、p-GSK3β和p-mTOR蛋白表达水平较模型对照组显著降低(P<0.05),AKT、GSK3β和mTOR蛋白表达显著升高(P<0.05),与阳性对照组裸鼠结果相似,见表2和图2。
图1 各组移植瘤AR mRNA表达
表2 各组裸鼠移植瘤PI3K/AKT信号通路相关蛋白表达比较
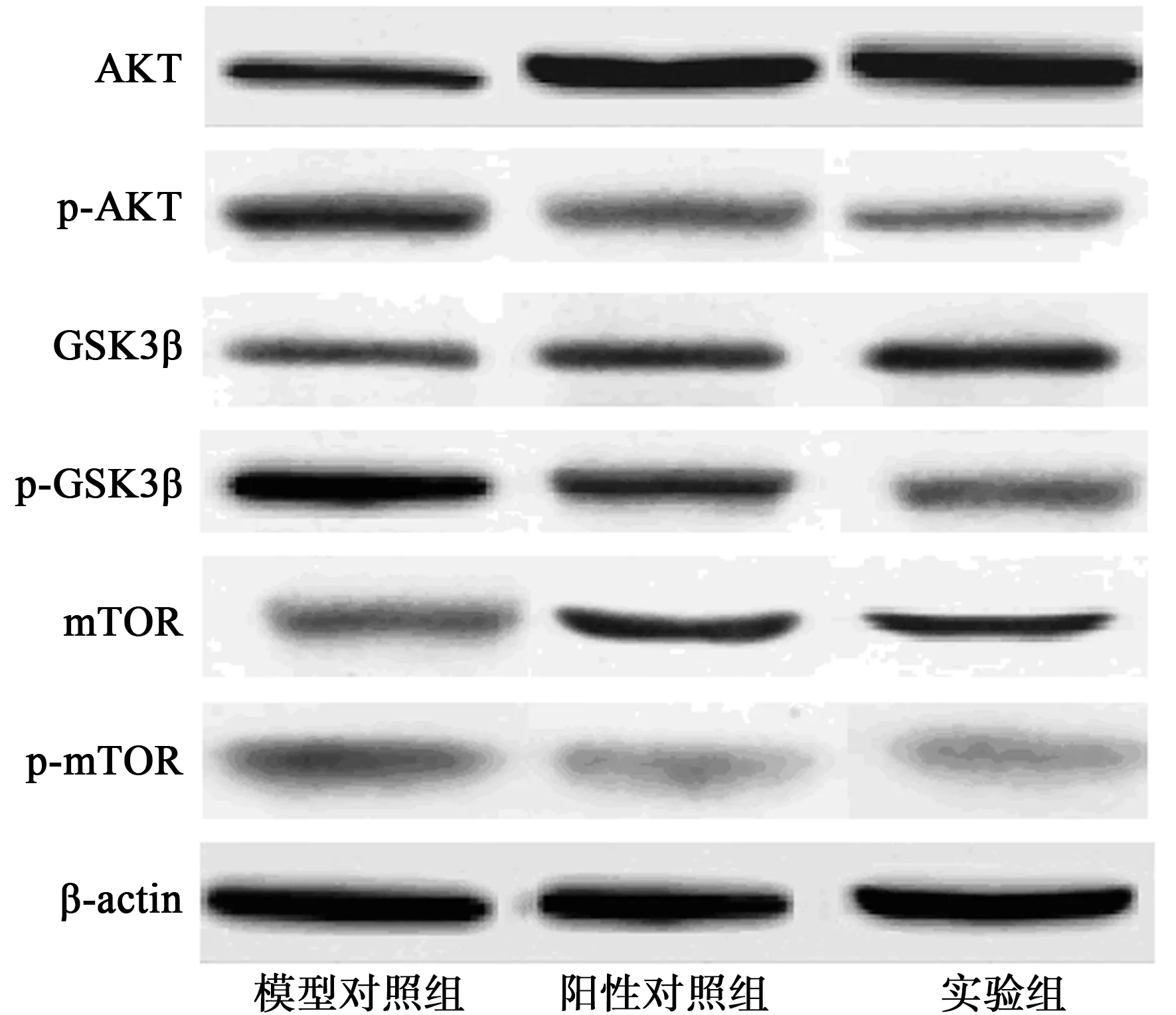
图2 PI3K/AKT信号通路相关蛋白电泳图
3 讨 论
AR是一种细胞内转录因子,属于核受体超家族中的类固醇受体〔4〕,分布于睾丸组织及睾丸外组织中如前列腺、附睾和癌组织等细胞中。AR 由热休克蛋白(HSP)70、90、56 组成,是前列腺癌的关键调节因子,也是其主要的治疗靶点。AR被雄激素等配体激活后诱使AR与HSP-90、HSP-70、HSP-56等分子伴侣分离,从而暴露了核转录信号,使AR二聚体并向细胞核内转移,以高专一性、高亲和力与雄激素反应元件结合以发挥基因转录的调控作用〔5,6〕。部分蛋白质也可以和AR相互作用,导致基因的激活和去势抗性〔7〕。在雄激素依赖型前列腺癌中雄激素与AR结合而刺激前列腺癌细胞的增殖〔8〕。在雄激素非依赖型前列腺癌通过AR表达增加、AR突变、AR信号转导途径改变等机制,使AR基因呈现出更高的表达活性〔9〕。本研究结果表明AR shRNA 质粒可抑制前列腺癌的增殖及移植瘤中AR的表达,这可能是AR shRNA 质粒抑制前列腺癌增殖的机制之一。
PI3K/AKT通路作为细胞内非常重要的信号转导通路,在细胞增殖、凋亡、血管生成等过程中发挥着极其重要的生物学功能,从而参与多种肿瘤发生发展的过程〔10〕。AKT是PI3K的重要下游靶激酶,而p-AKT是信号通路的必要条件,p-AKT可通过激活抗凋亡蛋白Bcl-2及减少促凋亡蛋白Bax 的活化而发挥其抗凋亡的作用〔11〕。GSK3β是细胞内主要的丝氨酸/苏氨酸家族激酶,也是AKT下游重要靶向分子,通过参与多种信号通路对细胞周期、细胞凋亡、细胞侵袭/转移、血管生成等进行调控〔12,13〕。GSK3β是多种信号途径的交汇点,具有广泛的底物,而磷酸化位点活化是GSK3β活性调控的主要方式之一。mTOR是一种高度保守的丝/苏氨酸蛋白激酶,是PI3K/AKT 信号通路的下游靶点〔14〕。AKT可磷酸化mTOR形成p-mTOR并使其激活,后者促进mRNA翻译,调节细胞代谢、生长增殖及存活等生理活动。本研究表明AR shRNA 质粒可以抑制PI3K/AKT通路中AKT、GSK3β和mTOR蛋白的磷酸化从而抑制PI3K/AKT信号通路,这可能是AR-shRNA 质粒抑制前列腺癌增殖的机制之一。
1俞 攀,尹彬彬,刘春华,等.雄激素受体负向调节雄激素非依赖性前列腺癌细胞FNl和ZNF438基因表达的研究〔J〕.中华医学杂志,2015;95(48):3935-40.
2Watson PA,Arora VK,Sawyers CL.Emerging mechanisms of resistance to androgen receptor inhibitors in prostate cancer〔J〕.Nat Rev Cancer,2015;15(12):701-11.
3Cargnello M,Roux PP.Activation and function of the MAPKs and their substrates,the MAPK -activated protein kinases〔J〕.Microbiol Mol Biol Rev,2011;75 (1):50-83.
4Lavery DN,Villaronga MA,Walker MM,etal.Repression of androgen receptor activity by HEYL,a third member of the Hairy/Enhancer-of-split-related family of Notch effectors〔J〕.J Biol Chem,2011;286(20):17796-808.
5Culig Z.Androgen receptor coactivators in regulation of growth and differentiation in prostate cancer〔J〕.J Cell Physiol,2016;231(2):270-4.
6Jehle K,Cato L,Neeb A,etal.Coregulator control of androgen receptor action by a novel nuclear preceptor-binding motif〔J〕.J Biol Chem,2014;289(13):8839-51.
7Liu LL,Xie N,Sun S,etal.Mechanisms of the androgen receptor splicing in prostate cancer cells〔J〕.Oncogene,2014;33(24):3140-50.
8Tanner MJ,Welliver RC Jr,Chen M,etal.Effects of androgen receptor and androgen on gene expression in prostate stromal fibroblasts and paracrine signaling to prostate cancer cells〔J〕.PLoS One,2011;6(1):e16027.
9Kawata H,Ishikura N,Watanabe M,etal.Prolonged treatment with bicalutamide induces androgen receptor over-expression and androgen hypersensitivity〔J〕.Prostate,2010;70(7):745-54.
10Li S,Yu W,Kishikawa H,etal.Angiogenin prevents serum withdrawal-induced apoptosis of P19 embryonal carcinoma cells〔J〕.FEBS J,2010;277(17):3575-87.
11Wang B,Shravah J,Luo H,etal.Propofol protects against hydrogen peroxide-induced injury in cardiac H9c2 cells via Akt activation and Bcl-2 up-regulation〔J〕.Biochem Biophys Res Commun,2009;389(1):105-11.
12Rattanalappaiboon D,Kietpeerakool C,Kleebkaow P,etal.Factors affecting compliance in the first year of postcolposcopy surveillance among women with a high incidence of cervical cancer〔J〕.Int J Gynaecol Obstetric,2014;124(2):160-3.
13Shimura T.Acquired radioresistance of cancer and the AKT/GSK3beta/cyclin D1 over expression cycle〔J〕.J Radiation Res,2011;52(5):539-44.
14Yang H,Rudge DG,Koos JD,etal.mTOR kinase structure,mechanism and regulation〔J〕.Nature,2013;497(7448):217-23.
