重复剖宫产瘢痕妊娠1例
2018-03-20梅松原魏金花韩秋丽
梅松原 魏金花 韩秋丽 石 岩
(哈尔滨242医院妇科,哈尔滨 150066)
剖宫产瘢痕妊娠 (cesarean scar pregnancy, CSP)是指受精卵着床于既往剖宫产瘢痕处的异位妊娠,较为罕见,可导致胎盘植入、子宫破裂甚至孕产妇死亡,是剖宫产术后远期潜在的严重并发症。CSP的临床表现多样,目前尚缺乏统一的治疗规范。随着二胎政策放开,CSP患病率明显增加。本文报道同一患者2次CSP,从病例特点、诊断和治疗方案及2次介入的对比等多角度进行分析总结,现报道如下。
1 临床资料
患者2007年子宫下段剖宫产术,分别于2010、2015年因CSP入我院治疗,报道如下。
第1次入院:34岁,因“停经44 d,药物流产后阴道流血9 h”于2010年8月5日入院。患者平素月经规律,经期3~5 d,周期28 d。末次月经:2010年6月22日。生育史:G2P1,2007年剖宫产1次。停经42 d超声检查提示宫腔内子宫下段见妊娠囊,大小2.0 cm×1.8 cm,药物流产失败,刮宫后出现持续阴道流血,经缩宫素静点止血对症治疗,阴道流血增多无改善,转入我院。我院超声检查提示:宫底内膜清晰,厚约0.5cm,子宫下段内膜不清晰,子宫下段可见一低回声区,2.9 cm×2.7 cm,边界尚清晰,内部回声尚均匀,其前缘距离前壁浆膜层4.3 mm。查体:血压86/50 mm Hg,脉搏74次/min,体温36.3 ℃,呼吸19次/min。贫血貌,心肺无异常,腹平软,无压痛反跳痛。妇科检查:阴道大量血凝块,宫颈常大,自宫颈口活动性出血,子宫增大,质软,余无异常。血常规:Hb 70g/L,Hct 21.7%。血β-hCG 21 244 IU/L,肝肾功及凝血象均未见异常。入院诊断:CSP,药物流产术后继发中度贫血。鉴于患者出血较多,入院后给予输血止血对症宫腔压迫治疗,行双侧子宫动脉栓塞术(uterine artery embolization,UAE),见图1,术中使用甲氨蝶呤25 mg。术后患者阴道流血量明显减少,监测血β-hCG成阶梯性下降。8月22日血β-hCG 284 IU/L。超声检查:子宫下段宫腔内可见2.6 cm×1.4 cm低至无回声,延续至宫颈内口,形态欠规则,内见少许强回声条索(图2)。宫腔镜检查:宫腔内前壁下段剖宫产瘢痕处陈旧机化组织,呈不规则团块状,剖宫产瘢痕缺陷(cesarean scar defect, CSD)。与患者沟通病情行,局麻宫腔镜下妊娠病灶切除术,切除机化妊娠组织约15 g,出血30 ml。术后病理:妊娠机化,坏死及瘢痕组织(图3)。8月29日复查阴式超声宫腔线清晰,内膜0.5 cm,未见异常,患者出院。出院后3周血hCG降至正常,继续随访3个月,月经恢复正常规律。
第2次入院:38岁,因“停经77 d,流产后阴道大量流血2 h”于2015年2月6日入院。末次月经:2014年11月21日。 2015年2月6日行药物流产未见妊娠囊排出,遂行刮宫术,术中出血约500 ml,刮出组织未见妊娠囊,阴道填砂压迫止血后来我院。超声检查示子宫下段异常回声,可见稍强回声6.0 cm×3.8 cm,其内可见孕囊1.9 cm×1.0 cm,形态略欠规则,子宫下段肌层连续性尚完整,最薄处2.7 mm(图4)。 查体: 生命体征平稳,心肺无异常,腹平软,无压痛反跳痛。妇科检查:阴道填纱状态,无明显出血,宫颈口未开,子宫稍增大,质软,余无异常。心电胸片,肝肾功及凝血象均未见异常。Hb 121g/L。血β-HCG 11 080 IU/L。既往2012年4月5日妊娠43 d,孕囊位置正常,成功行人工流产术。入院诊断: CSP,人工流产术后。入院后完善相关检查,再次行局麻下双侧子宫动脉栓塞术(图5),输液,备止血药、缩宫素及抢救设备,超声引导下刮宫术,术中出血300 ml。术后病理:蜕膜组织,少量滋养细胞绒毛(图6)。2月10日血β-hCG 8020 IU/L, 予甲氨蝶呤50 mg分臀肌注。2月13日血β-hCG>5804 IU/L,2月17日血β-hCG>3777 IU/L。2月22日复查阴式超声宫腔线清晰,内膜0.6 cm,未见异常,血β-hCG>1025 IU/L,患者出院。出院后3周血hCG降至正常。随访3个月,月经恢复正常。
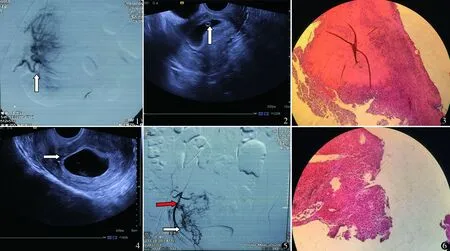
图1 子宫动脉造影,箭头所示为子宫动脉主干 图2 超声示宫腔内可见2.6 cm×1.4 cm低至无回声,延续至宫颈内口,形态欠规则低回声 图3 妊娠机化,坏死及瘢痕组织(HE染色 ×100) 图4 超声示子宫下段异常回声,肌层连续性尚完整,最薄处2.7 mm 图5 子宫动脉造影,白色箭头为子宫动脉主干,与图1对比,子宫动脉主干变细,黑色箭头为开放的侧支循环 图6 蜕膜组织,少量滋养细胞绒毛(HE染色 ×100)
2 讨论
CSP于1978年由Larsena和Solomon首次报道并提出概念,CSP发病率逐年上升,国外发病率1∶2216~1∶1800,占有剖宫产史妇女的1.15%[1]。2010年世界卫生组织的一份报告指出,中国的剖宫产率已达46.2%,国内发病率近十年从7∶100 000升至36.2∶100 000[2]。伴随我国二胎政策放开,CSP检出率也成上升状态。二次CSP时有发生,Maymon等[3]研究显示,CSP再次妊娠生育结局多数是良好的,孕期和分娩时发生并发症的风险并不比正常有剖宫产史的孕妇高,重复发生CSP的风险为25%。由于CSP出现症状的早晚不一,与剖宫产术后时间无关,易于误诊,早期诊断存在困难。血hCG能够辅助评估滋养细胞活性及子宫破裂风险,经阴道超声(transvaginal ultrasonography, TVS)和MRI可以提高诊断准确性,逐渐成为诊断CSP的金标准。CSP发病机制尚不明确,诊断也无国际统一标准,治疗没有统一的循证医学指南[4]。治疗多样化,可选择的方法多达12余种:局部血管硬化技术、UAE、药物保守治疗、保留生育功能的阴式手术、宫腹腔镜手术、全子宫切除术、高强度聚焦超声等[5],多种方法各有优点。李正子等[6]报道外突型CSP行阴式手术效果良好。依据2016年CSP诊断与治疗共识[7],根据临床表现及超声特点我国将CSP分为3型:Ⅰ型,瘢痕处宫腔内孕囊存活型;Ⅱ型,瘢痕处肌层内孕囊型;Ⅲ型,包块型或类滋养细胞疾病型。专家共识突出CSP治疗应清除妊娠组织,减少出血,保留生育功能,结合患者意愿,权衡利弊选择更加微创化、个体化、精准化的治疗方式。
本例的特点:①CSP易于误诊。应该对医源性疾病给予早期高度重视。CSP 的临床表现呈多样性,孕早期的临床经过可与正常宫内妊娠一样,如停经、子宫增大及血 β-hCG 升高等,也可表现为孕早期出血及下腹痛,所以误诊率较高。李苏萍等[8]报道 53 例首诊的 CSP 33.9% (18/53) 误诊为宫内早孕;30.2%( 16/53) 诊断为阴道出血原因待查和子宫下段混合性包块待查;3.8% (2/53) 分别误诊为先兆流产和滋养细胞肿瘤;只有 28.3% (15/53) 首次诊断为CSP。本例初诊依据患者病史及超声检查未明显提示CSP,入院诊断为Ⅰ型CSP,行UAE联合药物及宫腔镜病灶切除术,转归良好,再次妊娠仍为CSP,门诊仍没有完全重视,导致误诊误治。②早期诊断是处理CSP的关键。TVS、MRI可作为首选筛查诊断依据。对于血流动力学异常及持续性阴道出血者应急诊手术,避免期待治疗和盲目刮宫。③同为介入治疗,2次均有效,但效果不同。患者入院前诊断不明,盲目刮宫,持续出血,经子宫动脉血管介入达到稳定血液动力安全,结合药物及手术达到终止妊娠目的,而再次入院时进行血管介入,见子宫动脉主干变细,侧枝循环建立开放,栓塞效果欠佳,介入后刮宫失血较多。④CSP是剖宫产术后概率事件,再次CSP介入治疗有效。该患者首次CSP术后2年曾有过一次活胎人工流产,说明孕囊绒毛附着位置极为关键。患者于4年后重复CSP再次急诊介入治疗有效,但要注意介入后手术时机。Chou等[9]报道为减少清宫术中出血及预防术后出血的发生,可于术前24 h内进行选择性双侧UAE,临床证实安全有效。我们考虑到患者子宫动脉变异,血管侧支开放程度,结合超声引导后及时刮宫,失血量仍达300 ml,可见,对于重复介入治疗CSP有待进一步认识。⑤保留生育功能的手术可以达到终止妊娠目的。首次入院UAE后,为进一步明确剖宫产缺陷及妊娠组织残留行宫腔镜检查提示CSD,宫内妊娠组织残留,行宫腔镜电切术,切除病灶,改善临床症状。⑥本例拒绝修复性手术,结合CSP缺少修复术后再次妊娠的循证医学证据,实施保守的清宫手术,CSD病因没有纠正,并且可能存在子宫组织丢失,加重CSD,继而重复CSP,甚至孕晚期凶险型前置胎盘可能。
CSP治疗的目的在于及时终止妊娠,防止子宫破裂、大出血等严重并发症的发生,以保留患者的生育功能,同时要尽量避免再次CSP。因CSP患者多存在CSD,所以治疗CSD成为避免再次CSP的关键,手术切除瘢痕缺陷可避免再次CSP。①宫腔镜电切术[10]:将宫腔内有活瓣作用的剖宫产切口下缘切除,修复缺损,以利于经血流出,损伤小,操作简单。Raimondo等[11]报道87.0%的患者症状能得以改善。但无法缝合,未能对瘢痕缺陷进行真正的修补,若再次妊娠仍可发生CSP。②阴式手术:能有效减少月经量,但手术视野窄,需要术者熟练的手术技巧,术者于子宫表面用手指触摸及超声等辅助定位,难以保证定位的准确性,若存在子宫瘢痕处与腹壁或膀胱粘连,易损伤膀胱及尿道。③腹腔镜手术:Li 等[12]通过对比宫腔镜与腹腔镜手术切除瘢痕组织,认为对于有生育要求且瘢痕缺陷肌层厚度<3.5 mm或前壁瘢痕缺陷≥50.0%面积的患者,选择腹腔镜手术更合适; 肌层厚度≥3.5 mm或前壁瘢痕缺陷<50.0%选择宫腔镜手术较好。④宫腹腔镜联合治疗[13]:宫腔镜检查定位准确,瘢痕缺陷部位切除彻底,腹腔镜手术可分离盆腔粘连,恢复子宫、膀胱的解剖位置,腹腔镜下全层缝合后再次用宫腔镜进行评估,确保缝合效果。可见,宫腹腔镜联合手术彻底切除CSD,全层缝合,恢复子宫解剖,有效减少CSP的发生。此外,国外研究[14,15]结果表明多次剖宫产不仅可以增加CSD的发生率,还可能增大瘢痕缺陷的面积,因此,严格控制剖宫产指征,减少剖宫产次数,可降低CSD发生,减少CSP。
可见,对于有生育要求的患者,各种非修复性手术不能去除病因,手术切除病灶修复缺陷可能是最佳选择方案。对于不同妊娠时期的CSP,处置不同,但缺少循证医学佐证。Hoshino等[16]认为CSP在7周以内妊娠囊、子宫内膜、肌层粘连并不那么紧密,在超声监测下抽吸孕囊是安全有效的,孕周>8周、孕囊>6 cm,介入术后不适合选择清宫术,可考虑行手术切除病灶。手术清除瘢痕部位异位妊娠组织同时缝合裂口是治疗CSP的最佳方法[17,18]。总之,在各种治疗方案中,以UAE治疗结合宫腹腔镜治疗最为有效[19],戚燕妮等[20]报道腹腔镜下子宫动脉阻断、病灶切除及子宫修补术治疗Ⅱ型剖宫产瘢痕妊娠安全有效。
根据本例CSP的处理难点主要有以下几个方面:①不能及时诊断,误诊误治,盲目清宫,危及生命;②缺乏经验,不能明确分型,合理选择个体化治疗方案;③抢救能力,有高超的TVS、MRI、介入及宫腹腔镜技术;④CSD的手术修复对术者经验及技术要求高。
尽管本例CSP治疗尚存在诸多问题,但能警示我们对CSP提高重视程度,不具备抢救诊治能力的医院建议转诊到设施完善,诊疗水平高的医院实施治疗。我们应结合2016年中华医学会计划生育学会分会制定的“CSP诊治共识”,指导临床工作,规范临床诊疗行为,加强医疗风险防范,同时建议大的研究中心能够建立具备充分循证医学证据的治疗指南。
1 Litwicka K, Greco E. Caesarean scar pregnancy:a review of management options. Curr Opin Obstet Gynecol,2013,25(6):456-461.
2 Long Q, Klemetti R, Wang Y, et al . High caesarean section rate in rural China: is it related to health insurance(New Co-operative Medical Scheme). Social Sci Med,2012,75(4):733-737.
3 Maymon R, Svirsky R,Smorgick N, et al. Fertility performance and obstetric outcomes among women with previous cesarean scar pregnancy. Ultras Med,2011,30(9):1179-1184.
4 Ash MA, Haberman S, Maxwell D. Caesarean scar pregnancy. BJOG,2007,114(3):253-263.
5 张淑珍,赵玲利,李明奎,等.超声介入下注射聚桂醇在治疗剖宫产瘢痕妊娠61例中的应用.实用妇产科杂志,2015,31(2):112-115.
6 李正子,贾菲菲,杨润乔.经阴道剖宫产瘢痕妊娠病灶切除术9 例报告.中国微创外科杂志,2015,15(2):175-176.
7 中华医学会妇产科学分会计划生育学组.剖宫产术后子宫瘢痕妊娠诊治专家共识(2016).中华妇产科杂志,2016,51(8):568-572.
8 李苏萍,吴新华.剖宫产术后子宫瘢痕部位妊娠53 例临床分析.现代妇产科进展,2012,21(3):233-234.
9 Chou MM, Hwang JI, Tseng JJ, et al. Cesarean scar pregnancy: Quantitative assessment of uterine neovascularization with 3-dimensional color power Doppler imaging and successful treatment with uterine artery embolization. Am J Obstet Gynecol,2004,190(3):866-868.
10 徐大宝, 何大琼, 刘 慧.宫腔镜手术治疗剖宫产子宫切口瘢痕缺陷.南方医科大学学报,2010,30(2):394-396.
11 Raimondo G, Grifone G, Raimondo D. Hysteroscopic treatment of symptomatic cesarean-induced isthmocele: a prospective study. J Minim Invasive Gynecol,2015,22(2):297-301.
12 Li C, Guo Y, Liu Y, et al. Hysteroscopic and laparoscopic management of uterine defects on previous cesarean delivery scars. J Perinat Med,2014,42(3):363-370.
13 蒋清清,于 鹏,谢红斌.宫腹腔镜联合手术治疗剖宫产子宫切口瘢痕缺陷.中国内镜杂志,2016,22(1):83-85.
14 Roberge S, Boutin A,Chaille TN,et al. Systematic review of cesarean scar assessment in the nonpregnant state:imaging techniques and uterine scar defect. Am J Perinatol,2012,29(6):465-471.
15 Wang CB,Chiu WW,Lee CY,et al. Cesarean scar defect:correlation between cesarean section number,defect size,clinical symptoms and uterine position. Ultrasound Obstet Gynecol,2009,34(1):85-89.
16 Hoshino T, Kita M, Imai Y. Macroscopic appearance of auterus with a cesarean scar pregnancy. Gynecol Obstet,2011,115(1):65-66.
17 王 乔,彭鸿灵,何 镭,等.介入治疗联合清宫术治疗123例剖宫产瘢痕妊娠的疗效评价及临床研究.实用妇产科杂志,2015,31(5):372-375.
18 Fylstra DL. Ectopic pregnancy within a cesarean scar: a review.Obstet Gynecol Surg,2002,57(8):537-543.
19 Xin Wu, Qiujing Zhu, Xuezhe Wu. Combined laparoscopy and hysteroscopy vs. uterine curettage in the uterine artery embolization-based management of cesarean scar pregnancy: a cohort study.Clin Exp Med,2014,7(9):2793-2803.
20 戚燕妮 ,吴丹梅 ,杨 帆,等.Ⅱ型剖宫产瘢痕妊娠的腹腔镜处理.中国微创外科杂志,2015,15(1):30-32.
