异质性帕金森病患者非运动症状分布特点
2018-03-20李蒙燕郭爱华
李蒙燕 郑 浩 郭爱华
广州市第一人民医院神经内科,广东 广州 510180
帕金森病(Parkinson’s disease,PD)是一种常见的中枢神经系统退行性病。除运动症状外,非运动症状(non motor symptoms,NMS)是PD重要的临床组成部分,甚至是临床前期重要的生物标志物和表现形式。在积极治疗运动症状的同时,如何早期识别并有效治疗非运动症状,已成为当前帕金森病诊断与治疗的热点和难点之一。2006年Chaudhur发明国际帕金森病非运动症状用NMS调查问卷(Non motor symptoms questionnaire,NMSQuest),对PD患者进行筛查及合理治疗,其信度、效度都已得到证实[1],缺点是并不是一个评分量表,因此不能评价症状的严重程度和治疗效果,为了提供一种可以量化的工具,研究者还发明了非运动症状评价量表(Non-Motor Symptoms Scale,NMSS)[2]。本文根据PD临床异质性不同的分类方法,将患者分为不同类型,然后利用该量表比较近1个月来NMS发生率及严重程度,以期发现不同类型的PD患者NMS的分布特点,帮助临床医生在工作中能快速准确的诊断,达到针对不同类型的PD患者个体化精准治疗的目的。
1 对象与方法
1.1对象连续收集2014-08—2016-06就诊于广州市第一人民医院的神经科运动障碍疾病门诊及住院部PD患者共171例,记录人口学资料,包括姓名、性别、年龄及运动障碍类型。诊断符合1992年英国PD脑库制定的原发性PD的诊断标准诊断。经头颅CT或MRI检查,排除脑血管疾病、脑炎、中毒、外伤、药物等所致的帕金森综合征、帕金森叠加综合征,同时患有恶性肿瘤、残疾和其他躯体严重疾病者不纳入本研究。
1.2方法
1.2.1 临床异质性分型方法:以发病年龄为标准分为早发组(≤50岁)、晚发组(>50岁);以性别为标准分为男性组、女性组;依据运动障碍表现分型分为混合型、震颤型和强直型;依据H-Y分级严重度分为早期、中期和晚期。
1.2.2 分期:根据统一PD评定量表第五部分修订的Hoehn-Yahr(H-Y)分期对患者进行PD严重程度评定分期,共分为5期,其中1~2期为轻度,2.5~3期为中度,4~5期为重度;采用统一PD评定量表(Unified Parkinson’s Disease Rating Scale,UPDRS)Ⅲ部分进行运动功能评分。
1.2.3 帕金森病非运动症状评价量表(NMSS):选取30项问卷调查进行问卷自评,得出每位患者近1个月来每项的发生情况,该量表包含9个方面:心血管、睡眠/疲劳、情绪/认知、感知障碍、注意力/记忆、胃肠道症状、泌尿系统症状、性功能及混合症状。量表由“程度”和“频率”两部分组成,分开评分,根据症状出现给患者带来的痛苦感觉将“程度”分为1~3分;根据症状每周出现的次数将“频率”分为1~4分,分别计算得分,得分越高,NMS的程度越重,出现的频率越高。
1.3统计学方法采用SPSS 20.0软件进行统计学处理,符合正态分布的计量资料组间比较采用t检验;多组资料分析,如方差相等,采用单因素协方差分析(ANCOVA),如有统计学差异,组间采用SNK法进行两两比较,如方差不等,采用秩和检验(Kruskal-Wallis Test)。P<0.05表示差异有统计学意义。PD非运动症状的影响因素用Spearman等级相关分析。
2 结果
2.1 PD伴发NMS人口学特征PD患者共171例,年龄22~87(66.1±11.22)岁,根据临床分型包括男84例(49.13%),女87例(50.87%);早发组34例(19.88%),晚发组137例(80.12%);混合型70例(40.93%),强直型68例(39.77%)及震颤型33例(19.30%);早期70例(40.93%),中期66例(38.60%),晚期35例(20.47%);H-Y分级1~5(2.51±0.82)级;UPDRS III评分(28.64±18.36)分。
2.2 PD伴发NMS的总体发病程度、频率及分布情况171例PD患者中161例出现至少一项NMS症状,发生率为94.15%,无NMS 10例(5.84%)。NMSS(程度)(16.24±12.65)分,NMSS(频率)(25.00±17.90)分。NMSS(程度)最重的前5名包括:入睡困难(0.92)、便秘(0.92)、悲哀(0.85)、白天嗜睡(0.84)及活动的主动性下降(0.82);最轻的5例包括幻觉、幻视(0.27)、体质量改变(0.26)、重影(0.19)、晕厥(0.12)妄想(0.10)。NMSS(频率)最高的前5名包括:入睡困难(54.39%)、白天嗜睡(56.14%)、嗅觉或味觉减退(42.69%)、便秘(52.63%)悲哀(51.46%);最低的5名包括幻觉、幻视(18.71%)、体质量改变(16.37%)、重影 (16.37%)、妄想 (7.6%)、晕厥(7.02%)。
2.3 PD各亚型间NMSS比较
2.3.1 以发病年龄划分的PD亚型之间的NMSS比较:早发组与晚发组比较H-Y分期、UPDRS Ⅲ评分差异无统计学意义(P>0.05),年龄、NMSS(程度)、NMSS(频率)差异有统计学意义(P<0.05),年龄越大,NMS越严重;NMS症状比较,早发组的性生活障碍及情感障碍发生率较晚发组高(性欲下降51.42% vs 18.90%,悲哀74.28% vs 59.10%),其中早发组男性发生性生活障碍者60%。见表1。
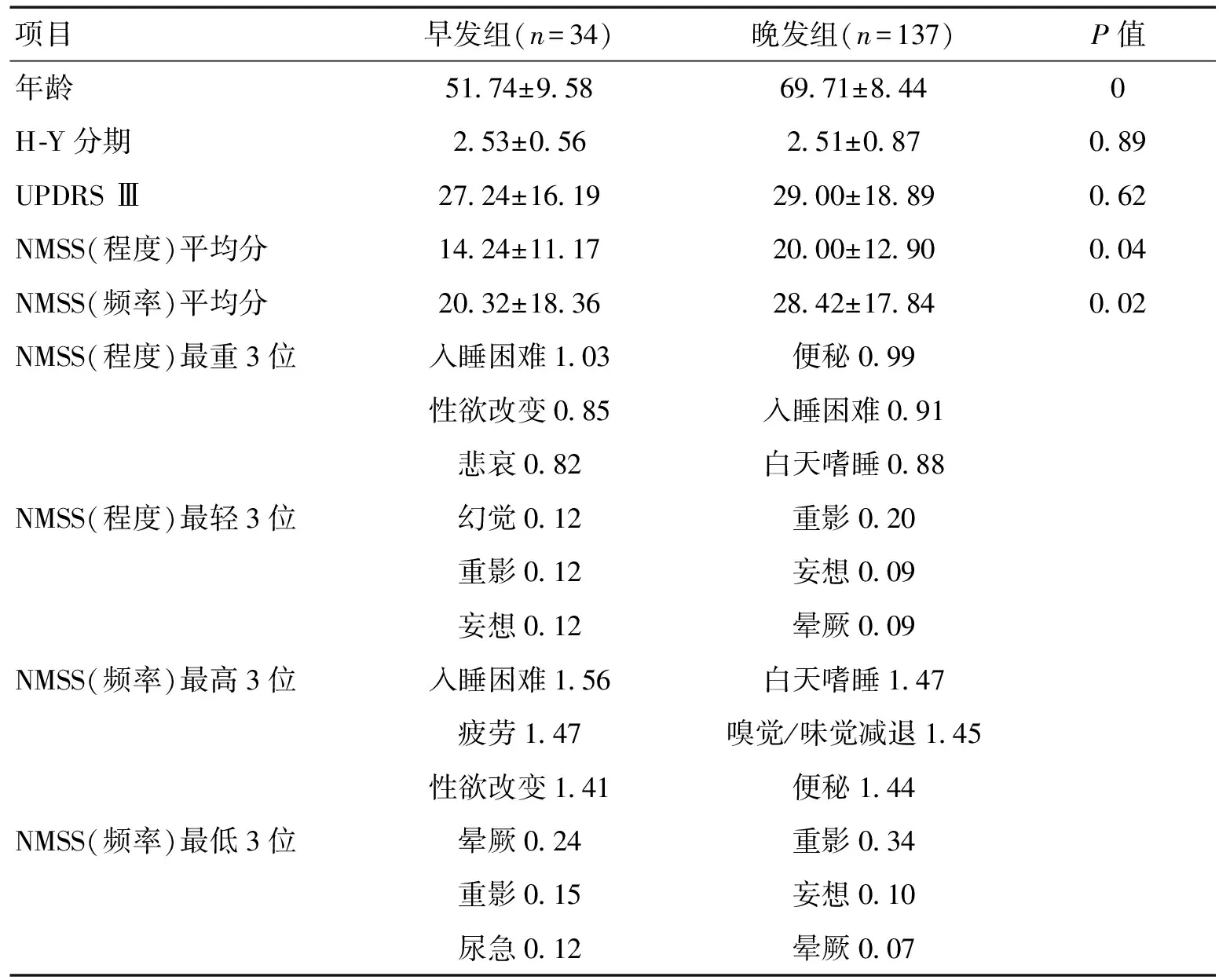
表1 不同年龄组PD患者NMSS评分比较
2.3.2 不同性别PD亚型间NMSS比较:不同性别PD亚型患者年龄、H-Y分期、UPDRS Ⅲ、NMSS(程度)及NMSS(频率)平均分比较差异无统计学意义(P>0.05)。NMS症状提示男性患者睡眠障碍中白天嗜睡发生率稍高、程度稍重(68.33% vs 57.64%);女性患者情感问题更为突出,表现为悲哀(57.95% vs 44.70%),入睡困难2组均高发。见表2。
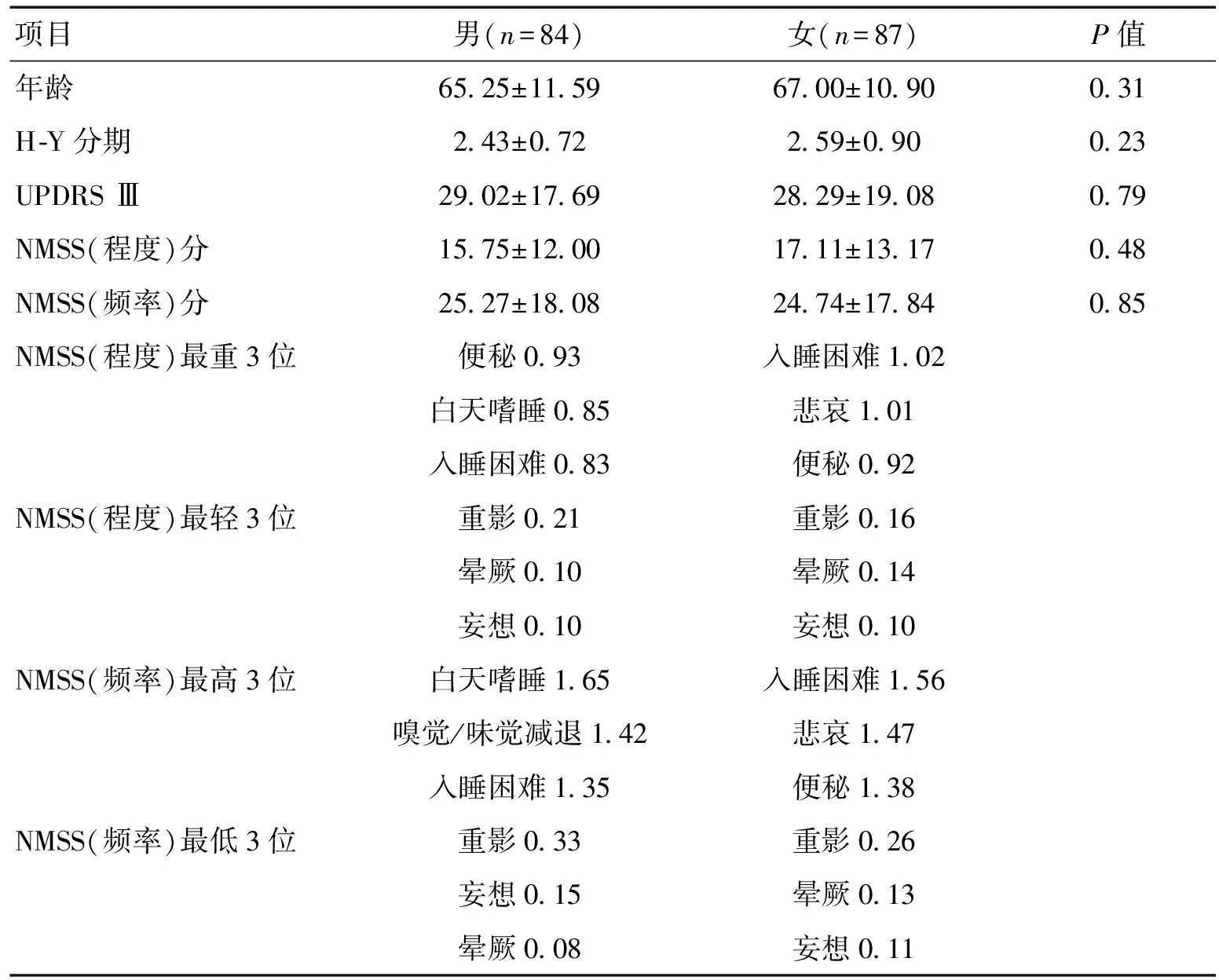
表2 不同性别PD患者NMSS比较
2.3.3 以运动障碍类型划分的PD亚型组NMSS比较:震颤型PD患者H-Y分期较其他2组低,差异有统计学意义(P<0.05),进一步SNK两两比较,混合型与强直型之间无差异;年龄及UPDRS Ⅲ比较差异无统计学意义(P>0.05);震颤型PD患者的NMSS(程度)及NMSS(频率)得分,低于混合型及强直型患者,但差异无统计学意义(P=0.18,P=0.15)。NMSS症状分布震颤型患者出汗增多发生率稍高(45.00% vs 38.89% vs 34.14%);与震颤型不同,混合型与强直型患者悲哀较多(52.44% vs 52.78% vs 30%);本组震颤型患者晕厥、幻觉、妄想无发生(9.76% vs 5.60% vs 0.00%,19.51% vs 15.28% vs 0.00%,8.53% vs 6.94% vs 0.00%)。见表3。

表3 以运动障碍类型划分的PD患者的NMSS比较
2.3.4 以病程划分的PD亚型组NMSS比较:以病程划分的3组PD患者平均年龄方差分析P=0.02,有显著性差异,进一步SNK法两两比较,晚期组年龄高于早、中期组患者;H-Y分期、UPDRS Ⅲ评分、NMSS(程度)及NMSS(频率),3组比较差异有统计学意义(P=0.00),随着年龄增加、病程发展,运动功能减退,NMS无论严重程度或发生率有增高的趋势;而3组NMS表现早期及中期患者仍以睡眠障碍、嗅觉减退及便秘问题为主,而晚期患者情感问题更为突出,表现为悲哀(82.61% vs 53.13% vs 38.37%)、焦虑(69.57% vs 56.25% vs 38.37%)、主动能力下降(69.57% vs 50% vs 38.37%);重影、晕厥、妄想在疾病的全程发生率始终是最低的,但是3组比较,中晚期PD患者发生率仍明显高于早期(26.09% vs 17.19% vs 15.12%,13% vs 10.94% vs 1.16%,18.70% vs 9.38% vs 3.49%)。见表4。
2.3.5 帕金森病非运动症状评价量表(NMSS)评分与各因素相关性分析:Spearman相关性分析显示,PD的NMS发生频率与性别、发病年龄、运动障碍类型无关(r=-0.01,r=-0.08,r=-0.1,r=-0.01,P>0.05),与年龄、病程、H-Y分期、UPDRS Ⅲ评分呈正相关(r=0.23,r=0.43,r=0.51,r=0.40,P=0.00)。
Spearman相关性分析显示,PD的NMS严重程度与性别、发病年龄、运动障碍类型无关(r=0.04,r=-0.04,r=-0.06,r=-0.03,P>0.05),与年龄、病程、H-Y分期、UPDRS Ⅲ评分呈正相关(r=0.25,r=0.39,r=0.51,r=0.38,P=0.00)。

表4 以病程划分的PD患者的NMSS比较
3 讨论
PD的传统发病理论认为,病变仅限于中脑黑质致密部多巴胺能神经元,目前认为PD的病变部位较为广泛,由α-突触核蛋白构成的路易小体异常沉积于特定脑区,造成神经元功能异常,因而临床不仅表现多种运动症状,还存在NMS,如便秘、睡眠障碍、抑郁等[3]。作为PD运动前期阶段的临床生物标志物,近年来人们逐渐认识到NMS对患者的生活质量的负面影响,甚至对某些PD患者而言比运动障碍更具有致残性[4]。
BARONE等[5]研究发现,98.6%的PD患者至少有1项NMS,NMS出现的频率随着病程和疾病严重程度的增加而增加。郑谨等[6]在国内进行的小样本调查研究发现NMS普遍存在于PD各期,各项NMS的发生率随PD患者临床特点的不同而变化。本研究显示,94.15% PD患者出现至少一项NMS症状,且随着疾病的进程逐渐增多及加重,支持NMS始终贯穿于大部分患者疾病始终这一观点。本组统计显示,NMSS(程度)最重的前5名包括:入睡困难、便秘、悲哀、白天嗜睡及活动的主动性下降,NMSS(频率)最高的前5名包括:入睡困难、白天嗜睡、嗅觉或味觉减退、便秘及悲哀;NMSS(程度)及(频率)最低的5名均为幻觉、体质量改变、重影、妄想、晕厥。研究表明,许多非运动症状(如嗅觉异常、便秘、快动眼相睡眠障碍和抑郁)先于PD的运动障碍,其潜伏期可以为20 a或者更长[7]。BRAAK等[3]假设变性过程从脑基底部开始。嗅球可能最先受累,然后影响低位脑干的自主神经功能如睡眠、便秘,接着黑质和中脑其他神经核受累,因此出现了典型的PD 症状,边缘系统和前额叶最后受累,导致认知和精神症状。尽管这种假设没有证实,但很好地解释了PD运动症状和NMS的进展过程。本组患者NMS的出现顺序基本符合BRAAK有关PD患者疾病发生发展的病理假说特点。
本研究以年龄划分的早发组(≤50岁)与晚发组(>50岁)比较,H-Y分期、UPDRS Ⅲ差异无统计学意义,但NMSS的严重度及发生的频率有显著性差异,年龄越大者,非运动症状越多,程度亦越严重,与以往报道一致[8-9]。既往较少学者关注PD患者的性生活情况。本研究显示,性欲减退是早发组发生率最高及程度最重的症状之一,发生率51.42%,其中男性占60%。性功能障碍(sexual dysfunction,SD)男性主要表现为勃起功能障碍,女性表现为性高潮缺乏,国外流行病学显示,男性SD占44%~79%,女性占46.9%~75%[10]。心理学和生理学的因素可以部分解释这种差异,性激素对神经元有明确的影响,雌激素可能减少神经毒物引起的多巴胺神经元缺失,男女在雌激素水平的不同,可能影响到大脑的结构[11]。情绪障碍也是PD患者SD的重要原因,本研究早期组PD患者抑郁情绪机会较高,抑郁是PD及SD常见的神经精神症状[12],可能会导致患者处于一种自卑的状态,且常会影响配偶之间的关系。本研究晚发组SD发生率18.90%,远低于早发组,首先可能是老年患者对该病认识不足,认为SD与本身的年龄增大有关,而非帕金森病引起。年轻的PD患者对性生活质量有更高的要求,更愿意承认及寻求帮助;其次,种族、文化教育背景亦为重要的原因;另外,部分老年患者可能认为难以启齿而选择回避。PD患者的姿势不稳,过去1个月无性交及性欲减退是SD的预测因子[12];另外,可能与年龄、病程、UPDRS Ⅲ、H-Y分期、HAMD、HAMA、NMS评分,甚至药物及NMS其他的症状等因素相关[13]。本组早发型PD患者的SD发生率较高,原因仍需要进一步详细分析。
以性别划分的PD亚型之间的NMS比较,在年龄、H-Y分级、UPDRS Ⅲ、NMSS(程度)及NMSS(频率)评分方面,2组比较差异无统计学意义,显示PD患者的NMS发生与性别无关。但NMS常见症状提示男性患者睡眠障碍中白天嗜睡发生率稍高、程度稍重(68.33% vs 57.64%);女性患者情感问题更为突出,表现为悲哀(57.95% vs 44.70%)。近年文献报道,帕金森病相关睡眠障碍的发病率为38%~96.6%[14-15],PD患者睡眠障碍主要受左旋多巴日剂量高、运动功能差和抑郁情绪影响,其中快动眼睡眠行为异常及睡眠呼吸暂停更以男性多见,本组患者睡眠障碍以男性多见,以白天嗜睡、入睡困难为主,由于未做睡眠呼吸监测检查,不明确快动眼睡眠行为异常及睡眠呼吸暂停是否为白天嗜睡、入睡困难的原因。BREEN等[16]和CAI等[17]研究发现,帕金森病患者呈现一种进行性的生物节律紊乱,如褪黑素、血清皮质醇释放的异常和外周血单核细胞Bmall基因表达节律的紊乱等。值得注意的是,这些节律的异常与PD患者睡眠结构的异常明显相关。以往研究认为,生物节律的异常是PD疾病本身所致。但近期研究表明,生物节律的异常有可能是PD发生、发展的病因之[18]。帕金森病抑郁的发生率目前暂无统一标准,国外报道其发生率波动在2.7%~90%[19],不同研究报道的发生率差异较大,可能与各研究对象的临床特点、所使用的量表及抑郁的诊断标准等因素不同有关。研究认为,在帕金森病早期阶段,蓝斑、延髓中缝核、脑桥相关核团已受损[20],而中缝核、蓝斑等主要为5-羟色胺、去甲肾上腺素能神经元,与抑郁、疲乏等发生相关。KETHARANATHAN等[21]研究认为帕金森病抑郁与女性、文化程度等因素相关,本组女性患者情感问题更为突出,表现为自我感觉悲哀、情绪低落,亦支持这一观点。
本组患者以运动障碍类型划分的PD亚型之间H-Y分级比较提示,震颤型患者运动障碍程度较其他两型较轻;3组患者年龄、UPDRS Ⅲ评分、NMSS(程度)及NMSS(频率)评分差异无统计学意义,但NMSS(程度)及NMSS(频率)评分比较,震颤型患者较其他2组有得分较轻的趋势。具体NMSS症状分布震颤型患者出汗增多(45.00% vs 38.89% vs 34.14%)发生率稍高,其他两型仍以睡眠障碍、情绪、便秘为主。国内有学者统计863数据库,1 510例中国PD患者,发现非震颤为主型:运动损害、运动并发症严重,中等非运动症状;震颤为主型:运动损害轻,进展速度慢,无认知减退、睡眠障碍、抑郁[22]。本组资料基本支持这一结论。另本组震颤型患者出汗增多发生率高,提示汗腺分泌相关的自主神经功能损害可能较其他2组出现较早及较重。MASAAKI等[23]研究提示,疾病早期泌汗异常与植物神经中枢功能异常相关,随着疾病进展脊髓节后神经节功能障碍亦加速病程的进展,出汗异常与抗帕金森药物的使用无关,与情绪不一定相关,但与自主神经功能损害进展有关。
不同病程PD患者平均年龄、UPDRS Ⅲ、H-Y分期、NMSS(程度)及NMSS(频率)评分比较有显著性差异,进一步两两比较,组间均有显著性差异,随着病程发展与运动障碍加重,NMSS发生率及严重度有增高的趋势。3组NMSS具体表现早期及中期患者仍以睡眠障碍、嗅觉减退及便秘问题为主,而晚期患者情感问题更为突出,表现为自我感觉悲哀、情绪低落、焦虑、主动能力下降。虽然重影、晕厥、妄想在疾病的全程发生率始终最低,但中晚期PD患者发生率仍明显高于早期。根据BRAAK等[3]关于PD病理分期和进展的研究结果,不难理解随着PD疾病进展与发病时间延长,路易体按照一定地顺序依次累计迷走神经背核和疑核、红核、中脑黑质、颞叶内嗅皮质和皮质感觉运动区等部位,使得NMS发生数进行性增加。
既往研究证实,NMS发生与病程、UPDRS总分和H-Y分期之间也存在明显相关性,随着疾病的进展,非运动症状出现的种类逐渐增加,两者呈线性相关。H-Y分期与病程是共同的相关因素[24]。本组资料也证实,本组PD患者的NMS发生频率与严重度与性别、发病年龄、运动障碍类型无关,与年龄、病程、H-Y分期、UPDRS Ⅲ评分呈正相关。
与运动症状相比,临床医生往往会忽略患者的非运动症状及其治疗。了解PD临床异质性分类下非运动症状的分布状况,能够帮助神经专科医生及其保健行业同行快速准确的识别,将是决定PD患者及其照顾者生活质量的一个关键性因素。本研究期望能扩大样本量,进一步观察PD不同亚型中可能存在常见的NMS症状差异,及其与神经病理改变之间的关系。
[1] CHAUDHURI K R,MARTINEZ-MARTIN P,SCHAPIRA A H,et al.International multicenter pilot study of the first comprehensive self-completed non motor symptoms question-naire for Parkinson’s disease:the NMSQ uest study[J].Mov Disord,2006,21(7):916-923.
[2] CHAUDHURI KR,MARTINEZ-MARTIN P,BROWN R G,et al.The metric properties of a novel non-motor symptoms scale for Parkinson's disease:Results from an international pilot study[J].Mov disord,2007,22(13):1 901-1 911.
[3] BRAAK H,BOHL J R,MULLER C M,et al.The staging procedure for the inclusion body pathology associated with sporadic Parkinson disease reconsidered[J].Mov Disorder,2006,21(12):2 042-2 051.
[4] ADLER C H.Non motor complications in Parkinson’s disease[J].Mov Disord,2005,20(11):23-29.
[5] BARONE P,ANTONINI A,COLOSIMO C,et al.The PRIAMO study:a multicenter assessment of nonmotor symptoms and their impact on quality of life in Parkin-son's disease[J].Mov Disord,2009,24(11):1 641-1 649.
[6] 郑瑾,孙圣刚,乔娴.帕金森病患者非运动症状的发生状况及影响因素[J].中华老年医学杂志,2010,29(10):796-799.
[7] HAUDHURI K R,HEALY D G,SCHAPIRA A H,et al.Non-motor symptoms of Parkinson’S disease:diagnosis and management[J].Lancet Neurol,2006,5(3):235-245.
[8] GUO X,SONG W,CHEN X,et al.Gender and onset age-related features of non-motor symptoms of patients with Parkinson’s disease e A study from Southwest China[J].Parkinsonism Relat Disord,2013,19(11):961-965.
[9] SPICA V,PEKMEZVIC T,SVETEL M,et al.Prevalence of non-motor symptoms in young-onset versus late-onset Parkinson’s disease[J].J Neurol,2013,260(1):131-137.
[10] BRONNER G.Sexual problems in Parkinson’s disease:the multidimensional nature of the problem and of the intervention[J].J Neurol Sci,201l,310(1/2):139-143.
[11] GILLIES G E,MCARTHUR S.Estrogen actions in the brain and the basis for differential action in men and women:a case for sex-specific medicines[J].Pharmacol Rev,2010,62(2):155-198.
[12] JITKRITSADAKUL O,JAGOTA P,BHIDAYASIRI R.Postural instability,the absence of sexual intercourse in the past month,and loss of libido are predictors of sexual dysfunction in Parkinson’s disease[J].Parkinsonism Relat Disord,2015,21(1):61-67.
[13] 朱骏,沈柏,潘杨,等.帕金森病患者性功能障碍发生率及相关因素分析[J].中华老年医学杂志,2016,35(1):37-42.
[14] WÜLLNER U,SCHMITZ-HÜBSCH T,ANTONY G,et al.Autonomic dysfunction in 3414 Parkinson’s disease patients enrolled in the German Network on Parkinson’s disease(KNP e.V.):the effect of ageing[J].Eur J neurol,2007,14(12):1 405-1 408.
[15] BHIDAYASIRI R,MEKAWICHAI P,JITKRITSADAKUL O,et al.Nocturnal journey of body and mind in Parkinson’s disease:The manifestations,risk factors and their relationship to daytime symptoms.Evidence from the NIGHT-PD study[J].J Neural Transm(Vienna),2014,121(1):59-68.
[16] BREEN D P,VUONO R,NAWARATHNA U,et al.Sleep and circadiall rhythm regulation in eady Parkinson disease[J].JAMA Neuml,2014,71(5):589-595.
[17] CAI Y,LIU S,SOTHEM R B,et al.Epression of clock genes Perl and Bmall in total Leukocytes in health and Parkinson’s disease[J].Eur J Neurol,2010,17(4):550-554.
[18] WILLISON L D,KUDO T,KH D H,et al.Circadian dysfunc-tion may be a key component of the non-motor symptoms of Parkinson’s disease:insights from a transgenic mouse model[J].Exp Neurol,2013,243:57-66.
[19] REIJNDERS J S,EHRT U,WEBER W E,et al.Asystematic review of prevalence studies of depression in Parkinson’disease[J].Mov Disord,2008,23(2):183-189.
[20] BRAAK H,GHEBREMEDHIN E,RUB U,et al.Sta-ges in the development of Parkinson’s disease related pathology[J].Cell Tissue Res,2004,318(1):121-134.
[21] KETHARANATHAN T,HANWELLA R,WEERASUNDERA R,et al.Major depressive disorder in parkinson’s disease:a cross-sectional study from Sri Lanka[J].BMC Psychiatry,2014,14:278.
[22] MA L Y,CHAN P,GU Z Q,et al.Heterogeneity among patients with Parkinson's disease:Cluster analysis and genetic association[J].Neurol Sci,2015,351(1/2):41-45.
[23] HIRAYAMA M.Sweating dysfunctions in Parkin-son's disease[J].J Neurol,2006,253(7):42-47.
[24] 冯维龙,段芳荣,高先彬.帕金森病患者非运动症状发生及相关影响因素的研究[J].卒中与神经疾病,2015,22(5):285-287.
(收稿2017-04-21 修回2017-11-21)
