干旱胁迫对黄秋葵种子萌发的影响
2018-03-19付咪咪李鲜花
付咪咪,李鲜花,李 强
(榆林学院生命科学学院,陕西榆林 719000)
世界上干旱、半干旱地区占地球陆地面积的1/3,我国干旱及半干旱地区约占国土面积的1/2,同时其他半湿润、湿润地区也常发生周期性、季节性或临时性的干旱[1]。这些地区的耕地大部分缺少灌溉,受干旱气候的影响,即使是非干旱地区,由于季节变化,往往也会受到干旱影响。干旱是影响作物生长的三大因素之一,会降低作物的产量,全球范围内,由于受干旱影响造成的作物减产远大于其他因素造成的减产。通常,植物在生长过程中会遇到不良环境条件的影响,在所有的非生物胁迫当中,干旱对农作物造成的损失程度占首位,仅次于病虫害及生物胁迫造成的损失。这些地区降水稀少且变化率大,特殊的地理位置导致地表蒸发量大,严重制约了农业的发展[2-3]。干旱直接导致植物水分亏缺,进而使得植物根系产生渗透胁迫,最终影响植物的生长以及发育,严重时往往会导致植物死亡。如何在现有的干旱和半干旱气候条件下提高作物的产量意义重大。在植物的抗旱性研究中,往往采用室内模拟干旱胁迫条件的方法,其优势在于可控性强,易操作,重复性好。
黄秋葵目前在国际上拥有很高的知名度及关注度。在美国,黄秋葵有着“植物黄金”的美称[4]。黄秋葵种子含有丰富的微量元素,并且富含蛋白质和氨基酸,营养价值较高。黄秋葵的种子除了可以榨油外,还可以用来作水净化中铝盐的替代物;由于其含有1%左右的咖啡碱,可用来替换咖啡豆或作咖啡添加剂[1]。黄秋葵的食用价值较高,其中的嫩荚,具有香味独特、口感滑润不腻、脆嫩多汁等特点,是主要的可食用部分。近年来,随着人们对黄秋葵的熟知和认可,对于其药用方面的研究越来越广泛。黄秋葵还具有很高的药用价值,其性寒、味淡,具有利咽、通淋、调经、下乳等功效[5]。黄秋葵具有抗癌、抗疲劳和增强血管扩张力以及健胃保肝的作用,它的花、种子、根均可入药。表明黄秋葵具有很好的研究和利用价值。
尽管关于植物抗旱性方面的研究方法有多种,但大多是在人为控制的干旱或人工模拟干旱条件下进行。聚乙二醇(PEG)作为一种高分子渗透剂,是一种亲水性很强的大分子有机物,溶于水后能产生强大的渗透压,但不能通过细胞壁进入细胞质,因而不会引起质壁分离,可以人为控制水分进入种子的速率,从而控制种子的吸水速率和发芽进程,使植物组织和细胞处于类似干旱的水分胁迫之中[6]。很多研究都表明,用聚乙二醇模拟植物干旱逆境是可行的。刘自刚等[7]在研究干旱胁迫对桔梗种子萌发的影响、郭鹏辉等[8]在研究干旱胁迫对紫苏种子萌发的影响时,均采用的是聚乙二醇模拟干旱的方法。
目前,对水稻[9]、玉米[10]、大豆[11]等作物抗干旱胁迫机制的研究较多,也培育出一些抗旱作物,但有关蔬菜耐旱机制以及抗性育种的研究较少,黄秋葵具有耐旱、耐高温、适应性广等特点[12]。目前,黄秋葵的研究大多集中在化学成分、生物活性、药理作用以及栽培制种等方面[13],而在黄秋葵种子萌发对干旱环境的适应能力方面的研究较少。模拟干旱胁迫对黄秋葵种子发芽的影响,可为黄秋葵生产提供理论依据和实践参考。
本试验采用聚乙二醇作为水分胁迫剂进行模拟不同程度的干旱胁迫,并且分析干旱胁迫下黄秋葵种子的萌发状况,从而为了解黄秋葵种子对干旱生境的适应机制提供参考。
1 材料和方法
1.1 试验材料
供试材料为台湾五福黄秋葵品种,购自蒲城县种子站。
1.2 试验方法
采用沉水法选取完好无损、籽粒饱满、大小均匀一致的黄秋葵种子。将选好的黄秋葵种子用0.3%的高锰酸钾溶液消毒处理0.5 h,然后用蒸馏水冲洗3次,最后将种子捞出,用滤纸吸干种子表面水分。以铺有双层定性滤纸的培养皿为发芽床,每个培养皿中放入50粒黄秋葵种子,然后分别加入10 mL质量分数为5%,10%,15%,20%,25%的PEG-6000溶液,以蒸馏水为对照,每个处理3次重复。设置培养箱温度设置为(25±1)℃,然后将培养皿置于光照恒温培养箱进行培养。试验开始次日起每天定时观察种子发芽情况(种子胚根长约2 mm视为发芽)并记录统计,观察时向培养皿中添加一定量的蒸馏水,每3 d更换一次滤纸,以保持溶液渗透势恒定。连续进行10 d跟踪观察,记录发芽状态并计算种子发芽率、发芽势以及发芽指数。

式中,Gt为t日的发芽种子数,Dt为相应的发芽天数。
种子萌发试验结束后,从每个处理的每个重复中随机选取5株幼苗植株,用直尺测量其胚根长。
1.3 数据处理
所有数据均采用Excel 2010统计,再通过SPSS 19.0统计软件对不同处理下的发芽率、发芽势、发芽指数、胚根长等各项生长指标进行差异显著性分析。
2 结果与分析
2.1 不同干旱处理对黄秋葵种子发芽率的影响
从表1可以看出,对照组和经5%,10%,15%PEG-6000处理的黄秋葵种子均于着床后第2天开始发芽,经15%的PEG-6000处理的种子于第3天开始发芽,经20%的PEG-6000及25%的PEG-6000处理的种子在整个试验过程中均未见萌发。
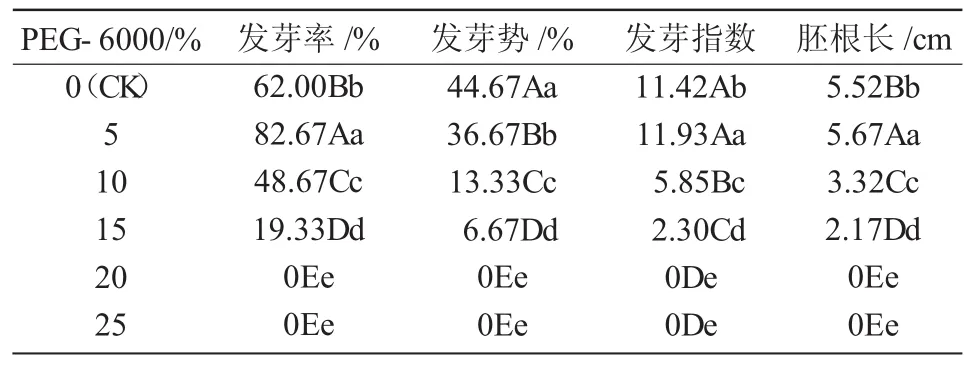
表1 干旱胁迫条件下黄秋葵种子的萌发情况
不同质量分数PEG-6000处理显著影响黄秋葵种子萌发的发芽率,随着PEG-6000质量分数的增加,黄秋葵种子的发芽率呈先升高后降低的变化趋势。5%的PEG-6000处理高于对照组且差异较明显,与对照相比,发芽率上升了20.67百分点,10%的PEG-6000和15%的PEG-6000处理低于对照且差异显著,与对照相比,发芽率分别下降了13.33,42.67百分点。20%的PEG-6000和25%的PEG-6000处理的种子发芽率均为0。
2.2 不同干旱处理对黄秋葵种子发芽势和胚根长的影响
由表1可知,不同质量分数PEG-6000处理显著影响黄秋葵种子萌发的发芽势。随着PEG-6000质量分数的增加,种子发芽势均呈降低趋势,且PEG-6000质量分数越高,其发芽势与对照组的差异越显著,与对照组相比,5%的PEG-6000处理发芽势下降了8百分点;10%的PEG-6000和15%的PEG-6000处理发芽势分别下降了31.34,38百分点;20%的PEG-6000及25%的PEG-6000处理的发芽势均为0。
随着PEG-6000质量分数的增加,黄秋葵种子的胚根长呈先升高后降低的变化趋势。在5%的PEG-6000处理下黄秋葵种子胚根最长,为5.67 cm,比对照组增加了0.15 cm;10%的PEG-6000和15%的PEG-6000处理下胚根长显著降低,与对照组相比,胚根长分别降低了2.2,3.35 cm;20%的PEG-6000和25%的PEG-6000处理时,由于种子均未萌发,故其胚根长为0。
2.3 不同干旱处理对黄秋葵种子发芽指数的影响
如图1所示,5%的PEG-6000处理可以提高黄秋葵种子的发芽指数,与对照组相比,发芽指数提高了 0.51;10%的 PEG-6000和 15%的 PEG-6000处理对黄秋葵种子的发芽指数有抑制作用,与对照组相比,分别降低了5.57和9.12,说明轻度干旱可以适量提高黄秋葵种子的发芽指数,随着干旱胁迫的加强,发芽指数逐渐降低。20%的PEG-6000和25%的PEG-6000处理对黄秋葵种子的发芽完全抑制,其发芽指数为0。

3 结论与讨论
杨旭东等[14]研究认为,低质量分数的PEG处理对向日葵自交系种子的萌发有明显的促进作用。高雪芹[15]研究认为,低浓度的PEG对沙芦草的相对幼根长具有一定的促进作用。陈宝悦等[16]研究结果表明,PEG-6000处理可显著提高芹菜种子的发芽指数和活力指数,使得芹菜种子的发芽更加快速和整齐。本试验研究结果表明,在5%的PEG-6000胁迫处理下,黄秋葵种子的发芽率、发芽指数和胚根长均高于对照组,说明轻度胁迫促进了黄秋葵种子的萌发,这与陈宝悦等[16]对芹菜种子的研究结果一致。
随着干旱胁迫程度的增加,黄秋葵种子发芽率、发芽指数以及胚根长总体呈下降趋势。5%的PEG-6000处理下,黄秋葵的发芽率、发芽指数和胚根长均高于对照组,分别为82.67%,11.93 cm和5.67 cm;10%的PEG-6000和15%的PEG-6000胁迫处理后,与对照组相比,其发芽率、发芽指数及胚根长均显著降低;当PEG-6000质量分数为20%和25%时,种子未萌发。
干旱胁迫对黄秋葵种子萌发阶段的影响不同,5%的PEG-6000胁迫处理下,黄秋葵种子的发芽率、发芽指数以及胚根长均高于对照组,表明黄秋葵幼苗对轻度干旱胁迫具有耐受性,反而会适当地促进萌发。轻度干旱胁迫下仍能维持较强的光合作用以确保植物正常的生长,这与厉广辉等[17]的研究结果类似。高质量分数(10%~25%)的PEG会对其萌发产生抑制作用,并且其危害程度也会随干旱胁迫程度的增加而增加,这与刘志媛等[18]的研究结果相似。抑制作用会随干旱胁迫程度的加深而显著增强,当干旱胁迫达到一定程度时,黄秋葵种子的萌发会完全受到抑制,不能萌发。
当PEG-6000质量分数达到15%时,黄秋葵种子的初始发芽时间均有所延迟。其中,对照组、5%,10%的PEG-6000处理均于第2天开始发芽,15%的 PEG-6000于第 3天开始发芽,20%,25%的PEG-6000处理始终未能发芽,这一结果与吕美婷等[19]研究的不同强度干旱胁迫对红砂种子萌发的影响结果相似。这可能是由于种子萌发时抵抗干旱胁迫而延缓了发芽准备时间导致的。
种子是植物最重要的繁殖材料,在发芽阶段的耐旱状况一定程度上反映了该种子的耐旱能力,种子的发芽状况也是判断种子质量、确定播种量的一项重要指标[4]。因此,种子萌发过程中的发芽率、发芽势、发芽指数等均可以作为判定其耐旱能力的指标。
不同品种对干旱胁迫的响应能力不同,任瑞芬等[20]研究结果表明,干旱胁迫对3种罗勒种子萌发的影响结果不同,不同品种罗勒对干旱胁迫呈现出不同的响应机制。因此,需要用不同品种的黄秋葵进行试验,从而得出更为科学的结论。
[1]张凤银,李方良,谭英.PEG模拟干旱胁迫对凤仙花种子萌发及幼苗生长的影响[J].华南师范大学学报,2014,46(2):114-118.
[2]徐丽,刘迪发,张如莲,等.黄秋葵种子研究进展[J].中国农业通报,2014,30(22):97-101.
[3]王汉杰.我国干旱半干旱地区的退耕还林还草与高效生态农牧业建设[J].林业科技开发,2001,15(1):7-9.
[4]黄修梅,郝丽珍,袁春爱.蒙古高原野韭种子萌发对PEG模拟干旱胁迫的响应[J].种子,2014,33(11):14-17.
[5] 宋立人.中华本草 [M].上海:上海科学技术出版社,1999:4322-4323.
[6]何学青,呼天明,许岳飞,等.PEG-6000模拟水分胁迫对柳枝稷种子萌发及幼苗生长的影响 [J].草地学报,2014,22(3):556-563.
[7]刘自刚,沈冰,张雁.干旱胁迫对桔梗种子萌发及幼苗生长的影响[J].西北农林科技大学学报,2015,43(10):162-168.
[8]郭鹏辉,高丹丹,田晓静,等.干旱胁迫对紫苏种子萌发及幼苗生理特性的影响[J].中国油料作物学报,2015,37(5):683-687.
[9] Wang W,Chen Q,Hussain S,et al.Seed priming in dry direct-seeded rice:consequences for emergence,seedling growth and associated metabolic events under drought stress[J].Plant Growth Regulation,2016,8(2):167-178.
[10] Benhilda Masuka,Jose Luis Araus,Blswanath Das,et al.Phenotyping for abiotic stress tolerance in maize[J].Journal of Integrative Plant Biology,2012,54(4):238-249.
[11] James R,Carl R,Philip J.Drought-stress effects on branch and mainstem seed yield and yield components of determinate soybean[J].Crop Science,2015,44(3):759-763.
[12]曾日秋,洪建基,姚运法,等.黄秋葵资源的植物学特征特性与生态适应性评价[J].热带作物学报,2015,36(3):523-529.
[13]宫慧慧,于倩,王恩军,等.黄秋葵的应用价值和产业化开发前景[J].山东农业科学,2013,45(10):131-134.
[14]杨旭东,聂慧,侯建华,等.PEG模拟干旱胁迫对向日葵种子萌发的影响[J].种子,2016,35(5):71-15.
[15]高雪芹,伏兵哲,穆怀彬,等.PEG-6000干旱胁迫对沙芦草种子萌发特性的影响及其抗旱性评价 [J].种子,2013,32(8):11-16.
[16]陈宝悦,陈子敬,王倩,等.聚乙二醇6000引发对芹菜种子萌发及幼苗生长的影响[J].北方园艺,2016(6):10-13.
[17]厉广辉,张昆,刘风珍,等.不同抗旱性花生品种的叶片形态及生理特性[J].中国农业科学,2014,47(4):644-654.
[18]刘志媛,党选民,曹振木.土壤水分对黄秋葵苗期生长和光合作用的影响[J].热带作物学报,2003,24(1):70-72.
[19]吕美婷,杨九艳,杨明,等.不同干旱胁迫对红砂种子萌发的影响[J].中国草地学报,2010,32(6):58-62.
[20]任瑞芬,任才,武曦,等.干旱胁迫对三种罗勒种子萌发的影响[J].山东农业大学学报,2015,35(6):614-618.
