人源性抗食管癌细胞单链抗体的表达纯化及活性鉴定
2018-03-19乔媛媛瞿秀华王欲晓周丽君张达矜
乔媛媛,熊 鸣,瞿秀华,王欲晓,周丽君,张达矜
食管癌是常见的恶性肿瘤,年死亡率居恶性肿瘤的第六位,严重危害人类健康。食管癌由于缺乏有效的检测标志物和靶向治疗药物,5年的生存率仅有10%[1]。噬菌体抗体库是筛选获得人源抗体的重要技术平台。将基因型与表型集中于一体,将选择能力与扩增能力偶联起来,在体外环境模拟体内抗体形成过程,具有较强的筛选能力[2]。单链抗体避免了传统的单克隆抗体免疫原性强、穿透力弱等缺点,在血清学检测和靶向治疗方面有较大的应用潜力。
本研究以完整活细胞为靶,利用噬菌体抗体展示技术筛选食管癌细胞的抗体,得到抗食管癌细胞表面抗原的单链抗体[3-4]。将两株携带噬菌体单链抗体的基因进行改造,转化到大肠杆菌BL21(DE3)中后,通过优化培养条件使目标蛋白表达,获得重组的抗体蛋白。利用人源大容量噬菌体抗体库筛选肿瘤细胞抗体的策略,为食管癌的检测标志物和靶向治疗药物的研发和应用奠定基础。
1 材料与方法
1.1 材料 大肠杆菌BL21(DE3)、DH5α和pET-28a、pET-SUMO质粒、Mix PCR试剂、DNA凝胶纯化试剂盒(购自TIANGEN公司);Bio-teke多功能DNA纯化回收试剂盒购自北京百泰克公司;Pfu DNA聚合酶为美国Thermo Fisher Scientific产品;T4 DNA连接酶、限制性内切酶(BamHI、NotI和CpoI)、异丙基-β-D-硫代吡喃半乳糖苷(isopropyl β-D-thiogalac-toside,IPTG)购自Fermentas公司;Anti-Flag、盐酸胍、咪唑为美国Sigma公司产品;Anti-SUMO为天津三箭公司出品;Yeast Extract和Tryptone为英国OXOID产品;各种盐类试剂购自国药集团化学试剂有限公司;实验用水为美国Millipore纯水系统生产。抗食管癌肿瘤细胞表面抗原ScFv表达质粒由本室构建,质粒提取采用碱裂解法;电泳及酶标仪为美国Bio-Rad公司设备。
1.2 方法
1.2.1 目的基因的扩增 抽提NFC20b、NFC70a单链抗体基因重组质粒,进行PCR扩增,NFC20b扩增引物序列如下:
Forward P:5′-CAGGAAACAGCTATGAC-3′
Reverse P:5′-GAATTTTCTGTATGAGG-3′
NFC70a扩增引物序列:
Forward P:5′-CTGCCGGTCCGTCTGTGCTGACGC-3′
Reverse P:5′-CTGCGCGGCCGCTGAGGAGACG-3′
配制150 μL PCR反应体系:NFC20b质粒模板15 μL、引物各8 μL、Mix混合液75 μL、双蒸水44 μL;反应条件为94 ℃预变性3 min、98 ℃变性10 s、55 ℃退火15 s、72 ℃延伸1 min,30个循环后72 ℃延伸10 min。NFC70a质粒模板15 μL、引物各8 μL、Mix混合液75 μL、ddH2O 44 μL;反应条件为94 ℃预变性3 min、95 ℃变性15 s、55 ℃退火15 s、72 ℃延伸1 min,30个循环后72 ℃延伸10 min。分别取两者扩增产物进行琼脂糖凝胶电泳检测,并用Bio-teke多功能DNA纯化回收试剂盒回收PCR产物。
1.2.2 表达质粒的构建及其转化 用NotI和BamHI内切酶双酶切pET-28a质粒和NFC20b的PCR扩增片段并以T4 DNA连接酶连接,连接产物转化大肠杆菌E.coliBL21(DE3)感受态细菌。NotI和CpoI内切酶双酶切pET-SUMO质粒和NFC70a的PCR扩增片段并以T4 DNA连接酶连接,连接产物转化TOP10感受态细胞。转染后挑取克隆,由诺赛基因公司测序鉴定,测序正确的重组质粒分别命名为pET-NFC20b,pET-NFC70a。
1.2.3 单链抗体重组基因的表达鉴定 挑选含重组质粒的多个大肠杆菌单菌落至3 mL含卡那的LB液体培养基中,37 ℃震荡培养至600 nm波长处的吸光值OD600约0.6。取部分菌液作为对照组,余下菌液加入IPTG至终浓度0.5 mmol/L,37℃震荡培养3 h。留样后收集菌体,12 000 rpm离心2 min,菌体沉淀以40 μL 1×上样缓冲液重悬裂解,十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)检测,筛选最优化的蛋白诱导表达条件。
1.2.4 单链抗体重组蛋白大量表达 取SDS-PAGE检测有表达的克隆菌液100 μL接种于100 mL含卡那的LB液体培养基中震荡培养过夜。取100 mL菌液接种于2 L LB液体培养基中,37 ℃扩大培养至OD600约0.6,降低培养温度到18 ℃,加入IPTG诱导剂至终浓度0.5 mmol/L,继续震荡培养3 h。8 000 rpm离心3 min收集菌体,重悬于50 mL预冷NTA-0缓冲液中,冰浴30 min。超声破碎菌体,参数设置为功率200 W、工作3 s、暂停4 s、99个循环。16 000 rpm 4℃离心50 min,收集上清液以及沉淀,取少量上清液及沉淀进行SDS-PAGE检测。
1.2.5 包涵体蛋白的处理 SDS-PAGE检测确定重组蛋白以包涵体形式进行表达。将菌体破碎离心后的沉淀用50 mL NTA-0缓冲液重悬,加入二硫苏糖醇至终浓度1 mmol/L。超声促进蛋白溶解,设置参数为功率200 W、工作3 s、暂停3 s、99个循环。超声处理后用10 000 rpm 4 ℃离心10 min,去上清液。重复以上步骤至上清液透明。去上清,以3 mL 6M盐酸胍重悬包涵体,加二硫苏糖醇至终浓度5 mmol/L,220 rpm 37 ℃震荡3 h至包涵体全部溶解。10 000 rpm 4 ℃离心10 min,取上清液进行SDS-PAGE检测。
1.2.6 包涵体蛋白的复性 以2倍体积的3M盐酸胍稀释蛋白溶液,在4℃环境下用注射器慢速地逐滴加入到200 mL复性液(pH 8.0)中,转速调节至最大,搅拌24 h。降低转速再搅拌24 h,取蛋白溶液于透析袋中,以PEG20000浓缩体积至100 mL。4 ℃以磷酸盐缓冲液(phosphate buffered saline,PBS)透析过夜,以PEG20000浓缩体积至4 mL。再次于4℃用PBS缓冲液透析过夜,取蛋白溶液进行SDS-PAGE检测。
1.2.7 复性蛋白纯化 蛋白溶液用0.22 μm过滤器过滤备用,准备Ni-NTA柱,以1 mL/min的流速上样上清蛋白溶液,以NTA-0缓冲液(pH 8.0)洗柱至流出液不含蛋白(G250检测液不变色);分别以20 mmol/L、60 mmol/L、200 mmol/L和500 mmol/L咪唑洗脱,分段收集洗脱液至G250检测液不变色,对收集的洗脱液进行SDS-PAGE电泳检测。
1.2.8 复性后抗体蛋白的生物学活性 食管癌细胞系KYSE-170、KYSE-150及肝癌细胞系SMMC7721细胞,各以5×104/孔细胞数接种96孔细胞培养板,培养1 h后水平离心,弃去上清液,用4%多聚甲醛固定30 min后,经PBS洗涤3次。用2.5%脱脂奶粉-PBS封闭,加入NFC20b和NFC70a蛋白及阴性对照卵清蛋白,每孔约0.5 μg,37 ℃孵育1 h后,用含0.05%Tween20的PBS洗涤3次后,加入二抗,NFC20b蛋白加入Anti-Flag,MFC70a加入二抗Anti-SUMO,浓度均以1∶1 000稀释,充分洗涤后,加入HRP-羊抗小鼠IgG,37 ℃反应1 h后加入OPD底物显色,20%硫酸终止后,酶标仪读取A490吸光度值。
2 结果
2.1 pET-NFC20b和pET-NFC70a表达质粒的构建分别用NFC20b、NFC70a质粒为模板,分别用引物扩增得到750 bp目的基因片段,NFC20b质粒用NotI和BamHI双酶切后与原核表达载体pET-28a进行连接,NFC70a质粒用NotI和CpoI双酶切后与原核表达载体pET-SUMO进行连接。转化感受态细胞后铺琼脂糖培养盘,挑取克隆,用相应的引物进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,电泳检测结果显示插入载体的750 bp片段与预期片段大小一致,测序结果显示插入的外源基因与ScFv基因序列完全相同,说明成功构建了pET-NFC20b和pET-NFC70a重组质粒(图1)。
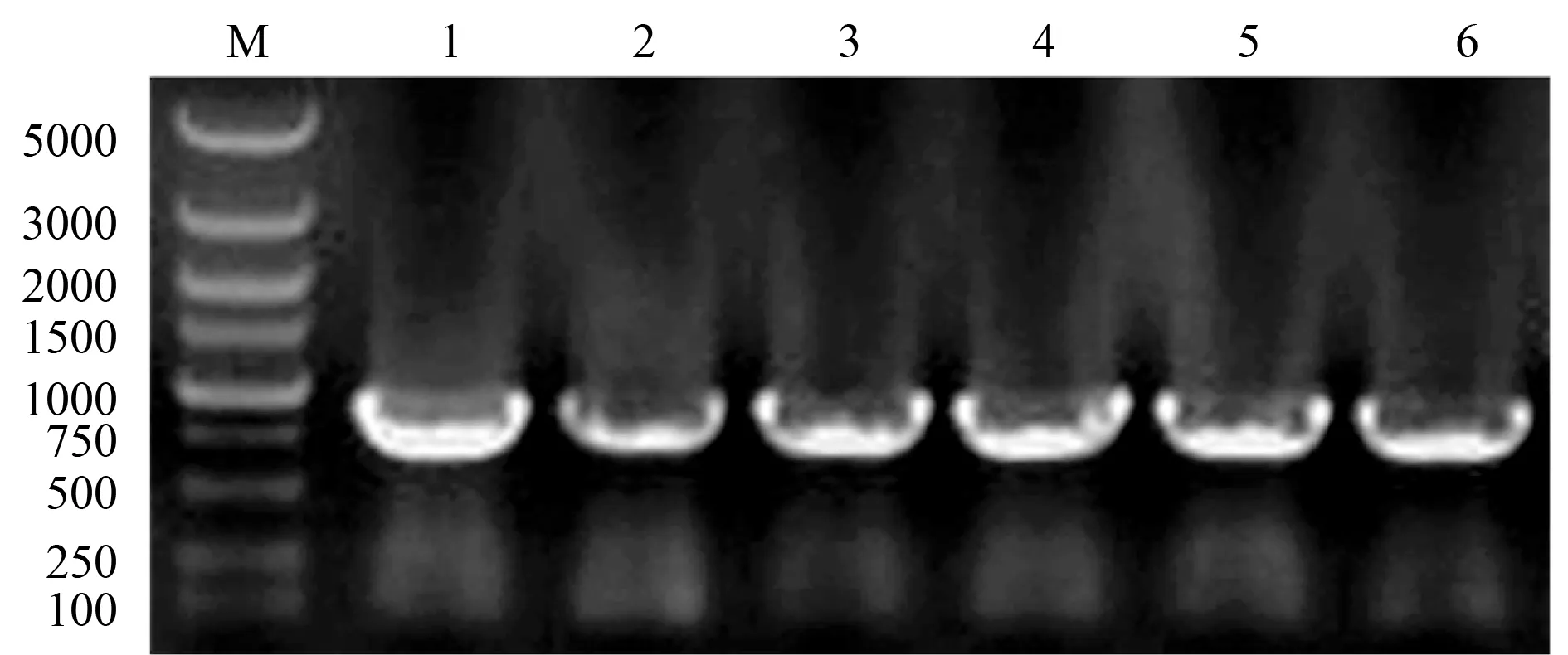
M:marker;1-3:pET-NFC20b重组质粒的PCR鉴定;4-6:pET-NFC70a重组质粒的PCR鉴定图1 pET-NFC20b和pET-NFC70a重组质粒PCR鉴定
2.2 单链抗体基因的原核表达 挑选含重组质粒的单菌落进行小量培养,取部分菌液作为诱导阴性对照,实验组加入IPTG诱导剂至终浓度为1 mmol/L,经3 h培养后离心取菌体裂解后进行SDS-PAGE检测,结果显示IPTG的诱导下重组蛋白进行了表达(图2)。
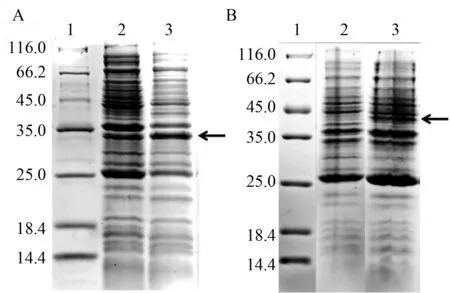
A:1,marker;2,pET-NFC20b的未诱导全菌蛋白;3,IPTG诱导全菌蛋白。B:1,marker;2,pET-NFC70a的未诱导全菌蛋白;3,IPTG诱导全菌蛋白箭头所指为表达的重组蛋白图2 pET-NFC20b和pET-NFC70a诱导与未经诱导阳性菌株全菌蛋白SDS-PAGE电泳图
2.3 包涵体表达 取保存的阳性克隆菌株进行扩大培养,收集菌体后进行破碎释放蛋白,经高速离心,取上清和沉淀即不溶性大小进行SDS-PAGE检测,结果显示重组蛋白主要以包涵体形式进行表达(图3)。
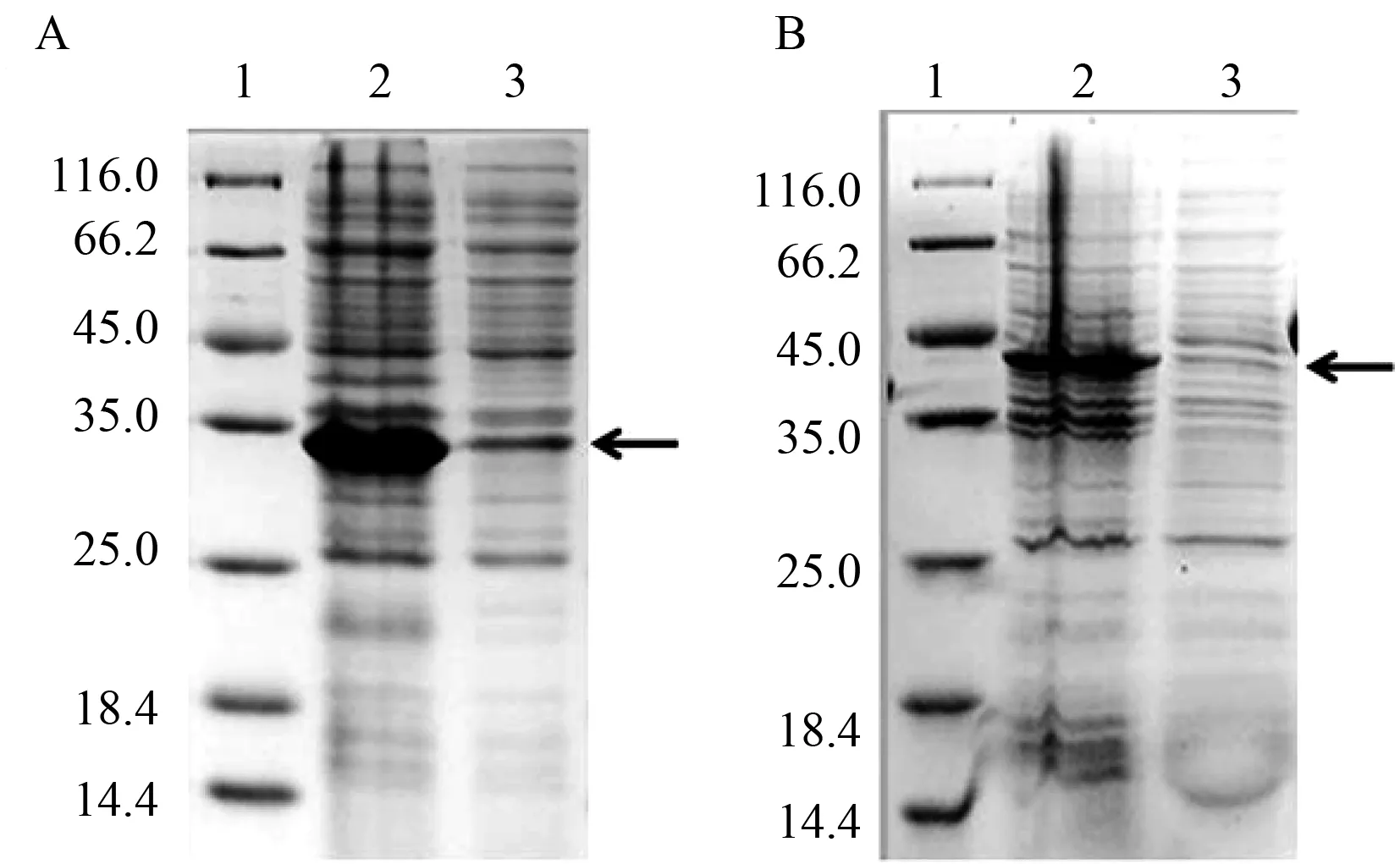
A:1,marker;2,pET-NFC20b诱导表达破碎后的不溶蛋白;3,诱导表达破碎后的上清蛋白。B:1,marker;2,pET-NFC70a诱导表达破碎后的不溶蛋白;3,诱导表达破碎后的上清蛋白箭头所指为表达的重组蛋白图3 pET-NFC20b和pET-NFC70a大量表达的菌体破碎上清液及沉淀SDS-PAGE电泳图
2.4 包涵体复性及纯化 蛋白纯化将包涵体溶解后进行滴定复性,得到的可溶性重组蛋白经过镍柱复性技术,得到纯度更高的重组,大量表达获得的重组蛋白包涵体经复性及Ni-NTA纯化技术纯化得到重组蛋白2 mg,重组蛋白纯度为90%。经SDS-PAGE检测可知纯化后的包涵体蛋白纯度达到90%,考马斯亮蓝染色几乎未见明显杂带(图4)。
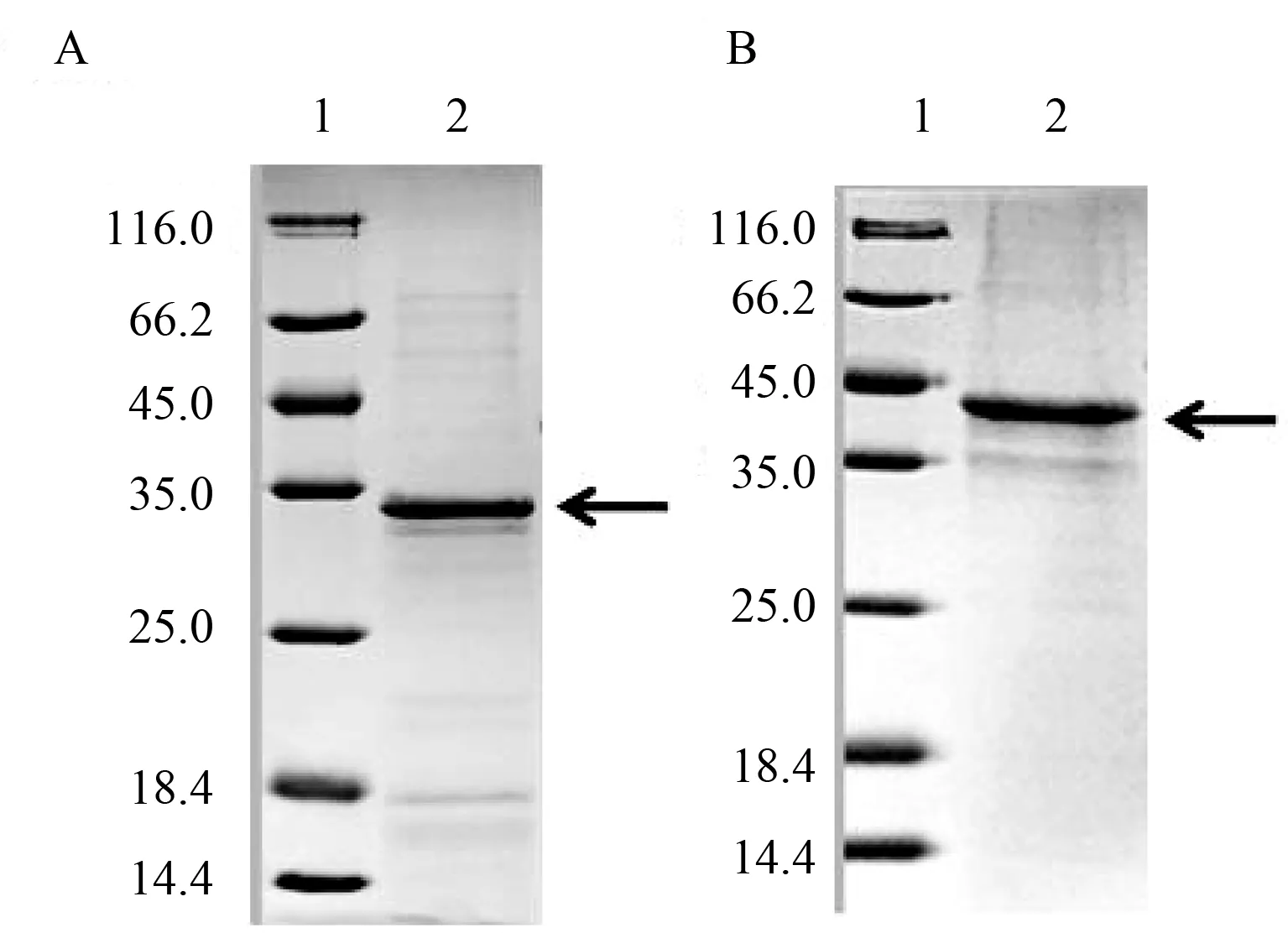
A:1,marker;2,pET-NFC20b咪唑洗脱蛋白。B:1,marker;2,pET-NFC70a咪唑洗脱蛋白。箭头所指为洗脱纯化的蛋白。图4 pET-NFC20b和pET-NFC70a咪唑洗脱蛋白的SDS-PAGE电泳图
2.5 复性后抗体蛋白的生物学活性 将上述制备表达的NFC20b和NFC70a蛋白进行细胞ELISA的实验,鉴定其生物学活性。用卵清蛋白(ovalbumin,OVA)作为对照鉴定其特异性,结果显示表达的NFC20b和NFC70a单链抗体可以与相应的食管癌细胞系KYSE-170、KYSE-150及肝癌细胞系SMMC7721等细胞结合,具有肿瘤细胞的生物学活性,同时与人肺泡上皮细胞A549也有结合(表1)。
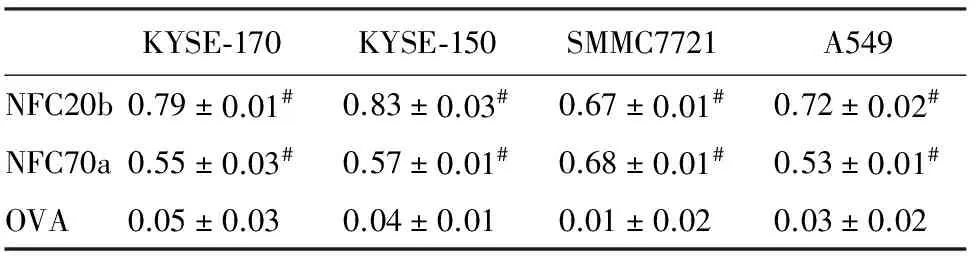
表1 复性后蛋白与不同肿瘤细胞的结合活性
注:与OVA组比较,#P<0.05
KYSE-170,KYSE-150:食管癌肿瘤细胞;SMMC7721:肝癌细胞;A549:人肺泡上皮细胞
3 讨论
重组蛋白在生物医药研究中的应用增加,原核生物、酵母、哺乳动物细胞等表达重组蛋白系统发展迅速。原核生物表达系统,主要是大肠杆菌表达系统,具有操作简便、遗传背景清楚、表达成本低、周期短且表达蛋白水平高等优点,是重组蛋白药物研究和生产中使用最广泛的表达系统。大肠杆菌表达系统目前有融合表达、非融合表达、分泌表达、带纯化标签的表达载体等,而融合表达载体又有pET系列、pTYB、pGEM及pGEX等[5-6]。用于表达的载体类型很多,在实际研究中,要根据需求选择合适的、高效稳定的表达载体。
本研究运用了pET-20a表达载体构建NFC20b蛋白的表达载体,pET系列应用较广泛,但对有些蛋白的表达却不是很理想,本研究中的一个蛋白用此载体就没有得到表达。而其他一些融合蛋白表达系统蛋白表达量虽然很高,但多数表达的目的蛋白可溶性较差。这就要求我们去寻找更多的高效稳定、可溶性较好的表达系统以满足不同类型基因的表达。
我们采用相关的载体研究本实验中一个蛋白。SUMO是一种小分子泛素修饰蛋白,广泛存在于各种真核细胞中,参与调解细胞凋亡、信号转导、RNA转录、蛋白的核质运输及其细胞周期等生理进程[7]。SUMO有约100个氨基酸组成的保守多肽家族,近年来作为重组蛋白表达的融合标签和分子伴侣,具有抗蛋白酶水解、增加蛋白表达量,增加重组蛋白的正确折叠等作用,为重组蛋白的纯化奠定基础[8-10]。本研究应用了SUMO作为融合标签和分子伴侣,与NFC70a融合表达,使重组蛋白能够在原核表达系统中正确表达折叠,经SDS-PAGE和Western blot鉴定,获得了纯度较高的成熟蛋白。细胞ELISA鉴定具有一定的生物学活性。
在37 ℃的条件下诱导3 h得到的融合蛋白的表达量最高,经蛋白的可溶性分析,目标蛋白主要以包涵体形式存在。本研究将SUMO和表达基因融合,而SUMO可以和Ni2+结合,为蛋白通过Ni金属亲和层析纯化带来便利,从而获得较纯的重组蛋白。
大肠杆菌表达的外源蛋白质可高达菌体总蛋白质的50%,但是高表达的重组蛋白质会相互交联在一起形成包涵体[11]。包涵体比较复杂,由膜包裹的高密度、不溶的蛋白质颗粒,与胞质内蛋白质生成速率有关,还被认为是与宿主菌的培养条件等因素有关。包涵体内的蛋白是非折叠状态的聚集体,不具有生物学活性,要得到具有生物学功能的蛋白必须将包涵体变性,并进行蛋白质的复性。包涵体复性是蛋白制备的难题,不同的蛋白复性条件各不相同,很多学者对包涵体的形成及复性的各种合适条件进行研究。我们使用6M的盐酸胍处理,使包涵体更好地溶解,采用含有2M尿素的谷胱甘肽氧化还原复性缓冲液体对蛋白进行复性。重组的目的蛋白C端带有His标签,可与带有镍离子(Ni2+)的亲和层吸柱螯和,洗脱纯化重组蛋白。经Ni-NTA柱纯化后获得了纯度为90%的变性蛋白,得到的纯化重组蛋白采用间接细胞ELISA法检测其结合活性,结果显示蛋白与食管肿瘤细胞系能够结合。
本研究通过人源的大容量抗体库筛选食管癌细胞相关抗原的抗体的方法,得到两个抗食管癌肿瘤细胞表面抗原单链抗体NFC20b和NFC70a,是经过白细胞差减淘筛,经细胞ELISA鉴定能与食管癌细胞等上皮来源的细胞膜有特异性结[12],可以将大容量抗体库中筛选的抗体作为肿瘤检测的标志物,因此通过噬菌体抗体库筛选肿瘤细胞抗体是切实可行的策略。
之后通过载体构建,原核细胞内实现抗体蛋白的表达,又综合包涵体变性、复性、纯化等步骤,为今后食管癌的检测及治疗方面的应用研究奠定了基础。
[1] Kim T,Grobmyer SR,Smith R,et al.Esophageal cancer-the five year survivors[J] .J Surg Oncol,2011,103(2):179-183.
[2] Sørensen KM,Meldgaard T,Melchjorsen CJ,et al.Upregulation of Mrps18a in breast cancer identified by selecting phage antibody libraries on breast tissue sections[J] .BMC Cancer,2017,17(1):19.
[3] Bedi D,Gillespie JW,Petrenko VA.Selection of pancreatic cancer cell-binding landscape phages and their use in development of anticancer nanomedicines[J] .Protein Eng Des Sel,2014,27(7):235-243.
[4] Wu CH,Liu IJ,Lu RM,et al.Advancement and applications of peptide phage display technology in biomedical science[J] .J Biomed Sci,2016,23(1):8.
[5] 谢琳,巫国辉,李小林,等.构建重组人pET-32a-瘦素高效的表达载体[J] .中国组织工程研究,2012,16(37):6926-6930.
[6] 李秀红,刘海龙,曹瑞致,等.丹参水杨酸结合蛋白基因的克隆、表达分析[J] .生物技术,2016,26(5):426-431.
[7] Marblestone JG,Edavcttal SC,Lim Y,et al.Comparison of SUMO fusion technology with traditional gene fusion systems:enhanced expression and solubility with SUMO[J] .Protein Sci,2006,15(1):182-189.
[8] Butt TR,Edavettal SC,Hall JP,et al.SUMO fusion technology for difficult-to-express proteins[J] .Protein Expr Purif,2005,43(1):1-9.
[9] 杜彩萍,王梅,段富刚,等.活化型及失活型SUMO1真核表达载体的构建及鉴定[J] .生物技术,2014,24(5):12-16.
[10] Wang W,Chen Y,Wang S,et al.PIASxα ligase enhances SUMO1:modification of PTEN protein as a SUMO E3 ligase[J] .J Boil Chem,2014,289(6):3217-3230.
[11] 麻粉莲,张骞,郑丽舒.人乳头瘤病毒18型L1蛋白的包涵体和可溶性表达及纯化[J] .生物技术通讯,2014,25(6):800-803.
[12] Qiao Y,Zhou L,Wang Y,et al.Screening for antibodies against intact cancer cells with a naïve large phage antibody library[J] .Int J Mol Med,2012,29(1):37-46.
