重组人粒细胞集落刺激因子对实验性自身免疫性脑脊髓炎小鼠的治疗作用
2018-03-19樊心童许春阳张达矜乔媛媛李金凤尹红蕾段海峰王运良
王 震,樊心童,许春阳,张达矜,乔媛媛,李金凤,尹红蕾,段海峰,王运良
多发性硬化是一种中枢神经系统的自身免疫性白质炎性脱髓鞘病变,具体发病机制尚未完全阐明,目前认为可能是一些携有先天遗传易感基因的个体有易发生免疫调节功能紊乱的趋势,在后天环境中外因的作用下,诱发对中枢髓鞘成分的异常自身免疫应答而致病[1]。目前世界上多发性硬化的急性期治疗主要是大剂量糖皮质激素冲击、静脉注射免疫球蛋白和血浆置换,缓解期治疗主要采用β-干扰素和芬戈莫德等药物治疗,但是上述方法效果并不理想,并且有一定的副作用。
近年来发现粒细胞集落刺激因子(granulocyte colony stimulating factor,G-CSF)在诱导免疫耐受方面有重要作用[2],能够影响非特异性免疫和特异性免疫[3]。因此,本研究采用人粒细胞集落刺激因子(recombinant human granulocyte colony stimulating factor,rhG-CSF)皮下注射实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)小鼠经典模型[4],旨在观察rhG-CSF在多发性硬化疾病过程中的免疫调节作用,为多发性硬化临床方案的优化提供新的思路。
1 资料和方法
1.1 一般资料 无特定病原体级6~8周健康雌性C57BL/6小鼠[SCXK号-(京)2014-0006] 购买于斯贝福(北京)生物技术有限公司,饲养于军事医学科学院动物房内。百日咳毒素(pertussis toxin,PTX)、弗氏完全佐剂(complete Freund’s adjuvant,CFA)、兔抗多克隆抗体胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)和碱性髓鞘蛋白(myelin basic protein,MBP)均购自美国Sigma公司;MOG35-55(纯度>95%)购自北京中科亚光生物科技有限公司;rhG-CSF购买于齐鲁制药有限公司;荧光单克隆抗体抗PE-NK-1.1、APC-CD3、FITC-CD4、APC-CD25、PE-Foxp3购自美国Biolegend公司;流式细胞仪购自美国Biosciences公司。
1.2 方法
1.2.1 EAE小鼠模型构建及分组 参照文献[5-7] 建立EAE小鼠模型。40只小鼠根据体重随机分为2组:一组10只作为正常对照组不作处理,另一组30只制备EAE模型。在造模的过程中小鼠死亡6只,根据神经功能评分将剩余的24只小鼠随机分为治疗组(12只)和模型组(12只)。从免疫后第15天开始,治疗组皮下注射rhG-CSF 200 μg/d,连续注射14 d。EAE组和对照组小鼠给予相同体积的生理盐水作为对照。
1.2.2 EAE小鼠神经功能评分 第0~28天用双盲法对所有小鼠神经功能缺损评分(一共持续评分28 d):不发病记为0分,尾巴张力降低或轻度步态笨拙记为1分,后肢力量轻度减弱记为2分,后肢力量明显减弱记为3分,后肢瘫痪记为4分,后肢瘫痪合并前肢力量减弱或濒死状态记为5分。评分标准可参考文献[8] 。
1.2.3 病理学观察 第29天将所有小鼠处死,从每组中随机抽取5只小鼠进行脊髓组织学观察。打开腹腔解剖出脾脏,在磷酸缓冲盐溶液(phosphate buffer saline,PBS)中浸泡,解剖出脑和脊髓做成石蜡切片,用苏木精—伊红染色法(hematoxylin-eosin staining,HE)染色和劳克坚劳蓝(luxol fast blue,LFB)染色观察脊髓炎性细胞浸润和脊髓脱髓鞘的改变。
1.2.4 EAE小鼠脾脏Treg细胞和NK细胞的检测第29天,取上述5只小鼠的脾脏研磨后制成单细胞悬液,每份细胞悬液约含1107个细胞,用PE-NK-1.1、APC-CD3抗体避光室温孵育30 min,用PBS洗2次,然后用500 μg PBS重悬上机检测;然后去上述细胞悬液,用FITC-CD4、APC-CD25抗体避光4 ℃孵育30 min,固化液固化,再用透化buffer洗涤,加入Fc阻断剂避光4 ℃孵育15 min,最后加入PE-Foxp3避光4℃孵育30 min,然后洗涤重悬上机检测。通过流式细胞仪检测,并用FlowJo软件分析数据。CD3阴性,NK-1.1阳性的象限即为自然杀伤(natural killer,NK)细胞的比例,CD4、CD25、Foxp3阳性的象限即为调节性T(regulatory T,Treg)细胞的比例。
1.2.5 Western blot 检测EAE小鼠脊髓GFAP和MBP的表达 冰上分离小鼠脊髓,将组织置于裂解液中,反复冻融离心提取组织总蛋白;蛋白定量采用BCA-200蛋白定量试剂盒;每个样品取20 μg,与上样缓冲液和二硫苏糖醇以8∶10∶2比例混匀,煮沸变性5 min,进行12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳和转膜;将膜用5%的脱脂牛奶封闭1 h,用兔抗胶质纤维酸性蛋白和髓鞘碱性蛋白抗体4 ℃杂交过夜;充分洗去未结合抗体,加入抗兔的辣根过氧化物酶标记继续室温孵育1 h,用增强型化学荧光素显色。
1.2.6 统计学处理 应用SPSS 10.0软件。2组间比较用t检验,3组间比较采用F检验,以P<0.05认为差异有统计学意义。通过图像-Pro Plus5.0快速图像分析仪对Western blot结果进行分析,用Photoshop分析A图的灰度值,除去内参对目的条带的影响,以对照组的灰度值作为单位1,对目的条带进行比较得出相对灰度值。
2 结果
2.1 小鼠的神经功能评分 各组小鼠的神经评分见图1。对照组神经功能正常,评分为0;从第12天开始,EAE造模小鼠开始出现发病的迹象,主要表现为运动迟缓和后肢瘫痪,尾巴下垂且拖地。第13天,治疗组和对照组神经功能评分开始出现显著差异(t=2.375,P<0.05);第21天,治疗组和模型组神经功能评分出现显著差异(t=2.032,P<0.05)。第24天治疗组发病达到高峰期,但临床症状较模型组明显减轻;模型组第25天发病达到最高峰表现为蹒跚步态,后肢完全瘫痪,严重的前肢也表现无力。

图1 各组小鼠的神经功能评分
2.2 小鼠的脊髓组织学变化 对照组小鼠脊髓组织学表现正常,未发现炎性细胞浸润和脱髓鞘的改变,脊髓炎性细胞浸润评分和脱髓鞘评分均为0。HE染色结果显示模型组小鼠的脊髓炎性浸润细胞明显著,经rhG-CSF治疗后炎性浸润细胞显著减少(如箭头所示)评分为2.80±0.45。LFB染色显示对照组小鼠脊髓髓鞘排列紧密,且着色深,评分为3.0±0.70,模型组小鼠脊髓脱髓鞘情况严重,治疗组髓鞘脱失情况显著改善。与模型组相比,治疗组小鼠炎性细胞浸润显著改善,评分为2.80±0.45(t=3.796,P=0.005),脱髓鞘程度也显著改善(t=3.201,P=0.013),且差异有统计学意义,评分为1.80±0.44。见图2。
2.3 小鼠脾脏Treg细胞和NK细胞比例的比较 3组小鼠之间Treg细胞和NK细胞比例的比较(见图3)。治疗组NK细胞的比例明显低于模型组(t=4.325,P=0.003)。治疗组与对照组相比,NK细胞比例明显升高(t=2.032,P=0.049)。3组间进行方差分析F=15.741,P=0.0004。治疗组Treg细胞明显比模型组升高(t=3.463,P<0.05)。治疗组Treg细胞比例高于对照组(t=2.358,P=0.046),3组间进行方差分析,F=10.879,P=0.002(表1)。
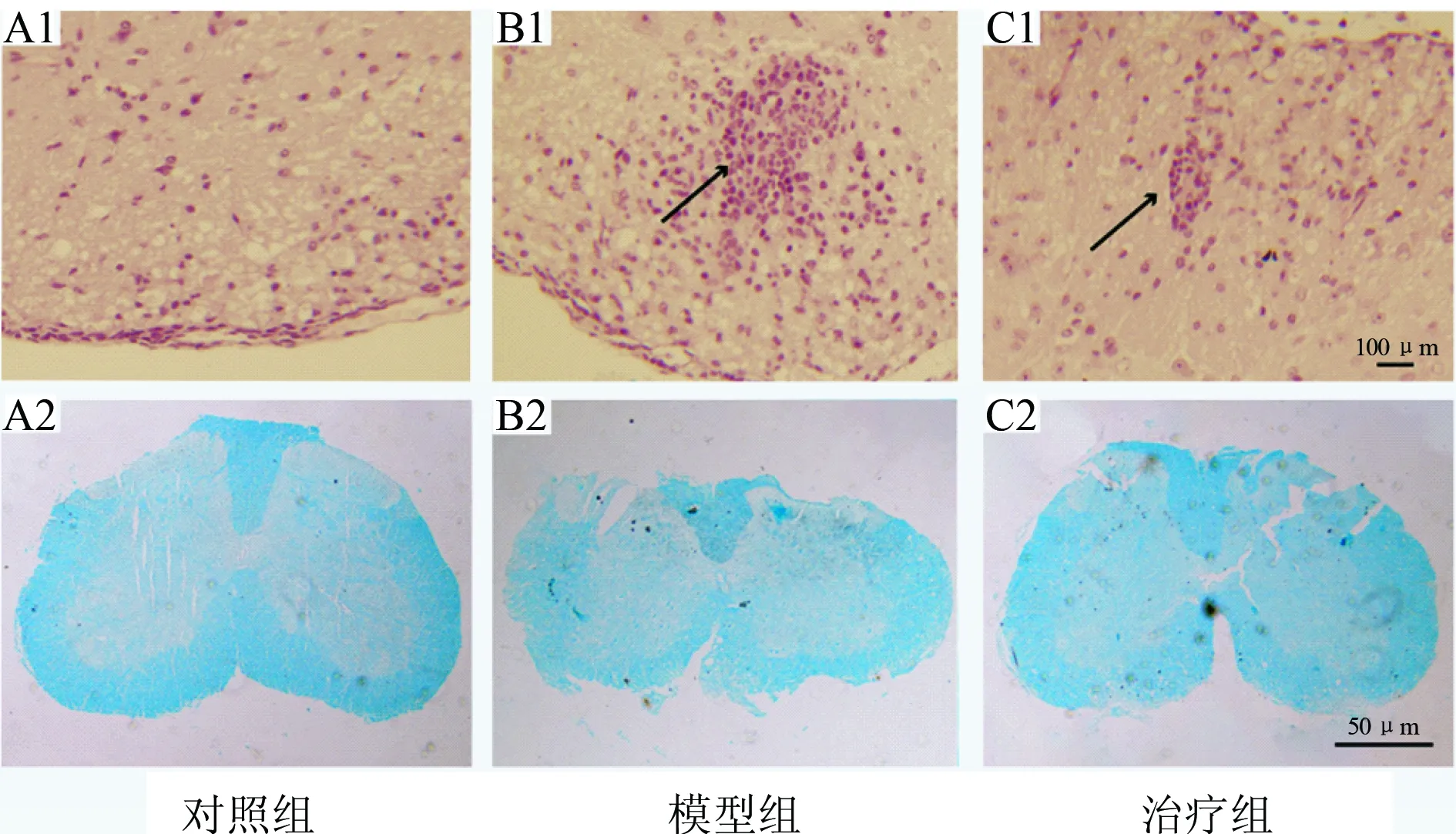
1:HE染色;2:LFB染色图2 小鼠脊髓组织学观察(HE,×100;LFB,×10)
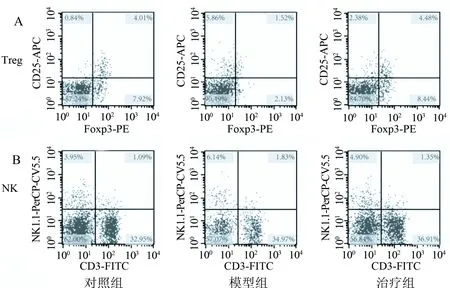
图3 通过流式细胞仪测定NK1.1CD3-和CD4+CD25+Foxp3+T细胞的水平
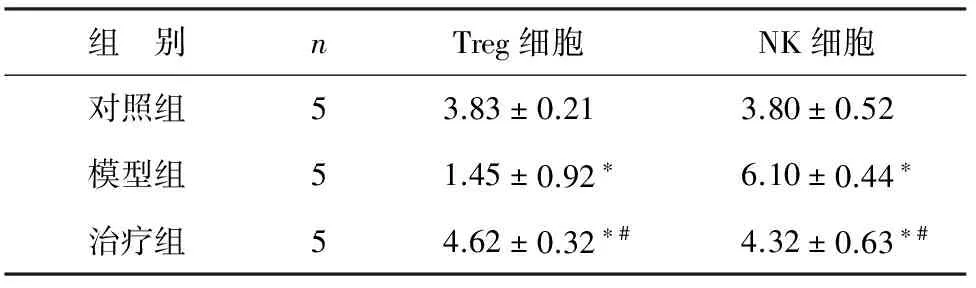
组 别nTreg细胞NK细胞对照组53.83±0.213.80±0.52模型组51.45±0.92∗6.10±0.44∗治疗组54.62±0.32∗#4.32±0.63∗#
注:与对照组相比,*P<0.05;与模型组相比,#P<0.05。
2.4 小鼠脊髓GFAP和MBP表达 Western blot结果见图4A,统计结果表明治疗组小鼠脊髓组织中GFAP的表达量明显低于模型组(t=2.436,P<0.05),但仍高于对照组(t=3.224,P<0.05)。而治疗组小鼠脊髓组织中MBP的表达明显高于模型组(t=3.213,P<0.05),但是仍然低于对照组(t=2.662,P<0.05)。
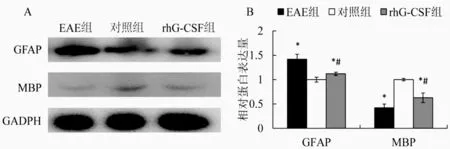
*与对照组相比P<0.05,#与模型组相比,P<0.05图4 小鼠脊髓GFAP和MBP的表达
3 讨论
G-CSF在1986年第一次被记录并且被克隆,人类的G-CSF基因被定为17号染色体,由骨间充质细胞、内皮细胞、巨噬细胞、成纤维细胞因炎症刺激而产生。近年来,越来越多的研究表明G-CSF除了能动员造血干细胞、祖细胞等细胞,在免疫调节方面也发挥着重要作用[2]。
在本研究中,我们成功诱导EAE模型,给予rhG-CSF治疗后,各组经过28 d的神经功能评分,发现治疗组在经rhG-CSF治疗1周后神经功能评分显著低于模型组;GFAP主要在中枢神经系统星形胶质细胞中表达,与炎症反应的严重程度有密切关联,治疗组经rhG-CSF治疗后GFAP的表达量显著低于模型组;MBP是一种主要在神经纤维髓鞘的蛋白质表达,它在维持神经纤维髓鞘的结构和功能稳定上有着至关重要的作用,具有神经组织特异性,治疗组MBP的表达量显著高于模型组;HE染色和LFB染色显示治疗组的脊髓的炎性细胞浸润和脱髓鞘评分显著降低。这些结果都表明rhG-CSF在治疗EAE小鼠模型中有较好的效果。且用流式细胞仪检测小鼠脾脏的Treg细胞的比例,发现治疗组小鼠体内Treg细胞比例显著上升。
Treg细胞是近几年来发现的表达CD4、CD25以及转录因子Foxp3的T细胞亚型[9]。Treg细胞可以通过上调其表面的白介素(interleukin,IL)-2受体,从而抑制IL-2与效应性T细胞的结合[10]。Treg细胞可以通过凋亡靶细胞来发挥免疫抑制作用,同时也能通过削弱共刺激信号以及抗原提成的作用从而对抗原提成细胞(antigen presenting cells,APC)进行负向调节[11]。淋巴细胞活化基因-3(lymphocyte ac-tivation gene-3,LAG-3)在Treg细胞膜上高表达,LAG-3能与APC的MHCⅡ结合,从而可以抑制树突状细胞的活化[12]。Treg细胞在维持体内免疫应答稳态过程中起重要作用。Zou等[13]发现G-CSF可以降低CXC趋化性细胞因子受体-4的配体基质细胞衍生因子-1,从而有利于动员骨髓里的Treg细胞到外周血中,从而抑制自身免疫反应。Haller等[14]用G-CSF联合低剂量的抗胸腺细胞球蛋白治疗I型糖尿病,发现这种联合治疗能够上调外周血Treg细胞,并且能够维护胰腺β细胞的功能。上述研究结果与我们的研究结果相一致。因此,我们认为以rhG-CSF治疗EAE小鼠的机制与其促进外周血Treg细胞增加有密切关系,因而抑制炎症反应,缓解了EAE相关的各种症状。
有些研究还发现,低剂量IL-2可以显著增加Treg细胞的比例[15]。这些结果提示我们在后续的研究中可以探索G-CSF联合低剂量IL-2与单用G-CSF相比是否能够更加显著的改善治疗效果。
[1] Milo R,Kahana E.Multiple sclerosis:geoepidemiology,genetics and the environment[J] .Autoimmun Rev,2010,9(5):A387-A394.
[2] Yang JZ,Zhang JQ,Sun LX.Mechanisms for T cell tolerance induced with granulocyte colony-stimulating factor [J] .Mol Immunol,2016,70:56-62.
[3] Gardner JC,Noel JG,Nikolaidis NM,et al.G-CSF drives a posttraumatic immune program that protects the host from infection[J] .J Immunol,2014,192(5):2405-2417.
[4] Schmitz K,Geisslinger G,Tegeder I.Monoclonal antibodies in preclinical EAE models of multiple sclerosis:a systematic review[J] .Int J Mol Sci,2017,18(9):1992.
[5] Riva A,Tandler B,Ushiki T,et al.Mitochondria of human Leydig cells as seen by high resolution scanning electron microscopy[J] .Arch Histol Cytol,2010,73(1):37-44.
[6] Kasarello K,Kwiatkowska-Patzer B,Lipkowski AW,et al.Oral administration of lactococcus lactis expressing synthetic genes of myelin antigens in decreasing experimental autoimmune encephalomyelitis in rats[J] .Med Sci Monit,2015,21:1587-1597.
[7] Zhao Z,Mao Z,Yin J,et al.Immune characteristics study of AG490,a signal pathway inhibitor,in EAE model mice[J] .Saudi J Biol Sci,2017,24(2):256-262.
[8] 薛鹏,李金凤,刘新珊,等. 脂肪间充质干细胞治疗实验性自身免疫性脑脊髓炎小鼠的效果[J] .郑州大学学报:医学版,2016,51(6):731-735.
[9] Sakaguchi S,Yamaguchi T,Nomura T,et al.Regulatory T cells and immune tolerance[J] .Cell,2008,133(5):775-787.
[10] Pandiyan P,Zheng L,Ishihara S,et al.CD4+CD25+Foxp3+regulatory T cells induce cytokine deprivation-mediated apo-ptosis of effector CD4+ T cells[J] .Nat Immunol,2007,8(12):1353-1362.
[11] Thornton AM,Shevach EM.Suppressor effector function of CD4+CD25+ immunoregulatory T cells is antigen nonspecific[J] .J Immunol,2000,164(1):183-190.
[12] Anderson AC,Joller N,Kuchroo VK.Lag-3,Tim-3,and TIGIT:co-inhibitory receptors with specialized functions in immune regulation[J] .Immunity,2016,44(5):989-1004.
[13] Zou L,Barnett B,Safah H,et al.Bone marrow is a reservoir for CD4+CD25+ regulatory T cells that traffic through CXCL12/CXCR4 signals[J] .Cancer Res,2004,64(22):8451-8455.
[14] Haller MJ,Gitelman SE,Gottlieb PA,et al.Anti-thymocyte globulin/G-CSF treatment preserves β cell function in patients with established type 1 diabetes[J] .J Clin Invest,2015,125(1):448-455.
[15] Chinen T,Kannan AK,Levine AG,et al.An essential role for the IL-2 receptor in Treg cell function[J] .Nat Immunol,2016,17(11):1322-1333.
