P2X4受体在慢性偏头痛大鼠三叉神经脊束尾核的表达及意义*
2018-03-19刘超阳秦光成陈力学周冀英
刘超阳 刘 清 王 莎 秦光成 陈力学 周冀英
(1重庆医科大学附属第一医院实验研究中心,重庆 400016;2重庆市神经病学重点实验室,重庆 400016 )
偏头痛是一种常见的致残性原发性头痛,依据其发作频率可分为发作性偏头痛 (episodic migraine,EM)和慢性偏头痛 (chronic migraine, CM) 两大类[1]。慢性偏头痛对人类健康的危害性远远大于发作性偏头痛,且每年有大约3%的偏头痛会由发作性进展为慢性[2]。然而对于慢性偏头痛目前尚缺乏有效的治疗手段,因此深入探究慢性偏头痛的发病机制对其预防及治疗有重要的临床意义。
慢性偏头痛的发病机制仍不清楚,国内外的研究认为中枢敏化及痛觉通路调控异常等机制可能促进了偏头痛的慢性化[3]。近年来,小胶质细胞在慢性偏头痛发病机制中的作用越来越受到关注[4,5]。最近研究发现,在反复硬脑膜 “炎性汤” 刺激诱导的慢性偏头痛模型中,三叉神经脊束尾核 (trigeminal nucleus caudalis, TNC) 小胶质细胞明显活化且对大鼠痛觉超敏的调控有重要作用[6]。而其他研究也发现,硬脑膜给予炎性或机械性刺激可引起大鼠TNC部位c-Fos蛋白的表达增加[7,8],而c-Fos属于即刻早期基因家族的重要一员,被认为是神经元激活的标志蛋白[7]。此外,研究表明脊髓小胶质细胞P2X4受体 (P2X4 receptor, P2X4R) 的表达上调与外周神经损伤诱导的痛觉超敏的发生密切相关[9]。然而,目前尚未明确TNC部位小胶质细胞P2X4受体是否在慢性偏头痛发病机制中发挥重要作用。本研究参考Melo-Carrillo等的方法[10]建立大鼠慢性偏头痛模型,观察CM大鼠TNC部位P2X4受体和c-Fos蛋白的表达情况,为慢性偏头痛的机制研究提供新的方向。
方 法
1. 实验材料
(1)实验动物及分组
雄性SD大鼠 (SPF级) 42只,体重250~300 g,由重庆医科大学实验动物中心提供(实验动物生产许可证号:SYXK(渝)2012-0001)。大鼠随机 (随机数字表)分为5组,对照组(Control组,n= 12),模型组(CM组,n=12),模型+溶剂组(CM+PBS组,n=6),模型+P2X4受体抑制剂30 nmol组(n= 6)和模型+ P2X4受体抑制剂60 nmol组 (n= 6)。实验大鼠均置于温度22 ± 2℃、湿度50 ± 5%的环境中,保证12 h/12 h的正常昼夜交替规律,自由摄食和饮水。所有实验动物适应性饲养一周后进行试验。
(2)实验试剂
“炎性汤” (in fl ammatory soup, IS),参考A.M. Strassman等人的配方[11],由组胺 (1 mmol/L)、5-羟色胺 (1 mmol/L)、缓激肽 (1 mmol/L) 和前列腺素E2 (0.1 mmol/L) 加入PBS配制而成(调PH值为7.4),均购自Sigma-Aldrich;TNP-ATP (Sigma-Aldrich);兔抗大鼠P2X4R抗体 (Abcam)、小鼠抗大鼠c-Fos抗体 (Santa Cruz)、山羊抗大鼠Iba-1抗体 (Abcam)、小鼠抗大鼠GFAP抗体 (Abcam)、Cy3标记的驴抗山羊 (Proteintech)、FITC标记的山羊抗兔 (Proteintech)、DAPI (Beyotime);兔抗大鼠β-actin抗体 (Proteintech)、HRP标记的羊抗兔/小鼠IgG抗体(北京中杉金桥);BCA蛋白浓度检测试剂盒 (Beyotime)、ECL化学发光显影液 (Beyotime)、TRIzol试剂和逆转录试剂盒 (Takara)。
2.实验方法
(1)大鼠慢性偏头痛模型的建立
参考Melo-Carrillo等人的报道及本课题组的前期研究[10,12],本实验通过“炎性汤”反复滴注刺激硬脑膜三叉神经痛觉感受器建立了慢性偏头痛大鼠模型。造模前将大鼠禁食禁水12 h,以避免实验操作过程可能引起的肠麻痹。SD大鼠腹腔注射10%水合氯醛 (4 ml/kg),麻醉后固定于立体定位仪上,常规备皮、消毒后,沿头部正中切开约1 cm切口,逐层钝性分离皮下组织直至暴露颅骨表面。用颅骨钻于前囟左侧1.5 mm,前方1.5 mm处建立一个直径约1 mm的颅骨窗,避免损伤硬脑膜。取微量套管下降深度约0.3 mm后安装于颅骨窗并用牙托粉固定,全层缝合皮肤,涂抗生素以预防感染。术后将大鼠置于37℃恒温板,待其苏醒后放回独立清洁笼中。术后1周评估恢复情况,选择切口无感染、恢复良好的进入后续实验。CM组大鼠给予硬脑膜外滴注2 μl “炎性汤”,通过微螺旋定量推进装置缓慢匀速泵入,每日一次,重复7日;control 组大鼠给予等量PBS (0.01 M)。
(2)侧脑室给药
大鼠建模成功后 (7次 “炎性汤” 滴注硬脑膜),腹腔注射10%水合氯醛,待其麻醉后去除由牙脱粉堆砌而成的“帽子”。在前囟左侧1.5 mm后方1 mm处,用颅骨钻建立一直径约1 mm的颅骨窗。微量注射器固定于立体定位仪上,从上述颅骨窗处下降深度约 4 mm 到达侧脑室,缓慢匀速泵入干预试剂(5 μl/只),约10 min。待给药完成后继续留针5 min再拔出,并用骨蜡封闭颅骨窗,缝合皮肤。溶剂组接受相同的处理后侧脑室给予等量的PBS。大鼠完成侧脑室注射后置于37℃恒温板,苏醒后送回清洁笼中。
(3) 机械痛阈值的测定
参照Oshinsky等[13]的方法,将大鼠置于透明玻璃笼 (22 cm×22 cm×30 cm) 中适应5~10 min后,使用电子von Frey痛阈仪 (WoodLand Hills, CA,USA) 测定眶周、后足的基础机械痛阈值变化。具体操作方法如下:使用纤维丝的头端垂直轻触大鼠眶周或后爪皮肤,当其出现快速回缩、发声、用爪搔抓头面部或剥开纤维丝时即为阳性反应,仪器自动记录痛阈值,每个部位测3次,间隔10分钟测一次,取平均值作为该部位的痛阈值。每日给予 “炎性汤” 之前测定基础痛阈值,以及给予P2X4受体抑制剂24 h后,再次测定各组痛阈值的变化。
(4)蛋白提取与蛋白水平检测
各组完成最后1次痛阈值测定后,将大鼠麻醉后断头并迅速分离TNC部位,-80℃冰箱保存待用。提取蛋白时,取适量组织,加入含有PMSF (Beyotime,China) 和磷酸酶抑制剂 (Boster, China) 的RIPA缓冲液 (Beyotime, China),匀浆器充分匀浆后置于4℃冰箱裂解1.5 h,低温离心机离心 (4℃,12000 rpm,20 min) 后,取上清液,用BCA试剂盒测定蛋白浓度。蛋白样品加入SDS-PAGE蛋白上样缓冲液 (Beyotime, China) 和裂解液配平浓度后,100℃水浴变性5 min,待其冷却后分装。取适量体积的蛋白样品上样,10% SDS-PAGE胶电泳分离后,电转至PDVF膜 (250 mA, 1.5 h),5%脱脂奶粉室温摇床上封闭2 h。孵育一抗:兔抗大鼠P2X4R (1:800)、小鼠抗大鼠 c-Fos (1:500) 和兔抗大鼠 β-actin (1:2 000),4℃孵育过夜。TBST漂洗3次,10 min/次,然后滴加相应二抗:HRP标记的山羊抗兔 (1:8 000) 或山羊抗小鼠 (1:5 000),室温孵育1.5 h。TBST漂洗3次,10 min/次。采用ECL试剂盒和凝胶成像系统 (Fusion,Germany) 发光成像,Fusion软件分析条带灰度值,以β-actin 作为内参,计算目的蛋白相对表达量。
(5)免疫荧光双标检测
将大鼠麻醉,经心灌注适量0.9%生理盐水后用4%多聚甲醛灌流固定,分离脑组织,4%多聚甲醛后固定24 h后放入20%蔗糖溶液中脱水24 h,然后换为30%蔗糖溶液继续脱水72 h。待组织块处理好后,采用冰冻切片机切片 (厚10 μm),-80℃冰箱储存待用。切片自然风干后,经PBS漂洗后用0.3% Triton破膜,37℃孵育10 min,PBS漂洗后用山羊血清封闭,37℃孵育30 min,随后滴加兔抗大鼠P2X4R (1:50) 与山羊抗大鼠Iba-1 (1:100) 或小鼠抗大鼠GFAP (1:100) 一抗混合液,4℃孵育过夜。次日,切片经PBS漂洗后滴加Cy3标记的驴抗山羊IgG (1:60) 与FITC标记的山羊抗兔IgG (1:60) 二抗混合液,室温孵育1.5 h,PBS漂洗后滴加DAPI染色溶液,37℃孵育8 min,PBS漂洗并50%甘油封片后,共聚焦显微镜下观察切片。
3. 数据处理与统计分析
数据以均数±标准差(±SD)表示,使用统计软件SPSS 20.0进行统计学分析。两组数据比较采用独立样本t检验 (unpaired Student' st-test),多组数据比较采用单因素方差分析 (ANOVA),两两比较采用Tukey检验,P< 0.05认为差异有统计学意义。
结 果
1.免疫荧光双标检测结果
免疫荧光染色技术检测P2X4R在TNC部位的表达与定位情况,结果显示,P2X4受体主要表达于TNC部位的小胶质细胞,而并未发现其在星形胶质细胞有表达 (见图1)。
2. 反复硬脑膜 “炎性汤” 刺激可诱导大鼠痛觉超敏及TNC部位c-Fos蛋白表达上调
采用von Frey痛阈仪测定大鼠给药 “炎性汤”前的基础机械痛阈值。随着给药次数增加,IS组大鼠眶周及后足的机械痛阈值逐渐下降,且从第三次给药前开始显著下降 (6.33±0.63 g; 13.30±1.42 g),与首次给药前的机械痛阈值 (8.40±0.50 g;16.94±1.47 g) 相比有明显差异 (P< 0.01, 见图 2);PBS组7次给予PBS前及IS组首次给药前的机械痛阈值之间差异无统计学意义。Western blot结果显示,与control组相比,CM组TNC部位c-Fos蛋白表达量显著增加 (P< 0.01, 见图5),且CM与CM +PBS组之间无显著差异。
3. 反复硬脑膜 “炎性汤” 刺激可诱导TNC部位P2X4受体蛋白表达上调
通过Western blot检测两组大鼠TNC部位P2X4受体蛋白表达水平,结果显示,CM组TNC部位P2X4受体的蛋白表达量较control组显著增加(P< 0.001,见图 3)。
4. 侧脑室给予TNP-ATP对大鼠痛觉超敏及TNC部位c-Fos蛋白表达的影响
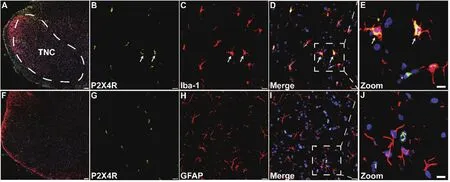
图1 免疫荧光染色对TNC部位P2X4受体的定位检测(A-E) 大鼠TNC部位P2X4受体与Iba-1的免疫荧光染色情况:DAPI (蓝色),P2X4R (绿色),Iba-1 (红色),D为B与C的融合图像,E为D中的部分放大图像;(F-J) 大鼠TNC部位P2X4受体与GFAP的免疫荧光染色情况:DAPI (蓝色),P2X4R (绿色),GFAP (红色),I为G与H的融合图像,J为I中的部分放大图像(A, F = 100 μm,B-D, G-I = 20 μm,E, J = 10 μm)Fig.1 Localization of P2X4R in the TNC detected with immuno fl uorescence(A-E) Immuno fl uorescence staining of P2X4R and Iba-1 in the TNC in rat: DAPI (Blue),P2X4R (Green), Iba-1 (Red), D is the merged image of B and C, E shows a magni fi ed section of D; F-J Immuno fl uorescence staining of P2X4R and GFAP in the TNC in rat: DAPI (Blue), P2X4R (Green), GFAP (Red), I is the merged image of G and H, J shows a magni fi ed section of I (Scale bar = 100 μm in A, F; Scale bar = 20 μm in B-D, G-I; Scale bar = 10 μm in E, J).

图2 对照组 (PBS) 与模型组 (IS) 7次给药前的眶周 (A) 及后足 (B) 机械痛阈值**P < 0.01,与首次给药前相比Fig.2 Periorbital (A) and hindpaw (B) mechanical pain threshold in both control (PBS) and CM (IS) group before 7 times infusions**P < 0.01, compared with the threshold before the fi rst infusion.
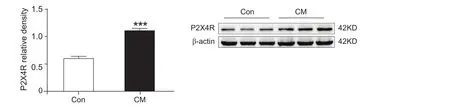
图3 对照组与模型组TNC部位P2X4受体的蛋白表达量***P < 0.001,与对照组相比Fig.3 P2X4R protein expression in TNC in control and CM groups***P < 0.001, compared with control group.
完成7次硬脑膜外 “炎性汤” 滴注后,检测痛阈值发现,与control组的眶周及后足机械痛阈值 (7.67±0.38 g; 16.97±1.33 g) 相比,CM组的眶周和足底机械痛阈值 (3.18±0.63 g; 6.27±1.20 g)均显著降低 (P< 0.01, 见图4),而CM与CM+PBS组 (3.35±0.44 g; 6.13±1.30 g) 之间无显著差异,提示慢性偏头痛模型造模成功且溶剂PBS对机械痛阈值无显著影响。侧脑室给予P2X4受体抑制剂TNP-ATP (30 nmol组,60 nmol组) 后,大鼠眶周(6.97±0.46 g;7.42±0.64 g)及后足 (13.83±0.78 g;15.60±0.91 g) 痛阈值均较CM+PBS组显著升高(P< 0.05, 见图4),且两种不同给药剂量组之间差异无统计学意义,表明TNP-ATP对痛阈值的影响无剂量依赖性。相应的,Western blot检测发现,与CM+PBS组相比,TNP-ATP组TNC部位c-Fos的蛋白表达量显著降低 (P< 0.05,见图5)。上述实验表明,侧脑室给予P2X4受体抑制剂TNP-ATP可逆转大鼠眶周及后足的痛觉超敏,表明P2X4R可能参与了慢性偏头痛的病理生理过程。
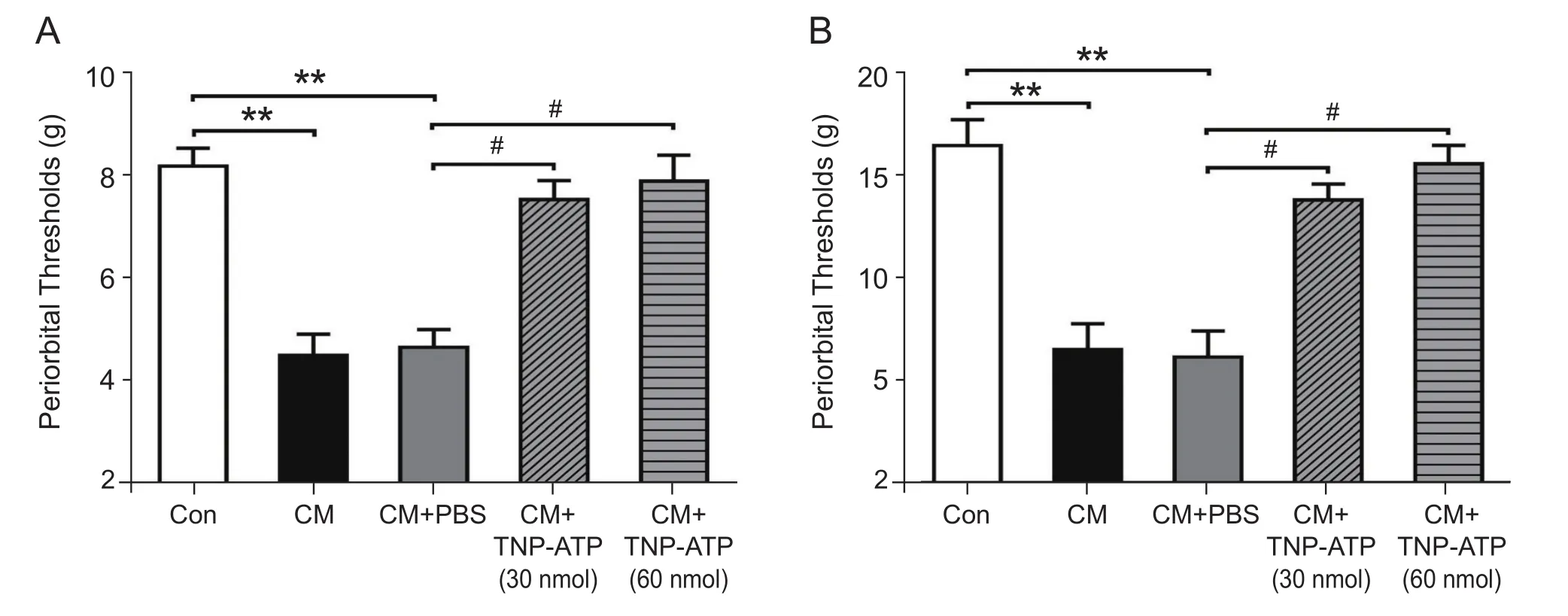
图4 给予P2X4受体抑制剂TNP-ATP后各组眶周 (A) 及后足 (B) 机械痛阈值变化**P < 0.01,与对照组相比; #P < 0.05,与CM+PBS组相比Fig.4 Changes in periorbital (A) and hindpaw (B) thresholds after the administration of P2X4R antagonist**P < 0.01, compared with control group; #P < 0.05, compared with CM+PBS group.
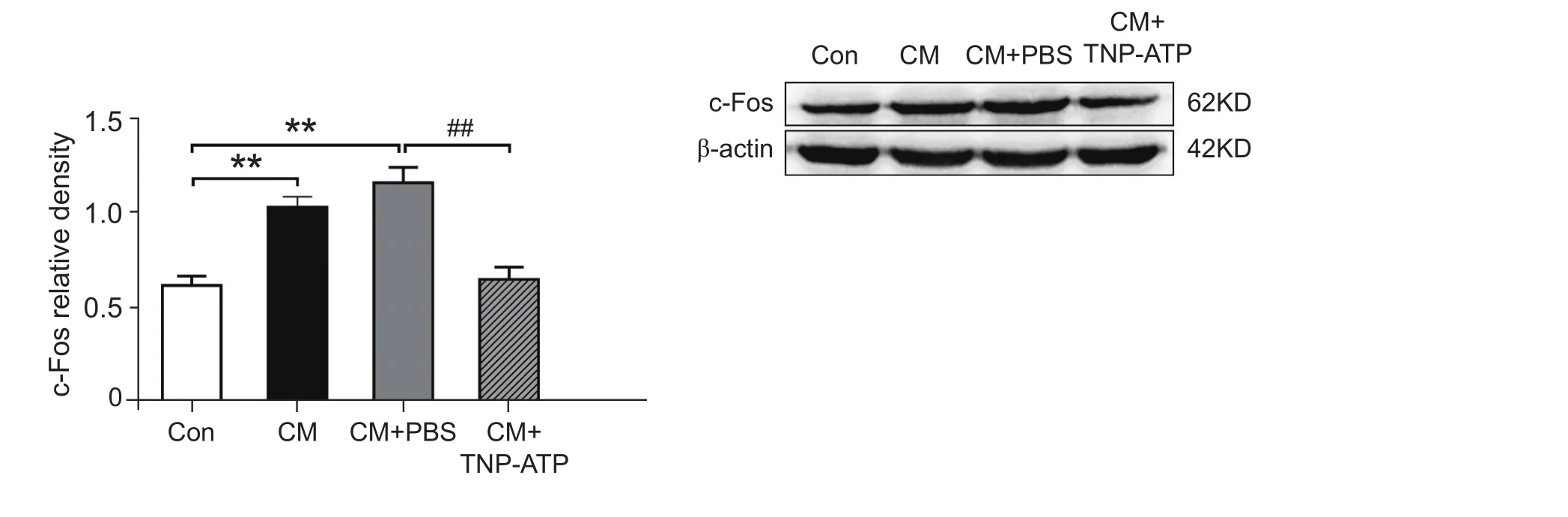
图5 给予P2X4受体抑制剂TNP-ATP后各组TNC部位c-Fos蛋白的表达变化**P < 0.01,与对照组相比;##P < 0.01,与CM+PBS组相比Fig.5 The protein expression of c-Fos in four groups after the administration of P2X4R antagonist TNP-ATP**P < 0.01, compared with control group; ##P < 0.01, compared with CM + PBS group.
讨 论
慢性偏头痛的发病机制目前尚不明确,既往的研究发现小胶质细胞的激活在慢性偏头痛的病理生理过程中发挥重要作用[4,5]。尽管国内外已有很多研究表明小胶质细胞P2X4受体与慢性疼痛的发生发展密切相关,但其主要为神经病理性痛领域,而在偏头痛相关研究中尚无报道。本研究参照Melo-Carrillo等人的方法及本课题组的前期实验[10,12],采用硬脑膜外反复滴注 “炎性汤”,模拟慢性偏头痛三叉神经血管系统的激活,建立大鼠慢性偏头痛模型,探究大鼠TNC部位小胶质细胞P2X4受体的表达变化与慢性偏头痛发病之间的关系。
在中枢神经系统中,小胶质细胞除了起支持作用之外,还可以通过影响神经元的兴奋性参与慢性疼痛状态的维持机制,而小胶质细胞P2X4受体的表达上调与其密切相关[14]。三磷酸腺苷 (ATP) 受体包括P1和P2两大类,P1又称腺苷受体,P2可分为P2X和P2Y两类,通过与ATP结合广泛参与机体各种生物学效应的发生[15]。P2X受体广泛表达于与痛觉信息传递有关的外周和中枢部位,参与疼痛发生的外周及中枢机制[16]。其中,P2X4是P2X中的一个重要亚型,已有研究表明其主要存在于小胶质细胞,在神经病理性痛的启动和维持机制中起着重要作用[9,17]。Tsuda等人研究发现,周围神经损伤后,损伤部位同侧的脊髓小胶质细胞P2X4受体表达量较对侧明显升高[17]。本研究也发现,随着硬脑膜外“炎性汤” 滴注次数增多,慢性偏头痛模型组大鼠眶周及后足的基础机械痛阈值与对照组相比均明显降低,而TNC部位P2X4受体蛋白表达量较对照组显著升高。荧光染色结果显示,P2X4受体在大鼠TNC部位有表达,且主要表达于小胶质细胞,提示小胶质细胞P2X4受体不仅参与神经病理性痛的病理生理过程,其在脑干TNC部位的表达上调可能与慢性偏头痛的发病密切相关。TNP-ATP是P2X4受体的一种非选择性抑制剂,其常被用于动物实验中,可通过拮抗P2X4受体而逆转痛觉超敏的发生[17]。本研究结果表明,侧脑室给予P2X4受体抑制剂TNP-ATP后,CM大鼠的眶周及后足机械痛阈值均显著升高,表明阻断小胶质细胞P2X4受体可影响偏头痛的进展,从而提示P2X4受体在慢性偏头痛的病理生理机制中可能发挥重要作用。
c-Fos是一种与细胞生长分化及信息传递密切相关的原癌基因,其作为即刻早期基因家族的重要成员已被广泛用作神经元激活的一个标志蛋白[18]。在外周化学性刺激及电刺激诱导的偏头痛模型中,可以检测到TNC部位神经元c-Fos的表达量显著增加,因此常常将其作为TNC神经元的激活标志而用于偏头痛的研究[7,8]。本研究发现,慢性偏头痛模型组大鼠TNC部位c-Fos蛋白表达量较对照组明显增高,提示硬膜外 “炎性汤” 反复刺激可以诱导TNC部位三叉神经元的激活。而侧脑室给予TNPATP阻断P2X4受体能够抑制c-Fos蛋白的表达上调。既往研究发现,神经损伤后小胶质细胞P2X4受体表达上调,可通过与释放增多的ATP结合引起Ca2+内流,激活p38丝裂原活化蛋白激酶 (p38 MAPK)[19]。p38 MAPK激活后可启动下游转录因子,导致脑源性生长因子及一些炎症因子合成释放增多,释放到突触间隙后通过调节神经元兴奋性,参与痛觉中枢敏化的形成[20]。因此,TNP-ATP可能通过抑制P2X4受体下调下游效应因子,间接抑制了神经元的激活,从而引起c-Fos蛋白表达降低。
综上所述,在 “炎性汤” 反复刺激硬脑膜诱导的慢性偏头痛大鼠模型中,TNC部位小胶质细胞P2X4受体表达明显上调,同时c-Fos的表达也显著增加,而TNP-ATP可显著抑制大鼠的痛觉超敏现象及c-Fos的表达。表明大鼠三叉神经脊束尾核小胶质细胞P2X4受体的表达上调,可能通过影响神经元的激活,从而参与了慢性偏头痛的病理生理机制,但其具体机制有待进一步研究。
[1]Headache Classi fi cation Committee of the International Headache society (IHS). The international classi fi cation of headache disorders, 3rd edition (beta version).Cephalalgia, 2013, 33(9):629 ~ 808.
[2]May A, Schulte LH. Chronic migraine: risk factors,mechanisms and treatment. Nat Rev Neurol, 2016,12(8):455 ~ 464.
[3]Boyer N, Dallel R, Artola A,et al. General trigeminospinal central sensitization and impaired descending pain inhibitory controls contribute to migraine progression. Pain, 2014, 155(7):1196 ~ 1205.
[4]郭永涛, 黄琳, 武茜, 等. 小胶质细胞在偏头痛大鼠中枢敏化过程中的作用. 中华老年心脑血管病杂志,2013, 15(4):419 ~ 422.
[5]Bartley J. Could glial activation be a factor in migraine?Medical Hypotheses, 2009, 72(3):255 ~ 257.
[6]Fried NT, Maxwell CR, Elliott MB,et al. Regionspeci fi c disruption of the blood-brain barrier following repeated in fl ammatory dural stimulation in a rat model of chronic trigeminal allodynia. Cephalalgia, 2017:1 ~16.
[7]Lukács M, Warfvinge K, Tajti J,et al. Topical dura mater application of CFA induces enhanced expression of c-Fos and glutamate in rat trigeminal nucleus caudalis: attenuated by KYNA derivate (SZR72).Headache Pain, 2017, 18(1):39.
[8]Strassman AM, Mineta Y, Vos BP. Distribution of foslike immunoreactivity in the medullary and upper cervical dorsal horn produced by stimulation of dural blood vessels in the rat. Neuroscience, 1994,14(6):3725 ~ 3735.
[9]Beggs S, Trang T, Salter MW. P2X4R + microglia drive neuropathic pain. Nat Neurosci, 2012, 15(8):1068 ~1073.
[10]Melo-Carrillo A, Lopez-Avila A. A chronic animal model of migraine, induced by repeated meningeal nociception, characterized by a behavioral and pharmacological approach. Cephalalgia, 2013,33(13):1096 ~ 1105.
[11]Strassman AM, Raymond SA, Burstein R. Sensitization of meningeal sensory neurons and the origin of headaches. Nature, 1996, 384(6609):560 ~ 564.
[12]吴白雪, 王莎, 秦光成, 等. 蛋白激酶C参与大鼠慢性偏头痛中枢敏化. 中国疼痛医学杂志, 2017,23(5):331 ~ 337.
[13]Oshinsky ML, Gomonchareonsiri S. Episodic dural stimulation in awake rats: a model for recurrent headache. Headache, 2007, 47(7):1026 ~ 1036.
[14]Beggs S, Salter MW. Microglia-neuronal signalling in neuropathic pain hypersensitivity 2.0. Curr Opin Neurobiol, 2010, 20(4):474 ~ 480.
[15]Inoue K, Tsuda M. Purinergic systems, neuropathic pain and the role of microglia. Exp Neurol, 2012,234(2):293 ~ 301.
[16]Tsuda M, Tozaki-Saitoh H, Inoue K. Pain and purinergic signaling. Brain Res Rev, 2010, 63(1-2):222 ~232.
[17]Tsuda M, Shigemoto-Mogami Y, Koizumi S,et al.P2X4 receptors induced in spinal microglia gate tactile allodynia after nerve injury. Nature, 2003,424(6950):778 ~ 783.
[18]Knyihár-Csillik E, Toldi J, Mihály A,et al. Kynurenine in combination with probenecid mitigates the stimulation-induced increase of c-Fos immunoreactivity of the rat caudal trigeminal nucleus in an experimental migraine model. J Neural Transm, 2007, 114(4):417 ~421.
[19]Tsuda M, Mizokoshi A, Shigemoto-Mogami Y,et al.Activation of p38 mitogen-activated protein kinase in spinal hyperactive microglia contributes to pain hypersensitivity following peripheral nerve injury. Glia,2004, 45(1):89 ~ 95.
[20]Trang T, Beggs S, Wan X,et al. P2X4-receptor-mediated synthesis and release of brain-derived neurotrophic factor in microglia is dependent on calcium and p38-mitogen-activated protein kinase activation. Journal of Neuroscience, 2009, 29(11):3518 ~ 3528.
