“燕尾征”在原发性帕金森病及多系统萎缩中的鉴别诊断价值
2018-03-16王娜杨华光李成博罗晓光范国光
王娜,杨华光,李成博,罗晓光,范国光
中国医科大学附属第一医院放射科,辽宁沈阳 110000; *通讯作者 范国光fanguog@sina.com
原发性帕金森病(idiopathic Parkinson's disease,IPD)和多系统萎缩(multiple system atrophy,MSA)均为常见的中枢神经系统退行性病变。两者临床症状复杂多样且表现相似;但MSA较IPD进展快、预后差,且不适合深部脑刺激手术,因此鉴别诊断对指导临床治疗具有重要意义。然而,目前尚缺乏可靠的生物学标志物鉴别两者[1]。近年来病理学及影像学研究发现,正常人黑质区中层后外1/3区存在的黑质小体-1在磁敏感加权成像(SWI)相应位置表现为水滴样或卵圆状等高信号,影像学称为“燕尾征”[2-3]。IPD患者中“燕尾征”高信号消失,可与正常人及非帕金森病患者(颅内占位及脑梗死等)相鉴别,并在与帕金森综合征患者(包括MSA、皮质基底节变性、进行性核上性麻痹等)的鉴别诊断中发挥重要作用[3-4]。因此,“燕尾征”可能成为IPD的影像学标志。本研究应用3.0T SWI序列对IPD及MSA患者的“燕尾征”进行研究,旨在进一步讨论其对两者的鉴别诊断价值。
1 资料与方法
1.1 研究对象 收集2016年1-12月在中国医科大学附属第一医院神经内科诊断为IPD的患者32例(IPD组),其中男17例,女15例;平均年龄(60.7±8.4)岁;MSA(可能诊断)45例(MSA组),其中男27例,女18例;平均年龄(65.6±8.9)岁;同时收集年龄及性别匹配的正常对照32例(对照组),其中男11例,女21例;平均年龄(64.4±3.3)岁。纳入及排除标准:①所有患者均由神经内科锥体外系运动疾病专家确诊。IPD诊断符合英国帕金森病协会脑库临床诊断标准[5];MSA诊断符合Gilman第2版临床诊断标准[6];同时排除其他帕金森综合征(特发性震颤、血管性帕金森、皮质基底节变性及进行性核上性麻痹等)。②根据常规MRI,排除各组存在颅内占位、出血、严重脑血管病变及脑炎等表现者;③所有患者MRI禁忌,如金属及固定假牙等。所有纳入研究对象均为右利手,于检查前了解所有检查内容并签署知情同意书。各组受试者年龄、性别差异无统计学意义(P>0.05)。
1.2 临床资料收集 所有受试者进行帕金森病临床Hoehn-Yahr分级(简称H-Y分级)及统一帕金森病评定量表UPDRS Ⅲ评分,量表评分由2名神经内科主治医师完成。
1.3 仪器与方法 采用Siemens Magnetom Verio 3.0 T超导型MR仪,32通道高分辨率相控阵头线圈,平行于前后联合间线扫描。扫描参数:轴位SWI采用3D FLASH T2WI序列,TR 27 ms,TE 20 ms,翻转角15°,层厚1.5 mm,激励次数1,视野230 mm×172.5 mm,矩阵256×243.3,接受带宽 120 Hz/PX。
1.4 图像分析 西门子自带软件将原始幅度图及相位图融合为合成图。所有图像由1名放射科主任医师和1名放射科主治医师采用盲法分别阅片。结合SWI轴位幅度图和合成图对黑质中层后外1/3区“燕尾征”进行评分。①每组受试者双侧黑质“燕尾征”均分别进行评分;②一侧“燕尾征”消失评价为0分,存在评价为1分;③如双侧评分不一致,评分较高及双侧平均分均进行统计;④鉴于IPD可以单侧发病,仅需单侧评价出现0分则诊断为IPD,否则为MSA。以高年资神经内科运动疾病专家的临床诊断作为“金标准”,与“燕尾征”诊断结果进行对比分析。为减少视觉误差,本研究中全部图像由2名固定医师进行诊断。典型病例影像学特征见图1。
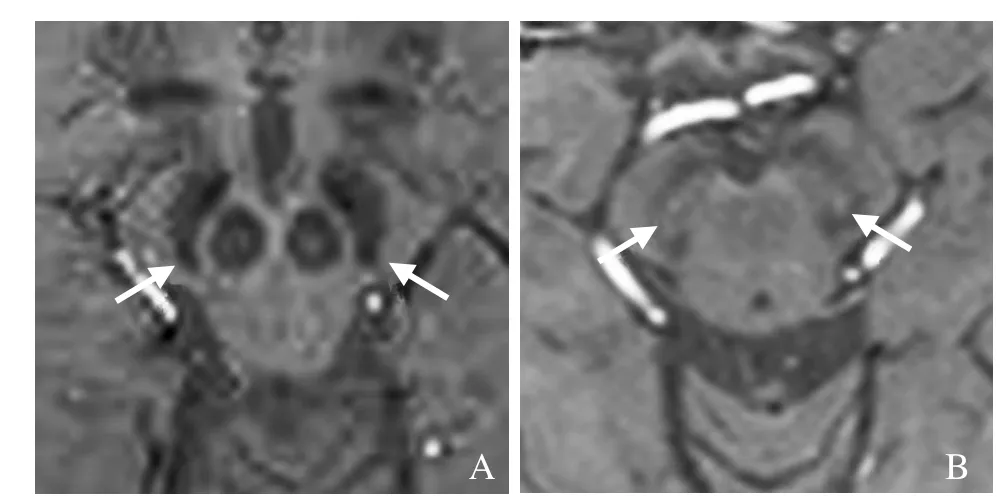
图1 男,67岁,IPD。在SWI序列上黑质区双侧“燕尾征”消失(箭,A);男,65岁,MSA。在SWI序列上黑质区类圆形高信号,代表双侧“燕尾征”存在(箭,B)
1.5 统计学方法 采用SPSS 20.0软件。人口学及临床资料比较采用Kruskal-Wallis检验、χ2检验及Mann-WhitneyU检验;影像学评分比较采用Kruskal-Wallis检验及Dunn多重比较检验;对“燕尾征”鉴别诊断结果绘制受试者工作特性(ROC)曲线,计算曲线下面积(AUC)并评价诊断价值;对患者组“燕尾征”评分与H-Y分级及UPDRS III评分进行Spearman相关性分析。P<0.05表示差异有统计学意义。
2 结果
2.1 H-Y分级及UPDRS III评分 各组受试者H-Y分级差异均无统计学意义(P>0.05);IPD组UPDRS III评分高于MSA组,差异有统计学意义(P<0.05)。见表1。
表1 各组H-Y分级及UPDRS III评分比较±s,分)
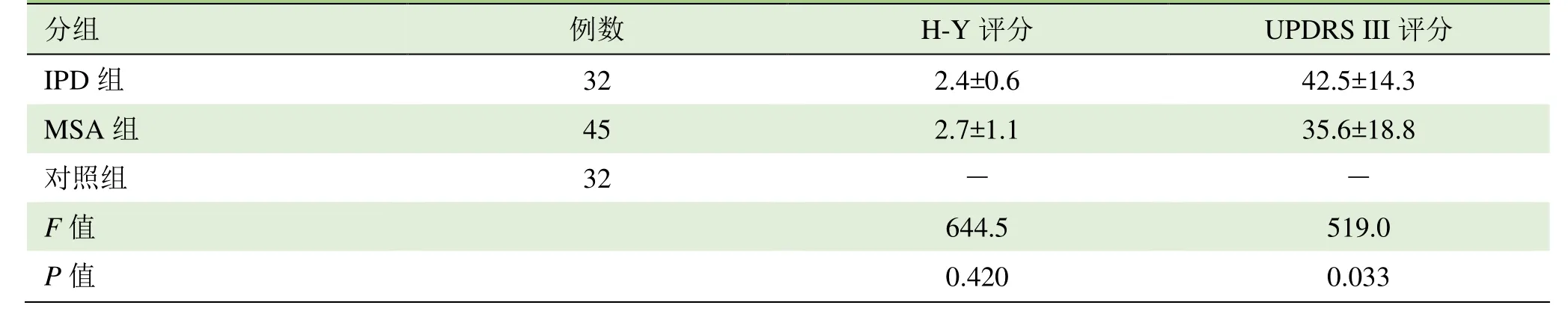
表1 各组H-Y分级及UPDRS III评分比较±s,分)
IPD 组 32 2.4±0.6 42.5±14.3对照组 32 - -P值 0.420 0.033
2.2 组间“燕尾征”评分结果比较 对3组间“燕尾征”双侧评分及最高分分析发现,IPD组“燕尾征”平均分及最高分均低于MSA组及对照组,差异有统计学意义(P<0.05);MSA组“燕尾征”平均分及最高分与对照组间差异无统计学意义(P>0.05)。见表2
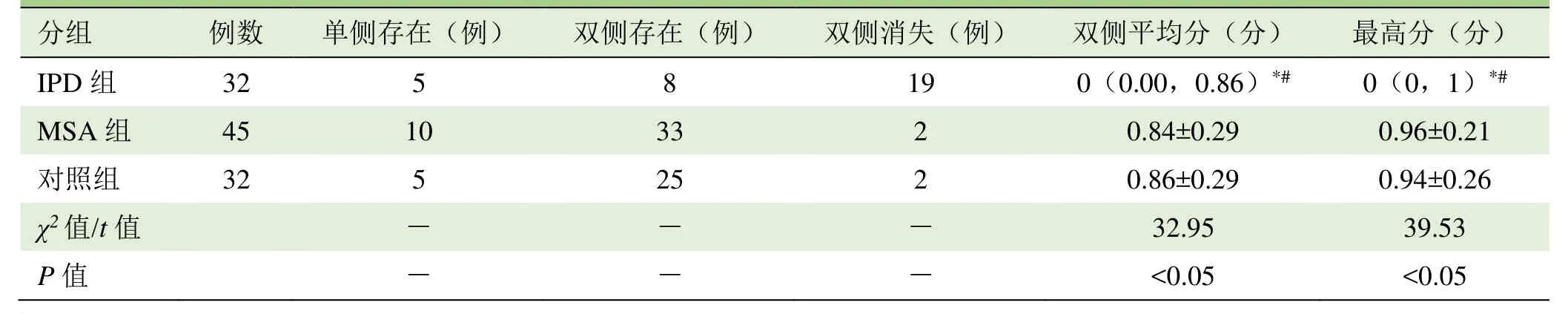
表2 SWI序列各组“燕尾征”的评分结果
2.3 “燕尾征”鉴别诊断效能评价 临床诊断IPD 32例、MSA 45例;2名放射科医师根据“燕尾征”诊断IPD 36例,MSA 41例。“燕尾征”鉴别诊断的敏感度和特异度分别为75.0%及73.3%,AUC为0.74(图2)。
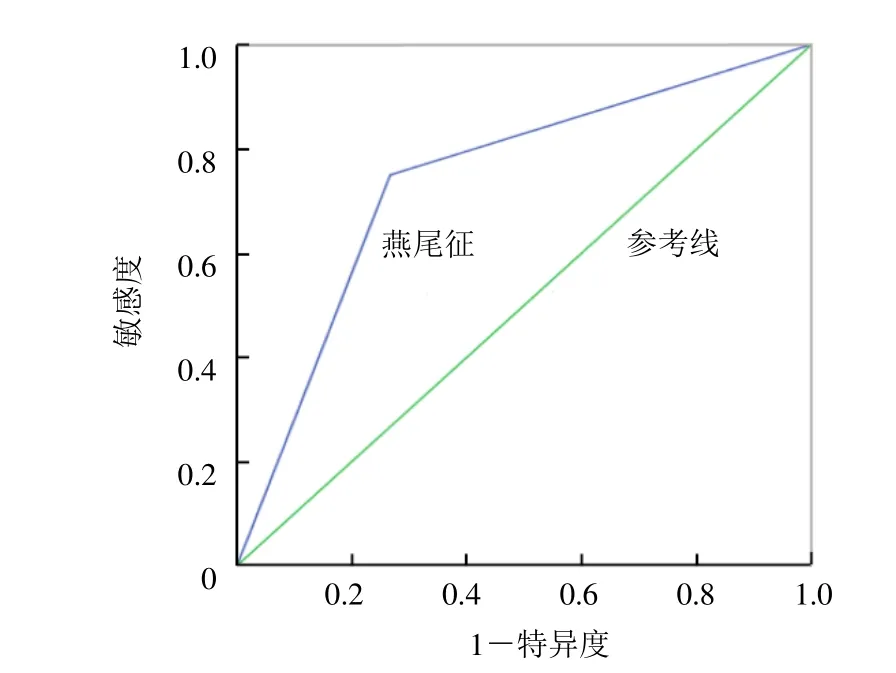
图2 “燕尾征”诊断IPD的ROC曲线
2.4 “燕尾征”与临床评价相关性分析 “燕尾征”最高分与UPDRS III评分呈弱负相关(r=-0.26,P=0.022),与H-Y分级无相关性(P>0.05);患者组“燕尾征”平均分与H-Y分级及UPDRS III评分无相关性(P>0.05)。
3 讨论
IPD和MSA临床症状类似,鉴别困难,其病因及发病机制仍需要进一步研究。但目前脑铁代谢异常在两者发病机制中的作用已经得到证实,有研究发现这2种疾病脑内铁含量增加及铁沉积部位不同[7]。铁的异常沉积可作为鉴别诊断的指征。SWI是以三维T2*加权梯度回波序列为基础,根据不同组织间磁敏感差异,反映组织磁化率属性的对比增强技术,对铁、钙化、微出血、血管外血液产物及血管内去氧血敏感,可反映IPD和MSA的病理学变化,并为其鉴别诊断提供依据[8]。
3.1 “燕尾征”在IPD及正常人中的特点及诊断价值Schwarz等[2]首次将SWI序列上黑质致密部中层后外1/3区的高信号命名为“燕尾征”,并提出“燕尾征”消失时提示诊断IPD。本研究与上述研究结果一致,发现SWI序列上正常人黑质区存在“燕尾征”,而IPD患者中该征象可能消失,这进一步说明“燕尾征”可能是IPD的特征,可以作为影像学诊断指标。“燕尾征”在病理上对应黑质区多巴胺神经元,即黑质小体-1[9]。Blazejewska 等[9]采用7.0T MRI-T2*WI序列联合病理研究发现正常人黑质区存在水滴样或卵圆状高信号;而在IPD患者中未见显示,且该高信号区与染色区域重叠,提示这种高信号可以直接反映黑质小体-1多巴胺能神经元的存在。黑质小体-1是黑质5组黑质小体中最大的一组,位于黑质致密部中层后外1/3区。病理研究发现健康人黑质中的黑质小体代表聚集成群的多巴胺神经元细胞,D28k蛋白免疫组织化学染色阴性[10];而IPD患者神经病理基础为中脑黑质多巴胺能神经元的退化、变性,纹状体多巴胺含量显著减少,从而导致基底节和皮层环路的功能异常,其黑质中丢失的神经元98%属于黑质小体-1[9]。IPD患者临床上出现运动症状时,已有60%~80%的黑质多巴胺神经元变性、丢失,导致异常铁沉积[11]。SWI序列表现为黑质区高信号消失,即“燕尾征”消失[2],其消失的主要原因为黑质小体-1变性,丢失后铁成分增加或神经黑色素细胞减少造成铁存储能力减少,进一步导致更多铁沉积。在SWI序列上顺磁性物质——铁增多,导致该区信号减低,与周围相对低信号的黑质对比度减低,从而导致黑质一致性低信号[9,12]。
3.2 “燕尾征”在IPD及MSA中的鉴别诊断价值MSA的病理改变主要为神经元及胶质细胞丢失,表现为壳核后侧异常的Fe3+沉积[13]。既往研究发现,IPD与MSA的铁沉积部位不同,IPD主要沉积在黑质质密部,MSA主要在壳核[14-15]。MSA患者异常铁沉积的SWI序列具有特异性,表现为壳核边缘从后缘到中间显著的低信号改变[16]。Meijer等[3]将帕金森综合征患者与IPD患者的“燕尾征”进行比较,发现尽管MSA患者例数较少,但也发现MSA患者中“燕尾征”存在,这与本研究中大多数MSA患者可见“燕尾征”的结果一致。本研究对45例MSA患者“燕尾征”特点进行分析,发现其平均分及最高分均显著高于IPD组(P<0.05),但与对照组间差异无统计学意义(P>0.05)。ROC曲线分析对照敏感度与特异度分别为75.0%和73.3%,AUC为0.74,提示“燕尾征”可以作为较好的特征用于IPD与MSA的鉴别诊断。另外,本研究还发现对照组中5例“燕尾征”单侧消失、2例双侧消失,MSA患者中10例单侧消失、2例双侧消失,推断可能与生理性Fe3+沉积及扫描技术有关。部分病理及MRI研究发现随着年龄增长,皮层下核团出现生理性矿物质沉积,这种铁沉积模式可能与疾病模式并不相同,如老年人中苍白球、红核及小脑齿状核出现铁沉积[17]。这种Fe3+沉积可能使“燕尾征”高信号减低,与周围组织对比度减小,是少数正常人“燕尾征”消失的原因。同时,中脑黑质面积小,容易受到骨气伪影响,且IPD及MSA患者在扫描过程中更容易发生头动,这些因素均会影响视觉观察“燕尾征”的存在,这可能是少部分正常人和MSA患者“燕尾征”消失的原因。
3.3 SWI在鉴别诊断IPD及MSA中的优势 既往MRI研究发现T2WI图像上壳核边缘“裂隙征”及脑桥“十字征”在MSA的诊断中具有一定特异性,但敏感度过低;扩散张量成像、磁共振波谱成像及静息态功能MRI主要用于揭示病理生理学机制;SWI的研究取得了较为理想的结果,但大多采用定量分析方法而缺乏统一标准。上述因素均限制了SWI序列在临床中的应用[18]。本研究中视觉评价“燕尾征”前无需复杂的后处理方法,这对于临床应用十分方便,进一步说明了该征象在临床鉴别诊断中的价值[3]。
3.4 “燕尾征”与运动功能评分及临床分期的相关性本研究对所有患者的“燕尾征”评分与H-Y分级及UPDRS III评分进行相关性分析,发现该征象最高分与UPDRS III评分呈负相关(r=-0.26,P=0.022),虽然相关性较弱,然而仍可表明随着黑质多巴胺神经元变性、消失患者运动功能障碍加重,进一步说明局部铁沉积与多巴胺神经元死亡密切相关,参与了疾病的发展;本研究并未发现“燕尾征”评分与H-Y分级存在相关性(P>0.05),这可能说明该征象与疾病的病程无关。鉴于患者样本量较小,对这些相关性的进一步研究可能会为临床提供更多有价值的信息。
本研究的局限性:①尽管有高年资神经内科运动学专家进行诊断,但将临床诊断作为“金标准”而非病理诊断,可能仍有一定的误诊;②样本量较少,且虽然MSA的2个亚型病理改变具有一致性,但并未进行分组分析;③中脑黑质区域小,且在SWI序列上容易受到骨气伪影影响,因此提高序列分辨率仍值得进一步探索。
总之,SWI中“燕尾征”在IPD及MSA鉴别诊断中有较高的敏感度及特异度,可以作为特征,为临床诊断提供可靠线索。但“燕尾征”在MSA患者中存在的病理学机制以及与其他帕金森综合征的鉴别诊断价值仍有待于进一步研究。
[1]Ramli N, Nair SR, Ramli NM, et al. Differentiating multiplesystem atrophy from Parkinson's disease. Clin Radiol, 2015,70(5): 555-564.
[2]Schwarz ST, Afzal M, Morgan PS, et al. The 'swallow tail'appearance of the healthy nigrosome-a new accurate test of Parkinson's disease: a case-control and retrospective crosssectional MRI study at 3T. PLoS One, 2014, 9(4): e93814.
[3]Meijer FJ, Steens SC, Van Rumund A, et al. Nigrosome-1 on susceptibility weighted imaging to differentiate Parkinson's disease from atypical parkinsonism: an in vivo and Ex vivo pilot study. Pol J Radiol, 2016, 81: 363-369.
[4]Gao P, Zhou PY, Wang PQ, et al. Universality analysis of the existence of substantia nigra "swallow tail" appearance of non-Parkinson patients in 3T SWI. Eur Rev Med Pharmacol Sci, 2016, 20(7): 1307-1314.
[5]Hughes AJ, Daniel SE, Kilford L, et al. Accuracy of clinical diagnosis of idiopathic Parkinson's disease: a clinicopathological study of 100 cases. J Neurol Neurosurg Psychiatry, 1992, 55(3): 181-184.
[6]Gilman S, Wenning GK, Low PA, et al. Second consensus statement on the diagnosis of multiple system atrophy.Neurology, 2008, 71(9): 670-676.
[7]Wang C, Fan G, Xu K, et al. Quantitative assessment of Iron deposition in the midbrain using 3D-enhanced T2 star weighted angiography (ESWAN): a preliminary cross-sectional study of 20 Parkinson's disease patients. Magn Reson Imaging, 2013, 31(7): 1068-1073.
[8]Sehgal V, Delproposto Z, Haacke EM, et al. Clinical applications of neuroimaging with susceptibility-weighted imaging. J Magn Reson Imaging, 2005, 22(4): 439-450.
[9]Blazejewska AI, Schwarz ST, Pitiot A, et al. Visualization of nigrosome 1 and its loss in PD: pathoanatomical correlation and in vivo 7 T MRI. Neurology, 2013, 81(6): 534-540.
[10]Damier P, Hirsch EC, Agid Y, et al. The substantia nigra of the human brain. I. Nigrosomes and the nigral matrix, a compartmental organization based on calbindin D(28K)immunohistochemistry. Brain, 1999, 122(Pt 8): 1421-1436.
[11]Fearnley JM, Lees AJ. Ageing and Parkinson's disease:substantia nigra regional selectivity. Brain, 1991, 114(Pt 5):2283-2301.
[12]Zecca L, Casella L, Albertini A, et al. Neuromelanin can protect against iron-mediated oxidative damage in system modeling Iron overload of brain aging and Parkinson's disease. J Neurochem, 2008, 106(4): 1866-1875.
[13]Matsusue E, Fujii S, Kanasaki Y, et al. Putaminal lesion in multiple system atrophy: postmortem MR-pathological correlations. Neuroradiology, 2008, 50(7): 559-567.
[14]Yoon RG, Kim SJ, Kim HS, et al. The utility of susceptibilityweighted imaging for differentiating Parkinsonism-predominant multiple system atrophy from Parkinson's disease: correlation with 18F-flurodeoxyglucose positron-emission tomography. Neurosci Lett, 2015, 584: 296-301.
[15]Han YH, Lee JH, Kang BM, et al. Topographical differences of brain iron deposition between progressive supranuclear palsy and parkinsonian variant multiple system atrophy. J Neurol Sci, 2013, 325(1-2): 29-35.
[16]Meijer FJ, Van Rumund A, Fasen BA, et al. Susceptibilityweighted imaging improves the diagnostic accuracy of 3T brain MRI in the work-up of parkinsonism. Am J Neuroradiol,2015, 36(3): 454-460.
[17]Harder SL, Hopp KM, Ward H, et al. Mineralization of the deep gray matter with age: a retrospective review with susceptibility-weighted MR imaging. Am J Neuroradiol,2008, 29(1): 176-183.
[18]Dąbrowska M, Schinwelski M, Sitek EJ, et al. The role of neuroimaging in the diagnosis of the atypical parkinsonian syndromes in clinical practice. Neurol Neurochir Pol, 2015,49(6): 421-431.
