水凝胶纳米颗粒对溶菌酶的亲和研究
2018-03-14孟子晖吉田田谢腾升
王 哲 薛 敏 孟子晖 吉田田 谢腾升
(北京理工大学化学与化工学院,北京 102488)
1 引 言
蛋白-蛋白相互作用是生命体新陈代谢的基础,也是蛋白质组学的研究方向之一。蛋白抗原-抗体反应是典型的蛋白-蛋白相互作用,即蛋白抗原和相应的抗体在一定条件下特异性结合形成可逆的抗原-抗体复合物的过程。在此过程中,构成蛋白质的多肽链会发生疏水塌缩、空间盘曲、侧链聚集等折叠过程,因此蛋白构象具有柔性的特点[1]。生物大分子间(如蛋白质-蛋白质之间)的作用力包括静电作用力、亲水/疏水作用力以及范德华力。近年来报道了许多根据目标蛋白质表面性质合成的对其有亲和作用的纳米级聚合物材料[2,3],如分子印迹技术[4,5]。针对目标多肽或者蛋白质设计并合成出表面具有正/负电荷、亲水/疏水基团的水凝胶纳米颗粒,理论上应对构象灵活的多肽或者蛋白质有亲和性。
水凝胶作为一种新型的柔性聚合物材料[6,7],由于其具有独特的亲水性、刺激响应性、环境友好和生物相容性等特点,广泛用于给药系统[8]、医学诊疗[9]、生物传感器[10,11]、环境友好器件[12]、吸附分离[13]、生物材料[14]等方面。水凝胶纳米颗粒(NPs)是通过沉淀聚合法得到的水凝胶聚合物[15]。Conde等[16]制备了含有纳米颗粒和纳米棒的水凝胶贴片,并用于肿瘤部位,实现局部肿瘤的消除并预防复发。Shea等模拟天然抗体制备出尺寸与免疫球蛋白相当[17]的聚合物纳米粒子“塑料抗体”[18],并成功用于体内外毒素消除[19,20]。天然抗体及通过基因工程得到的人工抗体制备分离过程复杂,价格昂贵,在疾病诊断治疗中有一定限制,而“塑料抗体”的应用为疾病的治疗提供了一条新途径。利用温敏性水凝胶聚合物的温敏特点,可以避免蛋白在高温下变性,Beierle等[21]测试了此类材料在85℃下对蛋白质的保护作用,表明该材料可以有效保护蛋白活性。
溶菌酶是一种碱性蛋白,分子量约为14 kDa,是具有杀菌作用的天然抗感染物质。通常采用亲和层析法、离子交换柱法、盐析法等从蛋清中提取溶菌酶,过程较繁琐[22]。 本研究基于溶菌酶的内疏水、外亲水结构,设计合成一种纳米颗粒,通过优化N-异丙基丙烯酰胺(NIPAm)、丙烯酸(Aac)和N-叔丁基丙烯酰胺(tBAM)等功能单体的配比,并调节制备过程中的表面活性剂含量,得到系列NPs,用于对溶菌酶亲和性研究,初步探究其吸附机理,利用其温敏性实现对溶菌酶简单快速的吸附分离。
2 实验部分
2.1 仪器与试剂
Zetasizer Nano-ZS型动态光散射激光粒度仪(英国Malvern公司); FDU-2100型冷冻干燥仪(北京优莱博技术有限公司); MS-100型恒温混匀仪(杭州奥盛仪器有限公司); 1-14型台式离心机(德国Sigma公司); UV-1600型紫外可见分光光度计(上海美谱达仪器有限公司); AWL-0502-U型艾科浦超纯水机(重庆台浦有限公司); Nanosep®300K型超滤管(美国Pall公司)。
丙烯酸(Aac,纯度99%)、N-异丙基丙烯酰胺(NIPAm,纯度99%)、N,N'-亚甲基双丙烯酰胺(Bis,纯度98%)、丙烯酰胺(AM,纯度98%)、溶菌酶(来源于鸡蛋, ≥20000 U/mg)和三氟乙酸(TFA,纯度97%)购于北京百灵威科技有限公司;N-叔丁基丙烯酰胺(tBAM,纯度97%,阿拉丁试剂有限公司); 十二烷基硫酸钠(SDS,分析纯,天津市福晨化学试剂厂); 过硫酸铵(APS,分析纯,北京化工厂); 2,2-乙氧基苯乙酮(DEAP,纯度99%,阿法埃莎试剂公司); 二甲基亚砜(DMSO,分析纯,国药集团化学试剂公司); 乙腈(色谱纯,赛默飞世尔科技公司)。
2.2 实验方法
2.2.1水凝胶纳米颗粒的制备采用沉淀聚合法合成水凝胶纳米颗粒(NPs)[23]。将适量Aac、tBAM(溶解于乙醇中)、Bis、NIPAm溶于水后加入到100 mL三口瓶,再加入0~1 mg/mL SDS溶液,混合均匀后,配制成50 mL 65 mmol/L单体溶液,通氮气除氧30 min后,加热; 体系温度升高到65℃,加入30 mg (0.1110 mmol)引发剂APS,反应3 h。反应过程中,溶液体系颜色由无色透明变为淡蓝色,最终得纯白色溶液。将所得溶液装入透析袋中(MWCO 14000),用纯水透析纯化5天。
2.2.2水凝胶纳米颗粒的表征用动态光散射粒径仪对所制备的聚合物溶液在25℃测定粒径和Zeta电位,在Trend模式下调整温度2.5℃~35℃,测定样品在不同温度下粒径变化,温度梯度为使用Zetasizer Nano软件分析结果。取5 mL水凝胶纳米颗粒溶液经真空冷冻干燥机冻干后,用称重法测其浓度。
2.2.3水凝胶纳米颗粒对溶菌酶的亲和作用将适量NPs溶液与溶菌酶溶液在35 mmol/L PBS缓冲溶液中35℃混合振荡,得到的混合液用离心超滤管(MWCO 300 kDa)13000 r/min离心10 min,检测滤液281 nm处吸光度,计算得溶菌酶浓度及吸附率。平行测定3次取平均值。吸附率(A)通过公式(1)计算:
A=(C0-C1)/C0(1)
其中,C0是吸附前溶液的浓度,C1是吸附后溶液的浓度。
2.2.4水凝胶纳米颗粒对溶菌酶的吸附分离将0.15 mg/mL溶菌酶与5.96 mg/mL NPs溶液混合(35 mmol/L PBS缓冲液)在35℃下振荡10 min,用离心超滤管常温离心后取滤液,测定其吸光度,计算溶菌酶浓度。平行测定3次。然后将浓缩溶液用PBS溶液稀释至1 mL,混匀后置于0℃中30 min,4℃离心后测定滤液中释放的溶菌酶吸光度,计算滤液中的溶菌酶浓度。用PBS溶液将脱附溶菌酶后的浓缩液淋洗3次,并最终稀释至500 μL,用于下一次吸附。如此反复3次,过程如图1所示。

图1 水凝胶纳米颗粒对溶菌酶吸附分离过程示意图。 Filtrate a, 吸附后的滤液; Filtrate e, 低温洗脱后的滤液Fig.1 Schematic illustration of adsorption and separation of hydrogels on lysozyme. Filtrate a, filtrate after the adsorption; Filtrate e, filtrate after cold elution
3 结果与讨论
3.1 水凝胶纳米颗粒的合成与表征
由NIPAm、Aac、tBAM和交联剂Bis聚合制备NPs。通过改变单体及表面活性剂用量,合成一系列的NPs,利用扫描电镜(SEM)对NPs形貌进行表征。以NIPAm-Aac-tBAM-Bis(38∶20∶40∶2,n/n)配方的水凝胶纳米颗粒为例,由图2A可见,合成的样品呈球形,分散均匀,粒径均一,约为105 nm。从图2B可见,聚合物粒径分布范围较窄,聚合物分散性指数PDI=0.043,粒径均匀。由于水化层的存在,测得粒径略大于扫描电镜所测粒径,微球在溶液中的粒径为138 nm。

图2 水凝胶纳米颗粒的表征: (A) SEM图, (B) DLS粒径分布图Fig.2 Characterization of hydrogel nanoparticles (NPs). (A) Scanning electron microscopy (SEM) image, (B) Dynamic light scattering (DLS) characterization
3.2 水凝胶纳米颗粒单体配方对蛋白的亲和作用的影响
NIPAm系水凝胶作为一种响应性材料,通过施加外部刺激可以调控与生物分子之间的作用力,并且NIPAm可与功能单体共聚,通过配体与生物分子间的相互作用,如氢键、静电作用、疏水作用、范德华力和π-π键等,实现聚合物对目标分子的特异性结合。而不同的单体配比影响聚合物的表面电荷和疏水性。考察了体系中电负性单体和疏水性单体的摩尔含量对NPs吸附溶菌酶的影响。
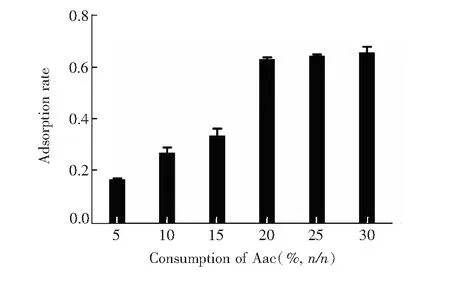
图3 水凝胶纳米颗粒中Aac摩尔含量对溶菌酶吸附性能的影响Fig.3 Effect of acrylic acid (Aac) concentration in hydrogel NPs on lysozyme adsorption properties
3.2.1电负性单体Aac对吸附的影响由于溶菌酶带有正电荷,带负电基团的聚合物可与之结合。Aac是电负性单体,其含量会影响NPs对溶菌酶的吸附能力。不同Aac含量的NPs对溶菌酶的吸附率如图3所示,Aac含量的对NPs亲和力的影响较大,Aac含量越高,亲和力越强,当Aac含量>20%(n/n)时,吸附率达到60%,且增速变缓。除静电作用外,聚合物中的Aac含有羧基,可通过离子键与胺发生作用,也可与酰胺、羧基产生氢键作用,对生物分子有许多作用位点,所以Aac含量增大可以增强NPs对溶菌酶的亲和力。但当Aac含量>25%(n/n)时,合成的NPs分散性较差,且久置易团聚,因此后续实验不采用Aac含量>20%(n/n)的NPs用于吸附。

图4 水凝胶纳米颗粒中tBAM摩尔含量对溶菌酶吸附性能的影响Fig.4 Effect of N-tert tutyl acrylamide (tBAM) concentration in hydrogel NPs on lysozyme adsorption properties
3.2.2疏水单体tBAM对吸附的影响溶菌酶带有正电荷,也含有疏水基团,tBAM是疏水性单体,可以为聚合物提供疏水作用位点。不同tBAM含量的NPs对溶菌酶的吸附率如图4所示,当tBAM含量为40%(n/n)时亲和力最强。tBAM摩尔含量从10%增加至40%(n/n),吸附率呈缓慢增大的趋势,这是因为tBAM含量增加,疏水作用位点增多,有利于NPs与生物分子间的相互作用。继续增加tBAM含量,NPs对溶菌酶的亲和力反而下降。这是因为聚合物中疏水单体含量增大时,不仅会增强聚合物与目标多肽的作用力,同时也会增大水凝胶纳米颗粒之间的排斥作用,当tBAM含量>40%(n/n)时,水凝胶纳米颗粒间的斥力影响了总的吸附效果。
根据上述优化实验结果,在制备NPs时,Aac和tBAM的含量分别采用20%(n/n)和40%(n/n)。此外,通过对比不同Aac和tBAM含量的两种配方的水凝胶纳米颗粒对溶菌酶的吸附情况,发现Aac对溶菌酶吸附率的影响远高于tBAM,表明Aac含量是影响吸附的主要因素,即静电作用在水凝胶纳米颗粒对溶菌酶的吸附起主导作用。这也与溶菌酶内疏水外亲水的结构特征相符。
3.3 水凝胶纳米颗粒粒径对蛋白的亲和作用的影响
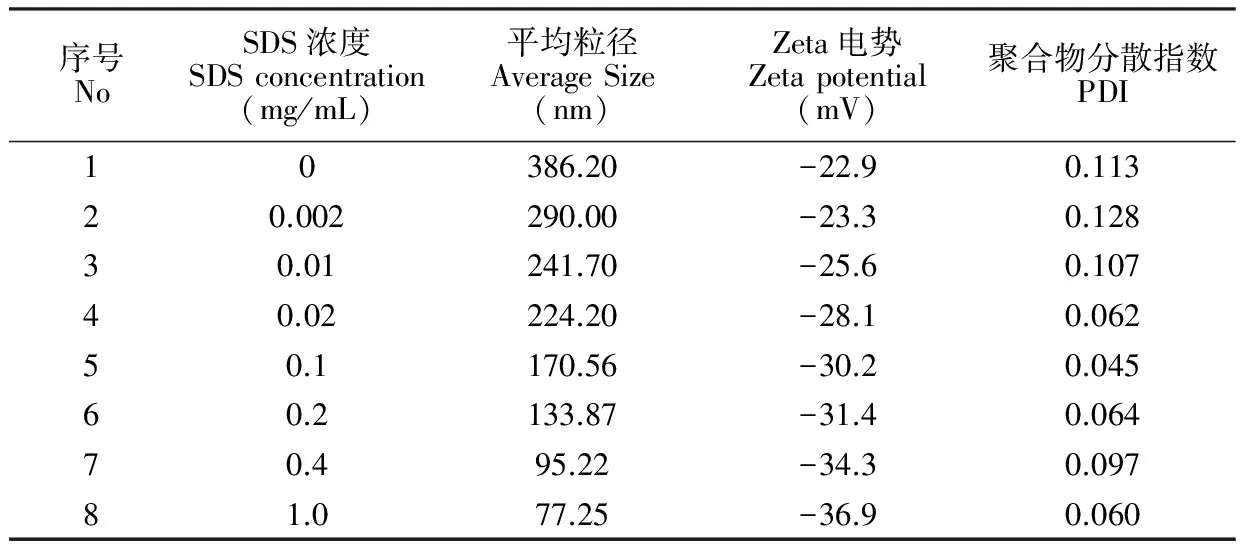
在聚合反应中,表面活性剂SDS的浓度会对粒子的成核、增长产生影响,进而影响NPs的粒径。对于按照NIPAm-Aac-tBAM-Bis(38∶20∶40∶2,n/n)制备的NPs,调节聚合时SDS浓度,得到一系列粒径的NPs。通过DLS测试其粒径及其分布及表面电势(表1)。
表1 SDS含量对水凝胶纳米颗粒粒径及表面电势的影响
Table 1 Relationship between SDS concentration and size/zeta potential of NPs
序号NoSDS浓度SDSconcentration(mg/mL)平均粒径AverageSize(nm)Zeta电势Zetapotential(mV)聚合物分散指数PDI10386.20-22.90.11320.002290.00-23.30.12830.01241.70-25.60.10740.02224.20-28.10.06250.1170.56-30.20.04560.2133.87-31.40.06470.495.22-34.30.09781.077.25-36.90.060
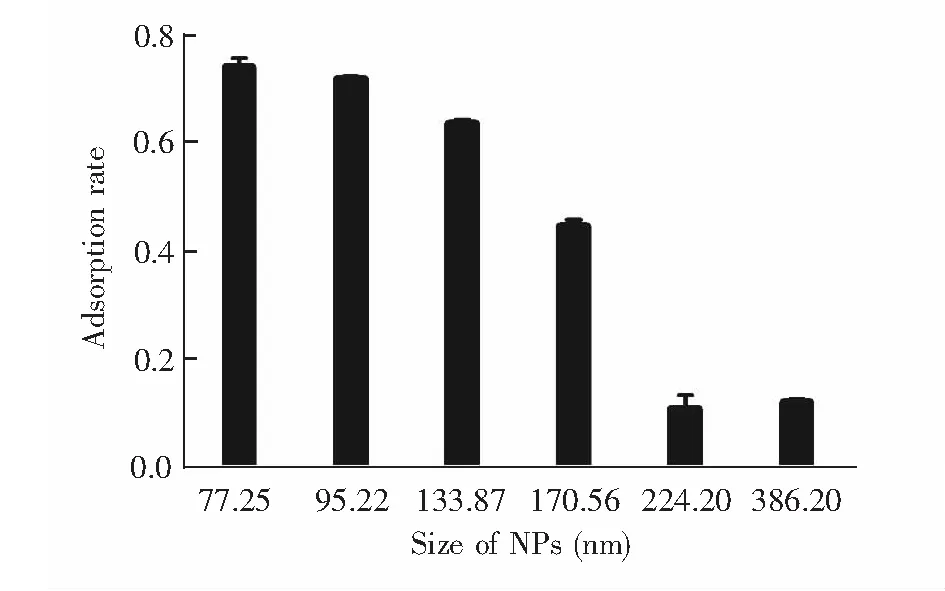
图5 NPs粒径对吸附溶菌酶性能的影响Fig.5 Effect of NPs size on lysozyme adsorption properties
当预聚溶液中,SDS浓度从0 mg/mL增大到1 mg/mL,NPs粒径从386.20 nm减小至77.25 nm。聚合物颗粒形成的过程中,在引发剂的作用下,体系中的部分单体形成了带自由基的胶束,胶束增长形成带有自由基的不稳定的初级粒子,初级粒子继续增长至体系中的单体全部耗尽,形成最终的聚合物颗粒。一般情况下,初级粒子间容易结合并形成大的粒子,而初级粒子表面带有负电,体系加入阴离子表面活性剂SDS后,初级粒子之间的静电斥力增强,可以在溶液中均匀且稳定分散而不易与其它初级粒子结合,即体系中形成的初级粒子数量增多,最终的纳米颗粒粒径减小。故SDS浓度越大,NPs粒径越小,此结果与先前的报道一致[24]。且当SDS含量大于0.1 mg/mL时,NPs在水溶液中的表面电势ζ值<-30 mV,表明聚合物体系稳定性较好。
NPs粒径对溶菌酶吸附的影响如图5所示,粒径越小的NPs对溶菌酶的亲和力越强,推测可能是小粒径的纳米颗粒具有较大的比表面积,提供了较多的吸附位点。而粒径过小的NPs离心分离较困难,故选择1 mg/mL SDS作为聚合时所用的浓度。
3.4 水凝胶纳米颗粒对溶菌酶的吸附性能研究
经过优化后的NPs用于对溶菌酶吸附性能的研究。将系列浓度的溶菌酶溶液与1.49 mg/mL NPs溶液于35 mmol/L PBS缓冲液中混合均匀,35℃下振荡30 min后,离心后取滤液,用紫外分光光度计测定溶液中溶菌酶的吸光度,计算吸附量,并绘制平衡吸附量对平衡浓度的关系。由图6可知,对于一定量的NPs,随着吸附溶液中溶菌酶浓度的增大,NPs对溶菌酶的吸附量逐渐增大。当溶菌酶浓度达到0.15 mg/mL时吸附达到饱和,吸附率可达到68.7%。
将0.15 mg/mL 溶菌酶与1.49 mg/mL NPs的混合溶液,35℃下振荡不同时间后离心,测定滤液中溶菌酶的吸光度,计算吸附量,并绘制吸附量对时间的吸附动力学曲线, 结果如图7所示。在初始的3 min内,吸附量急剧增长,3min后吸附趋于平衡, NPs对溶菌酶的吸附在5 min内即可达到平衡。

图6 NPs对溶菌酶的静态吸附曲线Fig.6 Static adsorption dynamics of hydrogel NPs on lysozyme

图7 NPs对溶菌酶吸附的动力学曲线Fig.7 Adsorption kinetics of hydrogel NPs on lysozyme
3.5 水凝胶纳米颗粒对溶菌酶的吸附分离
NPs中含有温敏性单体N-异丙基丙烯酰胺(NIPAm),具有温度敏感性。NIPAm系水凝胶的低临界温度(Lower critical solution temperature,LCST)为32 ℃,接近人体温度,而加入电负性单体Aac和疏水性单体tBAM后,其LCST会发生改变。经测量,NPs的LCST≈12℃,如图8A所示。在此温度以上NPs为收缩状态,对溶菌酶有吸附作用; 在此温度以下,NPs发生溶胀,将吸附的溶菌酶释放到溶液中,如图8B所示。为了研究NPs对溶菌酶的吸附和脱附性能,分别在0℃与35℃下处理混合溶液。
图8C显示了NPs对溶菌酶的吸附分离性能,经吸附后,滤液中溶菌酶的含量可以降至母液浓度的22.8%以下,经脱附后的滤液可以达到母液浓度的62.1%以上。即通过控制温度变化,一定程度上可以实现对溶菌酶的富集。循环吸附和脱附3次后,NPs仍然具有较好的吸附分离性能。

图8 水凝胶纳米颗粒粒径随温度的变化(A),吸附示意图(B),NPs对溶菌酶吸附分离(C) 图C中a为吸附后的滤液; e为低温洗脱后的滤液Fig.8 (A) Size change of NPs with temperature, (B) scheme of adsorption and separation, and (C) adsorption and separation of hydrogels on lysozyme. a is the filtrate after the adsorption; e is the filtrate after cold elution in (C)
4 结 论
利用沉淀聚合法合成了一系列具有亲电和疏水基团的温敏性水凝胶纳米颗粒,具有性质稳定且粒径均匀可控的特点。将水凝胶纳米颗粒用于对溶菌酶的吸附,得到对溶菌酶吸附的最优配方,并考察了吸附条件。水凝胶纳米颗粒对溶菌酶的吸附表现出吸附时间短、可重复利用等优点,对实际样品中溶菌酶具有较好的吸附率。利用水凝胶纳米颗粒的温敏性特点,可以实现对溶菌酶的吸附及脱附,在溶菌酶的分离提纯中具有良好的应用前景。
1 Cozzini P, Kellogg G E, Spyrakis F, Abraham D J, Costantino G, Emerson A, Fanelli F, Gohlke H, Kuhn L A, Morris G M, Orozco M, Pertinhez T A, Rizzi M, Sotriffer C A.J.Med.Chem.,2008, 51(20): 6237-6255
2 SHAN Bing-Hui, WANG Chao-Zhan, WEI Yin-Mao.ChineseJ.Anal.Chem.,2016, 44(7): 1119-1124
单丙辉, 王超展, 卫引茂. 分析化学,2016, 44(7): 1119-1124
3 SUN Wen-Tong, WANG Shi-Xing, ZHANG Xiao-Hong, ZHONG Du-Bo, WANG Ya-Qin, ZHU Hong-Kun, LI Jun-Ming.ActaChim.Sinica,2011, 69(3): 351-355
孙文通, 王仕兴, 张晓红, 钟读波, 王亚琴, 祝红昆, 李军明. 化学学报,2011, 69(3): 351-355
4 Chen W, Ma Y, Pan J, Meng Z, Pan G, Sellergren B.Polymers,2015, 7(9): 1689-1715
5 Lu Y, Yan C L, Gao S Y.Appl.Surf.Sci.,2009, 255(12): 6061-6066
6 Xia L W, Xie R, Ju X J, Wang W, Chen Q M, Chu L Y.Nat.Commun.,2013, 4(7): 2226-2236
7 LIU Zhuang, XIE Rui, JU Xiao-Jie, WANG Wei, CHU Liang-Yin.Chem.Ind.Eng.Prog.,2016, 35(6): 1812-1819
刘 壮, 谢 锐, 巨晓洁, 汪 伟, 褚良银. 化工进展,2016, 35(6): 1812-1819
8 Andrei M, Turturica G, Stanescu P O, Teodorescu M.SoftMater.,2016, 14(3): 162-169
9 Koide H, Yoshimatsu K, Hoshino Y, Lee S H, Okajima A, Ariizumi S, Narita Y, Yonamine Y, Weisman A C, Nishimura Y, Oku N, Miura Y, Shea K J.Nat.Chem.,2017, 9(7): 715-722
10 Cai Z Y, Smith N L, Zhang J T, Asher S A.Anal.Chem.,2015, 87(10): 5013-5025
11 YANG Zhao-Kun, ZHANG Xiao-Dong, SHI Dong-Jian, CHEN Ming-Qing, LIU Shi-Rong.Chem.J.ChineseUniversities,2016, 37(5): 37-42
杨兆昆, 张晓栋, 施冬健, 陈明清, 刘士荣. 高等学校化学学报,2016, 37(5): 37-42
12 Xu W, Huang L B, Wong M C, Chen L, Bai G X, Hao J.Adv.Funct.Matter.,2017, 7(1): 1-8
13 He X J, Wei B, Mi Y L.Chem.Commun.,2010, 46(34): 6308-6310
14 Sun W X, Xue B, Li Y, Qin M, Wu J Y, Lu K, Wu J H, Cao Y, Jiang Q, Wang W.Adv.Funct.Mater.,2016, 26(48): 9044-9052
15 Pelton R.Adv.ColloidInterfaceSci.,2000, 85(1): 1-33
16 Conde J, Oliva N, Zhang Y, Artzi N.Nat.Mater.,2016, 15(10): 1128-1140
17 Lee S H, Hoshino Y, Randall A, Zeng Z, Baldi P, Doong R-a, Shea K J.J.Am.Chem.Soc.,2012, 134(38): 15765-15772
18 Hoshino Y, Kodama T, Okahata Y, Shea K J.J.Am.Chem.Soc.,2008, 130(46): 15242-15243
19 O'Brien J, Lee S H, Onogi S, Shea K J.J.Am.Chem.Soc.,2016, 138(51): 16604-16607
20 Hoshino Y, Shea K J.J.Mater.Chem.,2011, 21(11): 3517-3521
21 Beierle J M, Yoshimatsu K, Chou B, Mathews M A A, Lesel B K, Shea K J.Angew.Chem.Int.Ed.,2014, 53(35): 9275-9279
22 YUAN Jing-Xiang, WANG Chao-Zhan, WEI Yin-Mao.ChineseJ.Anal.Chem.,2016, 44(12): 1892-1899
袁景香, 王超展, 卫引茂. 分析化学,2016, 44(12): 1892-1899
23 Yoshimatsu K, Yamazaki T, Hoshino Y, Rose P E, Epstein L F, Miranda L P, Tagari P, Beierle J M, Yonamine Y, Shea K J.J.Am.Chem.Soc.,2014, 136(4): 1194-1197
24 Wedel B, Brändel T, Bookhold J, Hellweg T.ACSOmega,2017, 2(1): 84-90
