铅对塿土细菌群落组成的影响研究
2018-03-14安凤秋吕家珑李海红赵琪琪
安凤秋,吕家珑,刁 展,李海红,赵琪琪
(1.西北农林科技大学资源环境学院,农业部西北植物营养与农业环境重点实验室,陕西 杨凌 712100;2.西安工程大学环境与化学工程学院,西安 710048)
土壤是人类赖以生存的重要资源,近年来,我国土壤重金属污染问题日趋突出。大量研究表明,重金属进入土壤可改变土壤的微生物活性,使群落结构及多样性发生变化[2-5]。阎姝等[5]报道了重金属污染的稻田土壤微生物量显著下降,细菌和真菌脂肪酸(PLFA)变化幅度达到30%以上。Gough等[6]报道长期受不同浓度重金属污染的淡水沉积物中,土壤微生物群落结构发生了改变和重建。Deng等[7]研究表明,重金属污染可对农田土壤根际微生物的群落结构和多样性产生显著影响。
研究微生物群落结构的方法主要有Biolog微平板法[10]、脂肪酸法[4,7]和 PCR变性梯度凝胶电泳(DGGE)[9-10]等,这些方法在灵敏度和精确度方面有一定的局限性。高通量DNA测序技术用于研究土壤微生物群落结构在精确度和灵敏度方面较上述方法均有大幅度提高。Ye等[11]采用高通量测序技术研究了活性污泥和污水中的微生物群落结构,结果显示变形菌纲和热孢菌纲相对丰度较高,污水中分支杆菌属和弧菌属是优势菌群。目前高通量测序技术大多用于研究污泥、废水、尾矿及森林等生态系统的微生物群落组成变化[11-13],对重金属污染土壤的细菌群落组成相关内容的报道较少,有少数研究以重金属复合污染和实验室模拟污染土壤为研究对象[14-15],探讨了重金属污染对土壤微生物群落的影响。目前,采用高通量技术对铅污染的塿土农田土壤细菌群落组成变化的研究还很有限。
鉴于此,本试验采用高通量技术研究铅对塿土细菌群落组成的影响,揭示土壤理化性质与细菌群落组成之间的关系,为重金属污染土壤的早期预警和生物修复提供依据。
1 材料与方法
1.1 研究地点及试验设计
田间试验地位于陕西省杨凌示范区五泉镇(34°17′51″N,108°00′48″E)国家黄土肥力和肥料效益监测基地,该基地海拔524.7 m,年平均气温约13℃,年平均降水量为585 mm。供试土壤属褐土类塿土亚类,红油土属,厚层红油土种(土垫旱耕人为土),黄土母质。该试验地周围为农田,无工业企业分布。
试验设3个处理,每处理3个重复,分别为对照(WCK)、低铅处理(WLOW)、高铅处理(WHIGH)。低铅处理添加 Pb(NO3)2浓度为 175 mg·kg-1;高铅处理添加Pb(NO3)2浓度为 350 mg·kg-1;对照不添加 Pb(NO3)2溶液。共9个小区,每个小区长2 m,宽1 m,小区之间设宽度为0.5 m的隔离行,并在每个小区四周埋设深度为0.5 m水泥隔板。于2010年6月3日将对应浓度Pb(NO3)2溶液添加至相应小区耕层中,对照组添加等体积的水,通过人工耕翻使0~20 cm表层土壤混合均匀;土壤含水量为田间持水量的80%,老化。之后,在小区实施小麦-玉米轮作。小麦、玉米品种分别为小偃22和陕单16。试验前在小区土壤中施氮磷钾底肥,底肥用量:尿素 0.15 g·kg-1;Ca(H2PO4)20.05 g·kg-1;K2SO40.10 g·kg-1。
2013年12月,采用“梅花”5点取样法,用土钻采集土壤样品,取样深度为0~20 cm,每个小区采集土样约0.5 kg,将土样充分混匀后去除植物残体及石砾,取其中约0.1 kg装入灭菌的自封袋中,置冰盒中迅速带回实验室,过2 mm筛后保存于-80℃冰箱中进行分子生物学分析;其余土样装入自封袋中带回实验室,室温下自然风干,过筛后测定土壤基本理化性质及重金属含量。
1.2 样品分析
土壤pH值测定的土水比(质量∶体积)为1∶2.5;土壤有机质的测定采用重铬酸钾外加热法;速效钾的测定用火焰光度法;速效磷采用0.5 mol·L-1的NaHCO3浸提、钼锑抗比色分光光度法测定;碱解氮采用碱解扩散法测定,上述方法均参照鲍士旦[16]的分析方法。
铅全量采用 HNO3-HCl-HClO4消解火焰原子吸收(PE,AA800,美国)光谱法测定[16],有效态铅(APb)采用 EDTA 浸提[17]ICP-MS(Thermo,XseriesⅡ,美国)测定,每个样品设置3个重复,取其平均值计算每个处理的相关指标。
1.3 DNA提取、PCR扩增和测序
采用DNA试剂盒提取土壤总DNA,型号为FastDNARspin kit(MP bio,Santa Ana,美国)。DNA浓度和质量采用超微量核酸蛋白测定仪检测(Thermo,NanoDrop ND 2000,美国),将符合试验要求的DNA送深圳华大基因公司扩增,通过Illumina MiSeq平台完成高通量测序。PCR扩增采用16S rDNA基因V4区的通用引物 515F(5′-GTG CCA GCM GCC GCG GTAA-3′)和 806R(5′-GGA CTA CHV GGG TWT CTA AT-3′)。PCR反应条件如下,预变性:95℃保持3 min;变性:95 ℃保持 30 s;退火:56 ℃保持 30 s;延伸:72℃保持45 s,共30个循环;72℃延伸20 min。序列平均长度253 bp,已提交NCBI数据库,序列号SRP075183。
1.4 数据分析
采用Mothur(V.1.36.1)过滤数据,获得高质量的优化序列,利用软件USEARCH(v7.0.1090)在97%相似度下进行聚类得到可操作分类单元(OTU)的代表序列;通过RDP classifer(v2.2)软件将OTU代表序列与数据库比对进行物种注释,统计每个样品在每个OTU中的丰度信息。
采用SPSS 22.0软件对样品的土壤基本理化性质、细菌丰度与多样性指数、组间差异物种进行单因素方差分析(LSD法)和斯皮尔曼(Spearman)相关性分析。应用CANOCO 4.5软件对环境因素和细菌群落结构进行冗余分析(RDA)。
2 结果与分析
2.1 土壤性质
土壤理化性质和铅含量见表1。3个处理的土壤含水量、有机质、速效磷、速效钾、有效态铅和总铅含量有显著差异(P<0.05),pH和碱解氮含量无显著差异(P>0.05)。
1.2.1 仪器 使用GE-VolusonE8型彩色多普勒超声诊断仪(GE,美国),阴道探头RIC5-9-D,频率5~9 MHz,常规腹部探头4C-D,频率1.7~6.2 MHz,经腹三维容积探头RA B4-8-D,占用率2.4~5.8 MHz。检查中保持每例患者参数设定一致。宫腔镜为Olympas 4.5 cm、6.5 cm连续灌流宫腔镜(Olympas,日本)。
2.2 土壤细菌群落组成
9个土壤样品高通量测序共得到153 653条高质量序列,平均每个样品获得17 073条序列。以97%相似度划分共得到14 414个OTU,样品中OTU数目范围为1574~1652,平均每个样品中有1601个OTU。
表2为3个处理的序列数及多样性指数。方差分析结果显示:WCK与WHIGH处理的序列数有显著性差异(P<0.05);WLOW和WHIGH处理的丰富度指数(Chao和 ACE)具有显著性差异(P<0.05),且WLOW处理的丰富度指数大于WHIGH处理的相应值,说明WLOW处理的细菌群落丰富度高于WHIGH;比较多样性指数(Shannon和 Simpson),WCK、WLOW 和WHIGH处理之间均无显著性差异(P>0.05)。
在97%的OTU相似度下,3个处理共得到2582个OTU(图1),其中WCK和WLOW处理共有1822个OTU,WCK和WHIGH处理共有1796个OTU,WLOW和WHIGH处理共有1814个OTU,其中1697个OTU为3个处理共有,且WHIGH处理特有OTU数为204个,高于WCK和WLOW处理。
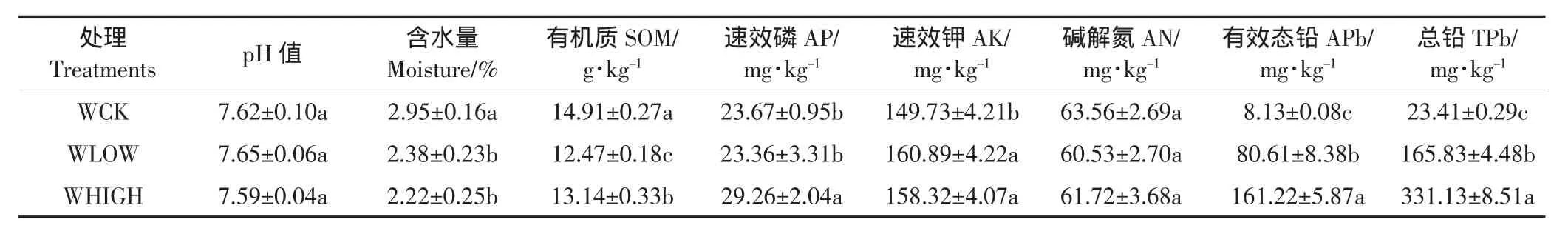
表1 土壤理化性质和铅含量Table1 Characteristics of soil samples and lead content
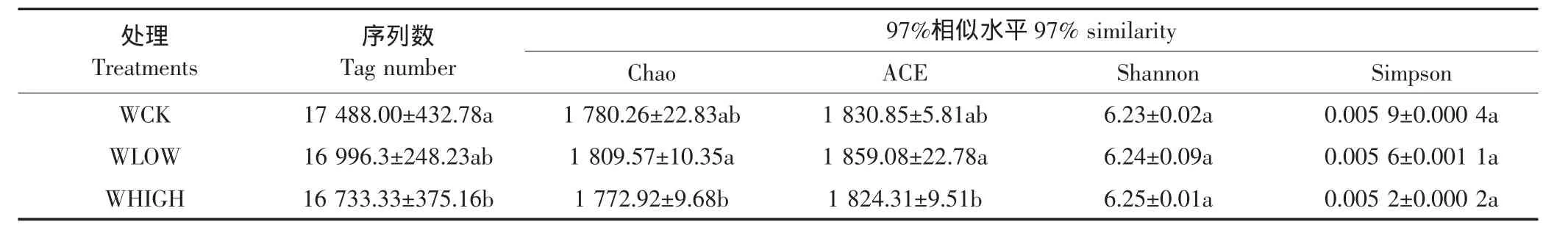
表2 不同处理间土壤细菌丰度与多样性指数Table2 Soil bacterial abundance and diversity indices between different treatments
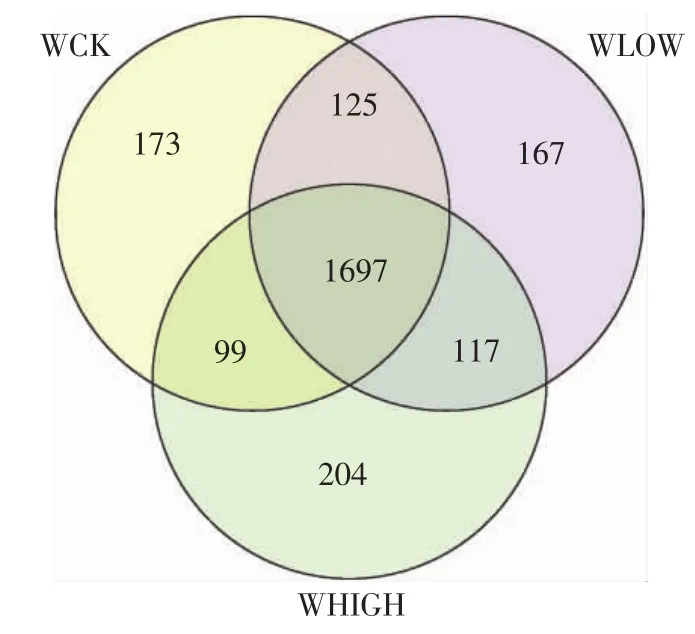
图1 3个处理的Venn图(OTUS0.03)Figure1 Venn diagram shared bacterial OTU among three treatments(OTUS0.03)
2.3 细菌群落组成
2.3.1 门水平上的群落组成
3个处理的细菌群落组成大体相似,分别属于27个门,31个纲,39个目,43个科,13个属,但各种细菌所占比例略有差异。如图2所示:变形菌门(Proteobacteria,平均相对丰度为25%)为最主要优势菌群,第二优势菌为放线菌门(Actinobacteria,平均相对丰度为18.60%),其他相对丰度较高的菌群有:酸杆菌门(Acidobacteria,平均相对丰度为17.82%),拟杆菌门(Bacteroidetes,平均相对丰度为12.04%),绿弯菌门(Chloroflexi,平均相对丰度为5.84%),浮霉菌门(Planctomycetes,平均相对丰度为5.27%),厚壁菌门(Firmicutes,平均相对丰度为5.22%)和芽单胞菌门(Gemmatimonadetes,平均相对丰度达3.59%)。放线菌门(Actinobacteria)在 WHIGH处理中含量略高于WLOW 和 WCK处理,酸杆菌门(Acidobacteria)在WLOW处理中的含量略高于WCK和WHIGH处理,其余菌群在3个处理中差别不大。
2.3.2 纲水平上的群落组成
2.3.3 目水平上的群落组成
目分类水平上共得到39个菌群,放线菌目(Actinomycetales,平均相对丰度为9.74%)是优势菌群,相对丰度大于3%的菌群还有:蓝藻菌目(Cytophagales),Saprospirales目,乳酸杆菌目(Lactobacillales),鞘脂单胞菌目(Sphingomonadales)。WHIGH处理中的放线菌目(Actinomycetales)和蓝藻菌目(Cytopha gales)相对丰度在3个处理中最高。
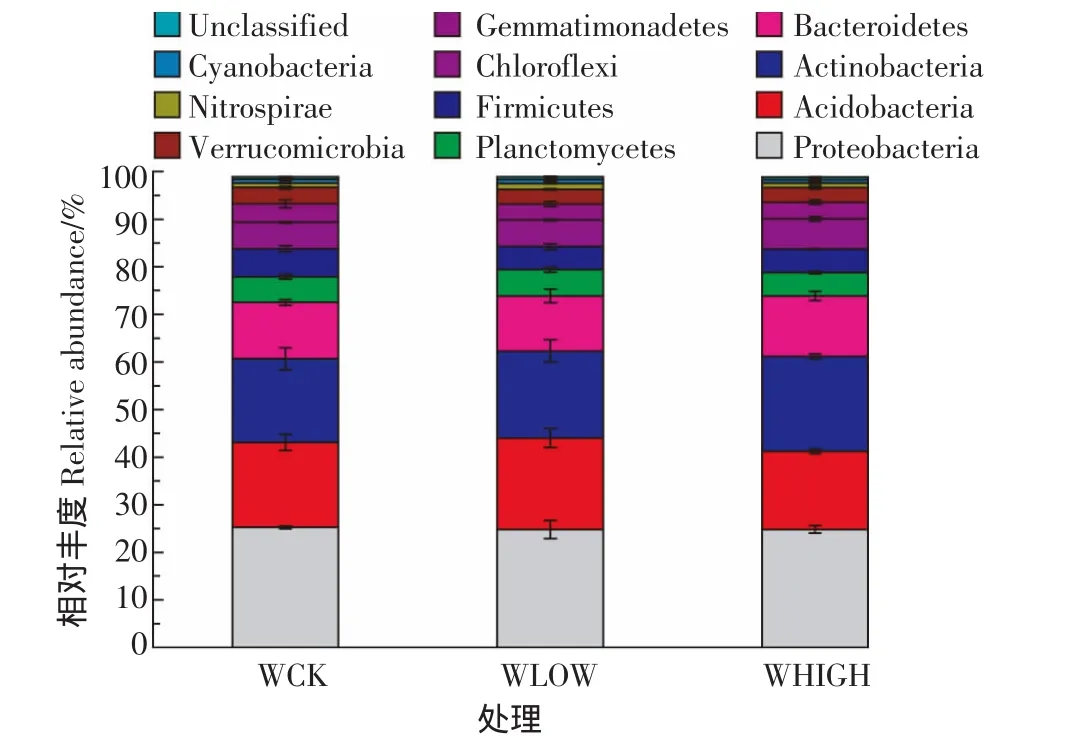
图2 细菌在门水平上的群落结构组成Figure2 The taxonomic composition distribution in samples of phylum-level
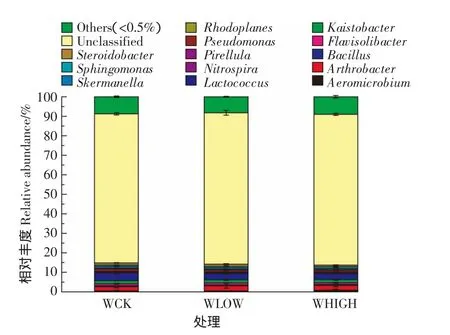
图3 细菌在属水平上的群落组成结构Figure3 The taxonomic composition distribution in samples of genus-level
2.3.4 属水平上的群落组成
属分类水平上共得到15个菌群(图3),未分类菌群平均相对丰度达77%,表明土壤中存在大量新类群。相对丰度小于0.5%归为其他种类的菌群达8.65%。乳球菌属(Lactococcus)是优势菌群,且在WCK处理中的相对丰度居3个处理之首。
对3个处理的OTU进行PCA分析(图4),第一主轴和第二主轴的贡献率分别为15.64%和15.09%。WCK和WLOW处理均处于主轴下方,距离较近,表明两者土壤中细菌的OTU组成相近,WHIGH距WCK和WLOW处理较远,表明其细菌在OTU水平上的群落组成与WCK和WLOW处理差异较大。
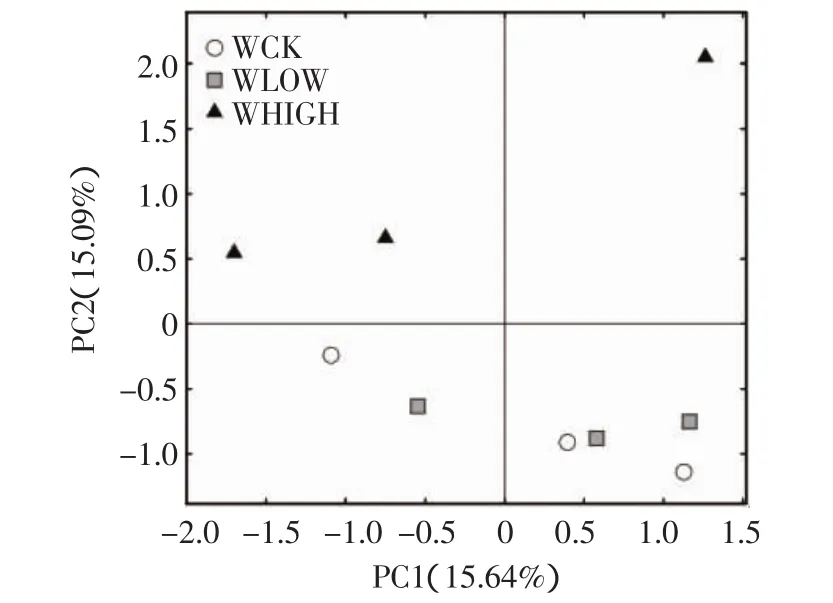
图4 不同浓度处理下的土壤细菌OTU主成分分析Figure4 Principal component analysis(PCA)of OUT in soil bacterial among three treatments
2.4 组间差异物种分析
在属分类水平上对3个处理进行一维方差分析,结果如图5所示。3个处理间共有9个属具有显著性差异(P<0.05),除假单胞菌属(Pseudomonas)和红弧菌属(Skemanella)相对丰度较高外,其余7个属的相对丰度较低(<0.3%);WHIGH和WCK处理相比,3个属有显著差异(P<0.05),分别是:假单胞菌属(Pseudomonas),红弧菌属(Skemanella)和水栖菌属(Enhydrobacter);WLOW 和 WCK 处理相比,水栖菌属(Enhydrobacter)、Lacibacter和贪噬菌属(Variovorax)具有显著差异(P<0.05);WHIGH与WLOW处理之间有5个属具有显著差异(P<0.05),分别是:Balneimonas、壤霉菌属(Agromyces)、水栖菌属(Enhydrobacter)、Devosia和 Flavihumibacter。水栖菌属(Enhydrobacter)在3个处理间差异均显著;壤霉菌属(Agromyces)和Devosia在WHIGH处理中的相对丰度大于WLOW和WCK处理,这两个属分别属于放线菌门(Actinobacteria)和变形菌门(Proteobacteria)。3个处理在属分类水平上呈现较多的低丰度差异显著物种,WHIGH和WCK处理差异物种较多。
2.5 细菌群落与土壤性质的关系
细菌OTU水平群落组成与土壤性质冗余分析(RDA)如图6所示。不同处理下第一主轴和第二主轴对细菌群落相对丰度方差的解释比例分别为14.5%和14.4%,两者共解释28.9%的方差变化。有效态铅和总铅含量、土壤有机质、速效磷和含水量与土壤细菌OTU水平群落组成相关性较大。其中,有效态铅和总铅含量与WHIGH(Pb21W/Pb22W)处理的细菌OTU水平群落组成具有较强的正相关性,而与WCK(CK1W/CK2W/CK3W)和 WLOW(Pb11W/Pb12W)处理的细菌OTU水平群落组成呈较强负相关,WCK(CK1W/CK2W)处理的细菌OTU水平群落组成还与土壤有机质含量呈正相关。
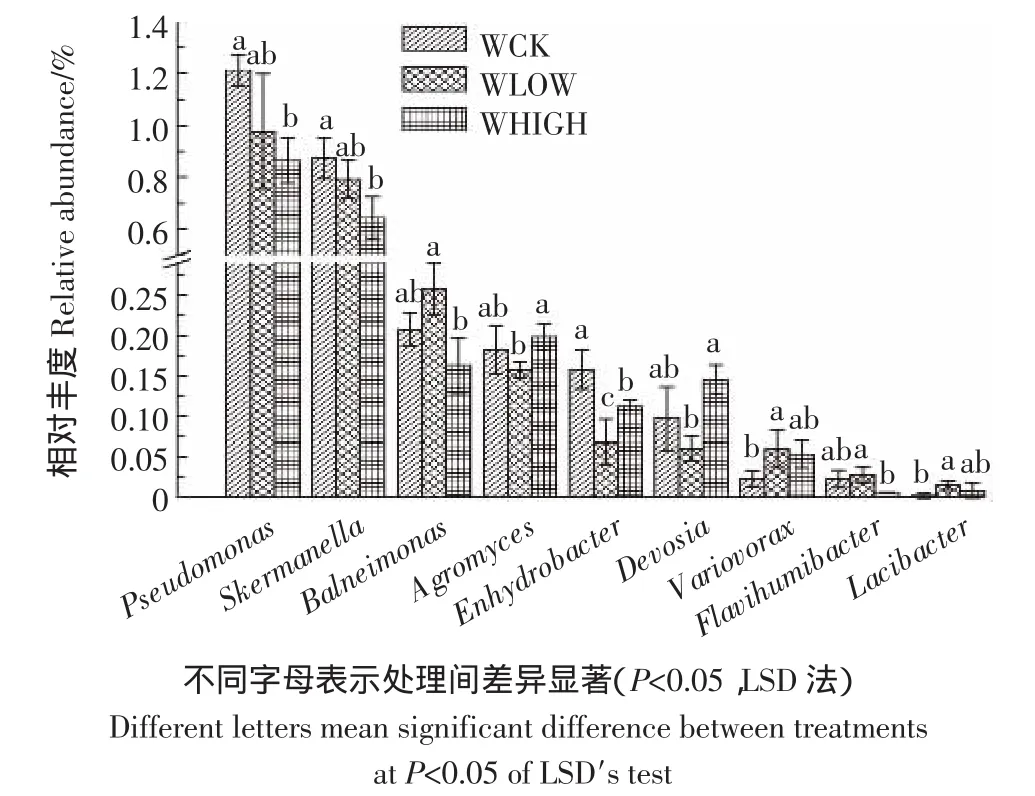
图5 属分类水平上具有显著性差异的物种分析Figure5 Analysis of significant differences at the genus-level
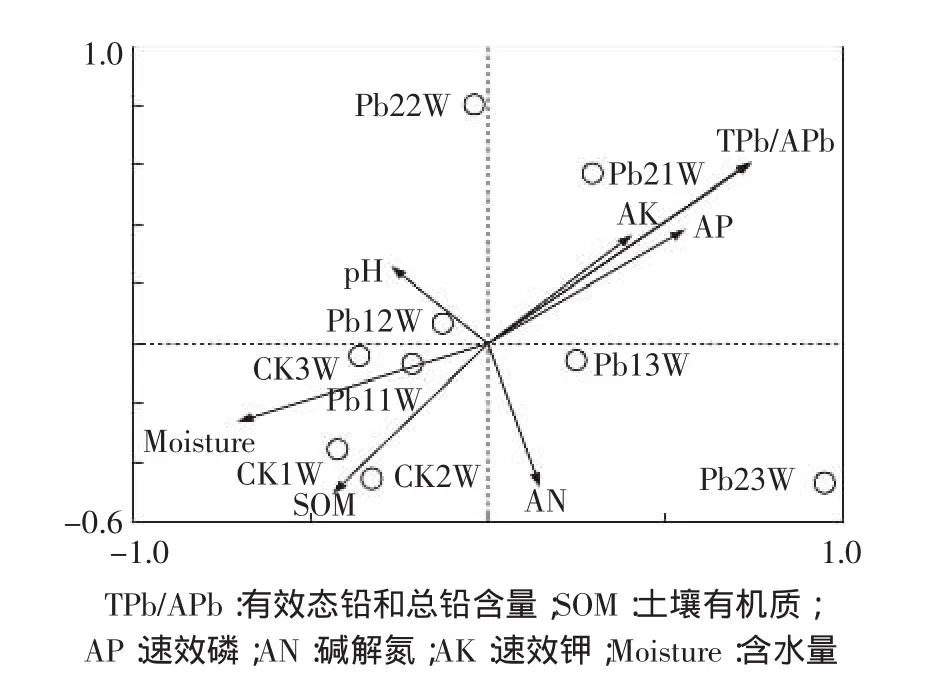
图6 不同铅浓度处理下土壤细菌群落与土壤理化指标的冗余分析Figure6 Redundancy analysis(RDA)of the relationship between the structure of soil microbial communities(relative abundances of OTUs)and environmental variables
在门分类上对菌群(相对丰度>5%)进行Spearman相关性分析,结果如表3所示。有5种细菌与环境因素显著相关,厚壁菌门(Firmicutes)与含水量显著正相关,与速效钾、有效态铅和总铅含量显著负相关,芽单胞菌门(Gemmatimonadetes)与速效钾含量显著负相关,疣微菌门(Verrucomicrobia)与pH显著负相关;速效磷、有效态铅和总铅含量与绿弯菌门(Chloroflexi)和硝化螺旋菌门(Nitrospirae)显著正相关,而硝化螺旋菌门(Nitrospirae)与含水量显著负相关。
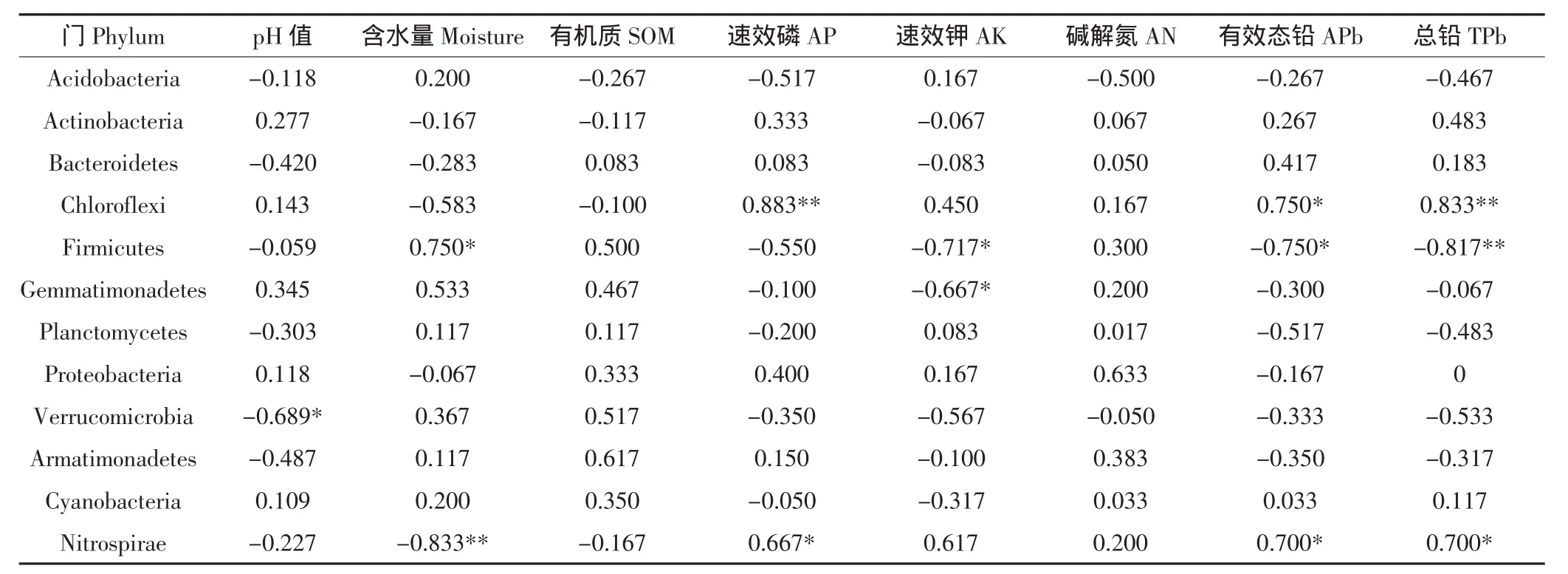
表3 门分类水平上细菌群落与土壤性质的Spearman分析(相对丰度>0.5%)Table3 Spearman′s rank correlations between abundant taxa of phylum-level(RA>0.5%in all samples combined)and soil properties
3 讨论
3.1 土壤铅处理对细菌群落组成的影响
土壤受重金属污染后,微生物群落组成可发生明显变化[2,5,18],但这种影响因土壤类型、重金属污染剂量和污染周期长短而异[10,14,19]。Niklińska 等[19]报道长期受重金属污染的森林土壤微生物群落组成变化不大。本研究的PCA分析显示WCK和WLOW处理的细菌群落结构主成分相似,但WHIGH处理与二者有差异;通过对比丰富度指数(Chao和ACE),也显示出WLOW和WCK处理之间无显著差异,但WLOW与WHIGH处理之间呈显著差异;WHIGH处理的Shannons指数略高于WLOW和WCK处理的相应值,其特有的OTU数为204个(图1),因此WHIGH处理细菌群落多样性略高于WLOW和WCK处理。Golebiewski等[14]报道重金属污染的土壤样品在门和纲的分类水平上不能充分表现出微生物群落变化,需要更低的分类单元描述微生物群落变化,本文在门分类水平上,细菌群落组成除放线菌门(Actinobacteria)和酸杆菌门(Acidobacteria)在三个处理间略有差异外,其余类群在3个处理间大体相似,这与Golebiewski等结论相似;而在属分类水平上,不同处理间才呈现出较多的差异显著物种(图5);且WHIGH与WLOW具有显著差异的属达5种(P<0.05),均为低丰度物种(相对丰度<0.3%),可见本文细菌群落组成的变化主要体现在低丰度菌群发生了显著改变。这也表明高通量技术比常规方法具有更高的灵敏度,能够探测到微生物群落结构的细微变化。
一定程度的重金属污染能改变原有群落内部种群之间的竞争关系,导致优势种群的变更或者产生一部分对重金属有抗性的微生物,从而使土壤微生物群落多样性增加[20]。有文献报道放线菌是PAHs和重金属Pb、Cu和Zn污染土壤中的优势菌群[21]。本文在门、纲和目的分类单元下,放线菌均为优势菌群,其在WHIGH处理的相对丰度高于WLOW和WCK处理,该结果与前人研究结论一致。本文WHIGH处理的β-变形菌纲(Betaproteobacteria)和蓝藻菌纲(Cytophagia)相对丰度均高于WLOW和WCK处理。变形菌门(Proteobacteria)是重金属污染土壤中的优势细菌,可能与其降解代谢及生境广泛有关[15,22-23],蓝藻菌纲(Cytophagia)通常用于处理重金属污染的水体,其可在细胞壁外分泌胞外多糖,从而螯合污染物中的重金属离子[24-25]。WHIGH比WLOW和WCK处理中含有更多的抗性菌,这也可能是WHIGH处理多样性丰富的原因之一。本文抗性菌群的解毒机制有待于今后深入研究。
3.2 细菌群落结构与土壤性质之间的关系
RDA结果显示,有效态铅和总铅含量与WHIGH处理的细菌OTU水平群落组成具有较强的正相关性,与WCK和WLOW处理的细菌OTU水平群落组呈负相关,此结果进一步印证了WHIGH处理含有较多的抗逆菌群。WCK处理的细菌OTU水平群落组成与有机质正相关,有机质可改变土壤孔隙度、通气度与土壤团粒,具有显著的缓冲作用和持水力,可为土壤细菌提供适宜的生长环境[26]。Spearman分析结果显示,土壤pH值、含水量、重金属含量及速效磷、有效钾均与相应的微生物类群有相关性。土壤pH值和含水量主要影响土壤理化反应,从而影响微生物的微生态生存环境,微生物的生长代谢产生一定的化学物质反过来又影响了土壤中化学物质的存在形态和浓度[27-28]。
外源铅进入土壤后受各种物理、化学作用的影响,总体上是由不稳定态向稳定态转变,活性和毒性呈降低趋势[29]。与严重重金属污染土壤,如矿区土壤相比,本试验所添加的重金属含量属于中低等水平,且添加铅已长达3年,虽然3个处理间的铅用量有差异,但并未引起土壤中的细菌群落组成发生显著的剂量效应,此结论与夏月等[20]结论较一致。本文细菌群落组成未发生显著的剂量效应,可能是由于地上部分有作物种植,依据本实验室前期的研究结果,地上部分种植的作物对土壤中的重金属有不同程度的吸收作用[30];还有可能是因为在重金属影响下,根际环境中的pH值、Eh值、根系分泌物也发生了变化,根分泌的粘胶物质与根际中的Pb2+、Cu2+、Cd2+等重金属离子络合,形成稳定的螯合体,将污染物固定在土壤中,进而影响到重金属在土壤-植物-微生物中的迁移转化行为[7,31],使重金属生物可利用毒性降低,从而对土壤微生物群落多样性的影响减小,但具体机制还有待于今后更加深入地研究。本文3个处理间的土壤细菌群落组成有差异,重金属铅应该是造成这个差异的主要因素,土壤环境因素对细菌菌群的改变也产生了一定程度的影响。由于本文添加外源铅浓度较低且经过了较长的周期,土壤微生物可通过改变其群落组成来修复自然界中较低浓度的重金属污染,为今后深入研究微生物修复提供了理论依据。
4 结论
(1)对照和低铅处理的OTU组成较相似,而高铅处理的OTU与前二者差异较大。变形菌门(Proteobacteria,25%)和放线菌门(Actinobacteria,18.60%)在3个处理中均为优势菌群,相对丰度较高的菌群还有酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)和浮霉菌门(Planctomycetes);放线菌纲(Actinobacteria)、β-变形菌纲(Betaproteobacteria)和蓝藻菌纲(Cytophagia)在高铅处理中相对丰度最高。
(2)在属分类水平上具显著差异的菌群有9个(P<0.05),除假单胞菌属(Pseudomonas)和红弧菌属(Skemanella)外(相对丰度>0.6%),Balneimonas、壤霉菌属(Agromyces)、水栖菌属(Enhydrobacter)、Devosia、贪噬菌属(Variovorax)、Flavihumibacter和 Lacibacter均为低丰度菌群(相对丰度<0.3%)。
(3)土壤有效铅和总铅含量与高铅处理的细菌OTU水平群落组呈正相关,而与对照和低铅处理的细菌OTU水平群落组呈负相关;对照的细菌OTU水平群落组成与土壤有机质含量正相关。在门分类水平上,厚壁菌门(Firmicutes)、芽单胞菌门(Gemmatimonadetes)、疣微菌门(Verrucomicrobia)、绿弯菌门(Chloroflexi)和硝化螺旋菌门(Nitrospirae)与土壤环境因素显著相关(P<0.05)。
[1]陈兴兰,杨成波.土壤重金属污染、生态效应及植物修复技术[J].农业环境与发展,2010,27(3):58-62.
CHEN Xing-lan,YANG Cheng-bo.The study of ecological benefits,soil contamination by heavy metals and the phytoremediation technique[J].Agro-Environment&Development,2010,27(3):58-62.
[2]吴建军,蒋艳梅,吴愉萍,等.重金属复合污染对水稻土微生物生物量和群落结构的影响[J].土壤学报,2008,45(6):1102-1109.
WU Jian-jun,JIANG Yan-mei,WU Yu-ping,et al.Effect of complex heavy metal pollution on biomass and community structure of soil microbes in paddy soil[J].Acta Pedologica Sinica,2008,45(6):1102-1109.
[3]陈承利.重金属Cd、Pb、Hg污染对土壤微生物及其活性影响研究[D].杭州:浙江大学,2006:2-3.
CHEN Cheng-li.Effects of cadmium,lead and mercury pollution on soil microorganisms and their activities[D].Hangzhou:Zhejiang University,2006:2-3.
[4]曾路生,廖 敏,黄昌勇,等.外源铅对水稻土微生物量、微生物活性及水稻生长的影响[J].生态环境,2008,17(3):993-998.
ZENG Lu-sheng,LIAO Min,HUANG Chang-yong,et al.Effects of lead contamination on soil microbial biomass,microbial activities and rice growth in paddy soils[J].Ecology and Environment,2008,17(3):993-998.
[5]阎 姝,潘根兴,李恋卿.重金属污染降低水稻土微生物商并改变PLFA群落结构:苏南某地污染稻田的案例研究[J].生态环境,2008,17(5):1828-1832.
YAN Shu,PAN Gen-xing,LI Lian-qing.Decline of microbial biomass quotient and change in microbial PLFA community structure of a rice paddy soil under heavy metal pollution:A case study of a polluted rice paddy from southern Jiangsu,China[J].Ecology and Environment,2008,17(5):1828-1832.
[6]Gough H L,Stahl D A.Microbial community structures in anoxic fresh-water lake sediment along a metal contamination gradient[J].The ISME Journal,2011,5(3):543-558.
[7]Deng L J,Zeng G M,Fan C Z,et al.Response of rhizosphere microbial community structure and diversity to heavy metal co-pollution in arable soil[J].Applied Microbiology&Biotechnology,2015,99(19):8259-8269.
[8]张 红,吕家珑,曹莹菲,等.不同植物秸秆腐解特性与土壤微生物功能多样性研究[J].土壤学报,2014,51(4):743-752.
ZHANG Hong,LÜ Jia-long,CAO Ying-fei,et al.Decomposition characteristics of different plants straws and soil microbial functional diversity[J].Acta Pedologica Sinica,2014,51(4):743-752.
[9]Pan J,Yu L.Effects of Cd or/and Pb on soil enzyme activities and microbial community structure[J].Ecological Engineering,2011,37(11):1889-1894.
[10]Shi W,Becker J,Bischoff M,et al.Association of microbial community composition and activity with lead,chromium,and hydrocarbon contamination[J].Applied and Environmental Microbiology,2002,68(8):3859-3866.
[11]Ye L,Zhang T.Bacterial communities in different sections of a municipal wastewater treatment plant revealed by 16S rDNA 454 pyrosequencing[J].Appl Microbiol Biotechnol,2013,97(6):2681-2690.
[12]Epelde L,Lanzén A,Blanco F,et al.Adaptation of soil microbial community structure and function to chronic metal contamination at an abandoned Pb-Zn mine[J].Fems Microbiology Ecology,2015,91(1):1-11.
[13]Frey B,Stemmer M,Widmer F,et al.Microbial activity and community structure of a soil after heavy metal contamination in a model forest ecosystem[J].Soil Biology&Biochemistry,2006,38(7):1745-1756.
[14]Golebiewski M,Deja-Sikora E,Cichosz M,et al.16S rDNA pyrosequencing analysis of bacterial community in heavy metals polluted soils[J].Microbial Ecology,2014,67(3):635-647.
[15]丁传雨,郑 远,任学敏,等.能源植物修复土壤镉污染过程中细菌群落分析[J].环境科学学报,2016,36(8):3009-3016.
DING Chuan-yu,ZHENG Yuan,REN Xue-min,et al.Changes in bacterial community composition during the remediation of Cd contaminated soils of bioenergy crops[J].Acta Scientiae Circumstantiae,2016,36(8):3009-3016.
[16]鲍士旦.土壤农化分析[M].三版.北京:中国农业出版社,2000:22-107.
BAO Shi-dan.Soil and agricultural chemistry analysis[M].3rd Edition.Beijing:Agriculture Publication,2000:22-107.
[17]Smith C J,Hopmans P,Cook F J.Accumulation of Cr,Pb,Cu,Ni,Zn and Cd in soil following irrigation with treated urban effluent in Australia[J].Environmental Pollution,1996,94(3):317-323.
[18]Chen J,He F,Zhang X,et al.Heavy metal pollution decreases microbial abundance,diversity and activity within particle-size fractions of a paddy soil[J].Fems Microbiology Ecology,2014,87(1):164-181.
[19]Niklińska M,Chodak M,Laskowski R.Characterization of the forest humus microbial community in a heavy metal polluted area[J].Soil Biology&Biochemistry,2005,37(12):2185-2194.
[20]夏 月,Sardar Khan,贺纪正,等.限制性片段长度多态性分析(ARDRA)方法对重金属污染土壤中细菌群落多样性的研究[J].环境科学学报,2007,27(6):953-960.
XIA Yue,Sardar Khan,HE Ji-zheng,et al.Use of amplified ribosomal DNA restriction analysis to study microbial diversity in soils impacted by heavy metals[J].Acta Scientiae Circumstantiae,2007,27(6):953-960.
[21]Bamborough L,Cummings S P.The impact of increasing heavy metal stress on the diversity and structure of the bacterial and actinobacterial communities of metallophytic grassland soil[J].Biology&Fertility of Soils,2009,45(3):273-280.
[22]Kuppusamy S,Thavamani P,Megharaj M,et al.Pyrosequencing analysis of bacterial diversity in soils contaminated long-term with PAHs and heavy metals:Implications to bioremediation[J].Journal of Hazardous Materials,2016,317:169-179.
[23]江玉梅,张 晨,黄小兰,等.重金属污染对鄱阳湖底泥微生物群落结构的影响[J].中国环境科学,2016,36(11):3475-3486.
JIANG Yu-mei,ZHANG Chen,HUANG Xiao-lan,et al.Effect of heavy metals in the sediment of Poyang Lake estuary on microbial communities structure base on Mi-seq sequencing[J].China Environmental Science,2016,36(11):3475-3486.
[24]El-Enany A E,Issa A A.Cyanobacteria as a biosorbent of heavy metals in sewage water[J].Environmental Toxicology&Pharmacology,2000,8(2):95-101.
[25]Philippis R D,Colica G,Micheletti E.Exopolysaccharide-producing cyanobacteria in heavy metal removal from water:Molecular basis and practical applicability of the biosorption process[J].Applied Microbiology&Biotechnology,2011,92(4):697-708.
[26]王佩雯,朱金峰,陈 征,等.高通量测序技术下连作植烟土壤细菌群落与土壤环境因子的耦合分析[J].农业生物技术学报,2016,24(11):1754-1763.
WANG Pei-wen,ZHU Jin-feng,CHEN Zheng,et al.Coupling analysis based on high throughput sequencing technology of soil bacterial community and soil environmental factors in continuous cropping tobacco soil[J].Journal of Agricultural Biotechnology,2016,24(11):1754-1763.
[27]Lauber C L,Hamady M,Knight R,et al.Pyrosequencing-based assessment of soil pH as a predictor of soil bacterial community structure at the continental scale[J].Applied&Environmental Microbiology,2009,75(15):5111-5120.
[28]Kemmitt S J,Lanyon C V,Waite I S,et al.Mineralization of native soil organic matter is not regulated by the size,activity or composition of the soil microbial biomass:A new perspective[J].Soil Biology&Biochemistry,2008,40(1):61-73.
[29]徐明岗,吴 曼,武海雯,等.土壤外源铅的稳定化特征及其对土壤性质的响应[J].农业环境科学学报,2012,31(9):1702-1709.
XU Ming-gang,WU Man,WU Hai-wen,et al.External lead stabilization characteristics in soils and responses to soil properties[J].Journal of Agro-Environment Science,2012,31(9):1702-1709.
[30]Liu K,Lv J L,Dai Y C,et al.Cross-species extrapolation of models for predicting lead transfer from soil to wheat grain[J].PLos One,2016,11(8):e0160552.
[31]徐卫红,黄 河,王爱华,等.根系分泌物对土壤重金属活化及其机理研究进展[J].生态环境,2006,15(1):184-189.
XU Wei-hong,HUANG He,WANG Ai-hua,et al.Advance in studies on activation of heavy metal by root exudates and mechanism[J].Ecology and Environment,2006,15(1):184-189.
